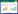文章信息
- 刘宇, 李木, 孔静
- LIU Yu, LI Mu, KONG Jing
- 激活转录因子2对胰腺癌细胞增殖与凋亡的影响
- Effects of the activating transcription factor 2 on pancreatic cancer cells proliferation and apoptosis
- 中国医科大学学报, 2022, 51(10): 919-924
- Journal of China Medical University, 2022, 51(10): 919-924
-
文章历史
- 收稿日期:2021-12-23
- 网络出版时间:2022-09-30 17:52
作为死亡率极高的恶性肿瘤,胰腺癌在欧洲的致死率排名第四。我国胰腺癌致死率虽低于西方国家,但近年来发病率持续上升[1-2]。研究[3]表明,恶性肿瘤细胞的增殖与转移均和激活转录因子2(activated transcription factor 2,ATF2)有关,例如在小鼠模型中发现,ATF2能够通过激活细胞周期蛋白D1来参与雌二醇诱导的乳腺癌细胞增殖;B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)作为代表性的凋亡抑制分子,其启动子区域中的环磷酸腺苷反应元件可以与ATF2特异性结合来参与肿瘤细胞凋亡;在ATF2突变的小鼠中,调节凋亡基因GADD45α的表达也会降低[4]。提示ATF2与恶性肿瘤细胞的增殖和凋亡过程相关。
目前关于胰腺癌细胞中ATF2的表达以及ATF2与胰腺癌细胞增殖和凋亡的关系仍缺乏研究。本研究拟通过检测胰腺癌与癌旁组织中ATF2的表达情况,对比ATF2 shRNA转染前后胰腺癌细胞株的增殖及凋亡情况,进一步探讨ATF2与胰腺癌发生的关系以及对胰腺癌细胞生物学行为的影响。
1 材料与方法 1.1 标本来源胰腺癌及癌旁组织来源于中国医科大学附属第一医院2014至2016年手术治疗的胰腺癌患者,共14例配对标本,均经病理证实为胰腺导管细胞癌。癌旁组织取自距胰腺癌边缘1~2 cm处。所有患者已签署知情同意书,术前未接受放、化疗及免疫治疗。本研究获得中国医科大学医学伦理委员会批准。胰腺癌细胞株ASPC-1购自中国科学院上海细胞库,PANC-1购自上海中乔新舟生物公司。
1.2 方法 1.2.1 细胞的分离、体外培养及ATF2 shRNA转染参考已有胰腺细胞的分离方法[5],将胰腺组织碎块(1 mm3)在适量V型胶原酶(美国Sigma公司)中孵育,而后在含10%胎牛血清的RPMI 1640培养基(美国Hyclone公司)中进行传代培养,为后续RNA的提取做准备。
将ASPC-1及PANC-1细胞复苏放置于37 ℃温箱中(含5%的CO2)进行细胞传代培养,并在24 h后进行ATF2 shRNA质粒和非特异性对照质粒(non-specific control,NC)的转染。ATF2 shRNA片段:5’-GGAGCCUUCUGUUGUAGAAUU-3’。ATF2 NC片段:5’-TTCTCCGAACGTGTCACGT-3’。
用含有10%胎牛血清的DMEM培养基筛选转染稳定的胰腺癌细胞株,并将ASPC-1组细胞(ASPC-1、ASPC-1-NC、ASPC-1-ATF2 shRNA)及PANC-1组细胞(PANC-1、PANC-1-NC、PANC-1-ATF2 shRNA)进行收集,用于后续实验。
1.2.2 细胞RNA提取、反转录及实时PCR检测收集细胞并使用RNA提取试剂盒提取总RNA。以super M-MLV反转录酶进行反转录后,采用ExicyclerTM 96荧光定量仪(韩国BIONEER公司)对ATF2 mRNA水平进行荧光定量分析。β-actin作为内参基因,采用2-ΔΔCt分析法计算胰腺癌及癌旁组织中ATF2 mRNA的表达。以同样方法检测ASPC-1及PANC-1组细胞中ATF2 mRNA表达水平,验证ATF2 shRNA的敲减效率。ATF2正向引物5’-TGGTAGCGGATTGGTTAGG-3’;ATF2反向引物5’-TTGGGTCTGTGGAGTTGG-3’;β-actin正向引物5’-CTTAGTTGCGTTACACCCTTTCTTG-3’;β-actin反向引物5’-CTGTCACCTTCACCGTTCCAGTTT-3’。
1.2.3 Western blotting检测ATF2及p-ATF2蛋白表达参考贺龙梅等[6]的研究,以ATF2、P-ATF2,β-actin抗体为一抗(英国Abcam公司),羊抗兔IgG-HRP为二抗(中国碧云天公司)进行免疫反应。在发光、显影后观察p-ATF2、ATF2及内参β-actin蛋白的表达。以同样方法检测ASPC-1及PANC-1组细胞中ATF2蛋白表达水平,验证ATF2 shRNA敲减效率。
1.2.4 MTT实验测定胰腺癌细胞生长曲线采用MTT法检测ASPC-1及PANC-1组细胞在4 h、24 h、48 h、72 h、96 h、120 h的细胞活力。
1.2.5 胰腺癌细胞平板克隆实验将ASPC-1及PANC-1组细胞培养至肉眼可见细胞克隆团,经多聚甲醛固定及瑞姬氏复合染料染色后,在显微镜下观察各组细胞。
1.2.6 胰腺癌细胞周期检测培养ASPC-1及PANC-1组细胞,参照方法1.2.3,分别以Cyclin A和Cyclin D1抗体作为一抗,羊抗小鼠IgG-HRP作为二抗,采用Western blotting检测各组细胞中Cyclin A和Cyclin D1的表达水平。
1.2.7 胰腺癌细胞凋亡实验检测培养ASPC-1及PANC-1组细胞,参照方法1.2.3,分别以cleaved caspase-3、cleaved PARP、Bax和Bcl-2抗体作为一抗,羊抗兔IgG-HRP作为二抗,采用Western blotting检测各组细胞中细胞凋亡相关蛋白表达水平。
1.3 统计学分析采用Gel-Pro-Analyzer软件对Western blotting图像进行处理,分析目标条带光密度值。采用GraphPad软件进行统计学分析,绘制统计图,数据以x±s表示,组间差异采用独立样本t检验。实时PCR数值分析采用2-ΔΔCt分析法。P < 0.05为差异有统计学意义。
2 结果 2.1 胰腺癌及癌旁组织中ATF2 mRNA的表达水平采用紫外线分光光度计NANO2000(美国Thermo公司)分别检测胰腺癌及癌旁组织提取出的RNA。结果显示RNA纯度良好,可用于后续实验。实时PCR结果显示,胰腺癌组织中ATF2 mRNA的表达(0.001 3±0.000 4)高于癌旁组织(0.000 9±0.000 2),见图 1。
|
| *P < 0.05. 图 1 ATF2 mRNA在胰腺癌组织和癌旁组织中表达情况 Fig.1 Expression levels of ATF2 in pancreatic cancer tissues and adjacent normal tissues |
2.2 胰腺癌及癌旁组织中ATF2和p-ATF2蛋白的表达水平
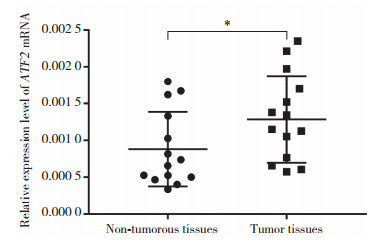
以β-actin为内参,采用Western blotting检测胰腺癌及胰腺癌旁组织中ATF2和p-ATF2蛋白的表达水平(图 2A)。结果显示,胰腺癌组织中ATF2蛋白表达水平(0.50±0.03)较癌旁组织(0.25±0.02)显著上调(图 2B);同时胰腺癌组织中p-ATF2的蛋白表达水平(0.71±0.04)与癌旁组织(0.40±0.03)相比也呈上调趋势(图 2C)。
|
| A, Western blotting results of ATF2 and p-ATF2 in pancreatic cancer (PC) tissues and adjacent normal tissues (ANT); B, ATF2 protein expression in PC tissues and ANT; C, p-ATF2 protein expression in PC tissues and ANT. N, ANT; T, PC tissues.*P < 0.05, **P < 0.01. 图 2 Western blotting检测胰腺癌及癌旁组织中ATF2和p-ATF2蛋白表达 Fig.2 Detection of ATF2 and p-ATF2 levels by Western blotting in the PC tissues and ANT |
2.3 ATF2 shRNA对胰腺癌细胞增殖的抑制作用
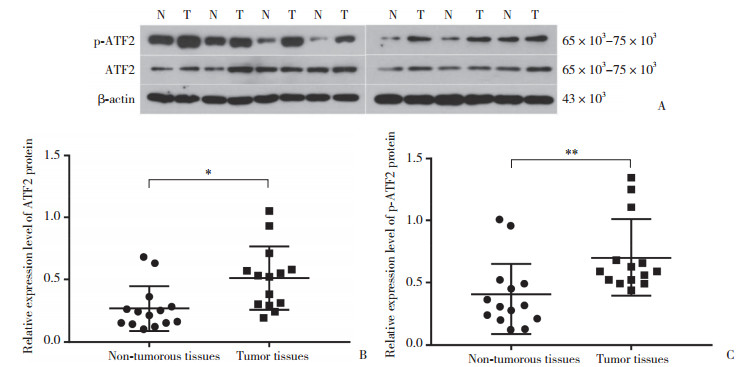
MTT检测结果显示,在转染24 h、48 h、72 h、96 h后ASPC-1-ATF2-shRNA及PANC-1-ATF2-shRNA组细胞增殖与对应NC组相比均显著抑制(P < 0.01)(图 3)。转染120 h后的ASPC-1-ATF2-shRNA组细胞仍受到抑制(P < 0.05)(图 3A),而120 h后PANC-1-ATF2-shRNA组细胞的增殖抑制效果更为显著(P < 0.001)(图 3B)。
|
| A, cellular viability of the ASPC-1 group at different time points; B, cellular viability of PANC-1 group at different time points.*P < 0.05, **P < 0.01. 图 3 ATF2 shRNA对胰腺癌细胞增殖的抑制作用 Fig.3 ATF2 silencing inhibited the proliferation and colony formation of PC cells |
2.4 ATF2 shRNA对胰腺癌细胞周期蛋白的抑制作用
以β-actin为内参,采用Western blotting检测Cyclin A及Cyclin D1蛋白表达水平。结果显示,ASPC-1-ATF-shRNA处理组中Cyclin A(0.67±0.02)及Cyclin D1蛋白表达量(0.53±0.01)与ASPC-1-NC组(1.07±0.03和1.03±0.03)相比均显著下降(P < 0.01)。同时PANC-1-ATF-shRNA处理组Cyclin A蛋白的表达量(0.63±0.02)与对应NC组(1.13±0.03)相比也显著下降(P < 0.01),见图 4。
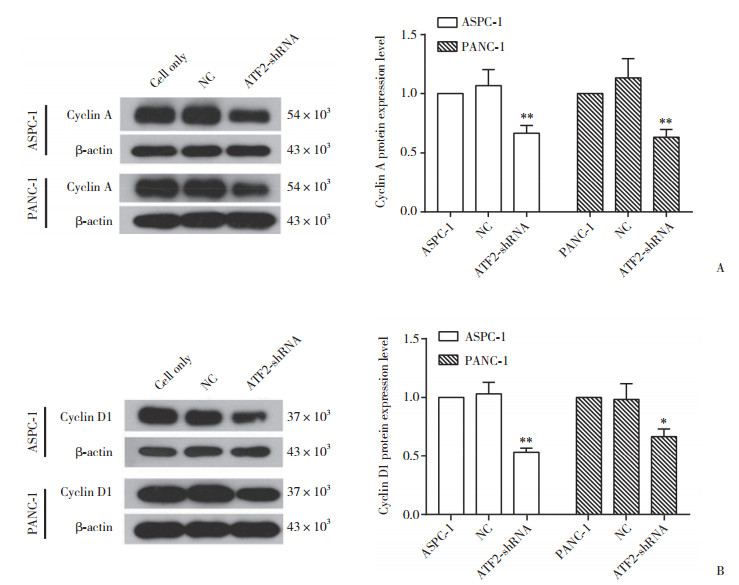
|
| A, Cyclin A protein expression in the ASPC-1 and PANC-1 cells groups; B, Cyclin D1 protein expression in the ASPC-1 and PANC-1 cells groups.*P < 0.05, **P < 0.01 compared with NC group. 图 4 ATF2 shRNA对胰腺癌细胞周期蛋白的抑制作用 Fig.4 Inhibitory effect of ATF2 shRNA on cyclin in pancreatic cancer cells |
2.5 ATF2 shRNA对胰腺癌细胞凋亡的促进作用
采用流式细胞术检测ATF2 shRNA对胰腺癌细胞凋亡的影响,结果显示,ATF2 shRNA PANC-1和ATF2 shRNA ASPC-1中细胞凋亡与NC组相比明显增多(P < 0.01,P < 0.001),见图 5。
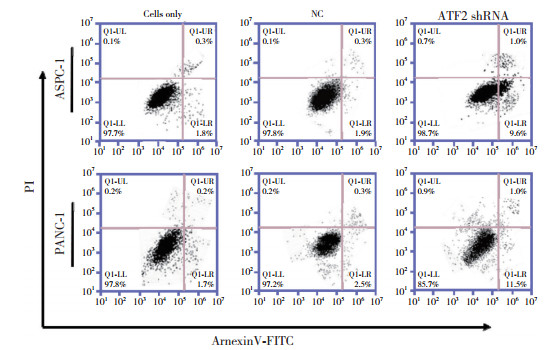
|
| 图 5 流式细胞术显示ATF2 shRNA促进胰腺癌细胞凋亡 Fig.5 Flow cytometry showed that ATF2 shRNA promoted the apoptosis of pancreatic cancer cells |
以β-actin为内参,采用Western blotting检测细胞凋亡相关蛋白,与NC组相比,ATF2 shRNA PANC-1、ATF2 shRNA ASPC-1中cleaved caspase-3、cleaved PARP表达量均上调2倍左右;而Bcl-2的表达量在ATF2 shRNA PANC-1中约下调5倍,见图 6。
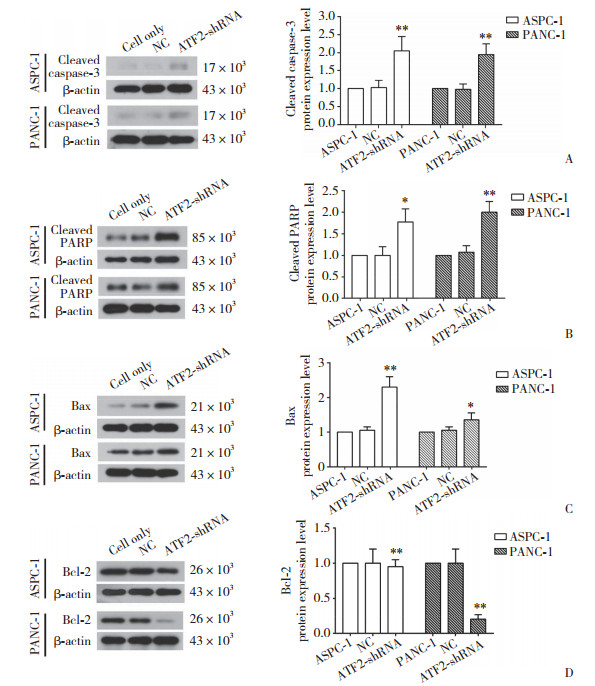
|
| A, expression levels of cleaved caspase-3 protein in ASPC-1 and PANC-1 cells; B, expression levels of cleaved PARP protein in the two groups of cells; C, expression levels of Bax protein in the two groups of cells; D, Bcl-2 protein expression levels. *P < 0.05, **P < 0.01 compared with NC group. 图 6 ATF2 shRNA对胰腺癌细胞凋亡的促进作用 Fig.6 Promoting effect of ATF2 shRNA on the apoptosis of pancreatic cancer cells |
3 讨论
胰腺癌相关诊断和治疗的准确性及有效性在近些年来有显著提升,但其5年生存率仍较低[7]。虽然各种新型治疗方案有效地提高了胰腺癌术后患者的长期预后,但只有15%~20%的患者适合行手术治疗。因此,为了有效提高胰腺癌患者的生存时间和质量,缩短胰腺癌诊断时间,提高诊断的准确性刻不容缓[8-10]。
转录因子是调节细胞基因表达的主导因子,通过与基因组靶点的精准结合影响转录[11]。ATF2作为ATF/cAMP转录因子家族的成员之一,可促进与细胞周期、免疫、炎症反应及细胞凋亡相关的靶基因表达[12]。ATF2已被证实可调节肿瘤上皮细胞的间质转化,参与细胞糖代谢和肿瘤发生,并且能够影响肿瘤细胞的侵袭性[13]。但目前关于ATF2与胰腺癌相关性的研究还鲜有报道。本研究通过实时PCR及Western blotting检测发现,胰腺癌组织中ATF2的mRNA和蛋白的表达水平均高于癌旁组织,表明ATF2可能为胰腺癌的潜在标志基因,在未来的诊断上具有一定的应用价值。
恶性肿瘤具有细胞分化和增殖异常、生长失去控制、细胞凋亡受抑制等特性,关注以上特性是否随某基因表达量的改变而变化,可以进一步证明该基因对癌细胞产生的生物学行为[14]。本研究采用基因沉默技术,构建了ATF2 shRNA表达载体并成功转染了胰腺癌细胞,通过流式细胞仪、Western blotting等检测发现ATF的沉默会改变细胞增殖、周期和凋亡等特性。细胞增殖速率变慢的同时,细胞周期相关蛋白Cyclin A和Cyclin D1的表达也显著降低,这与已有研究[15]关于ATF2可通过调控Cyclin A来影响细胞增值的结论相一致。cleaved PARP为Caspase家族凋亡基因启动子,cleaved-caspase-3是程序性细胞死亡或凋亡的关键介质,2种蛋白表达增加时说明细胞凋亡增加[16]。Bcl-2和Bax作为Bcl-2家族成员,前者具有抑制凋亡的作用,而Bax具有促进凋亡的作用[17]。本研究结果显示,与对照组相比,cleaved caspase-3、cleaved PARP与Bax的蛋白表达水平上调,而Bcl-2的表达下调,这也进一步证实ATF2作为胰腺癌的致癌基因,对细胞凋亡及生长周期有重要影响。
综上所述,ATF2可作为胰腺癌疾病诊断的潜在标志物,也可作为后续治疗的靶标展开深入研究。同时,ATF2作为致癌基因的分子作用机制及其他临床意义有待进一步研究。
| [1] |
MORRISON AH, BYRNE KT, VONDERHEIDE RH. Immunotherapy and prevention of pancreatic cancer[J]. Trends Cancer, 2018, 4(6): 418-428. DOI:10.1016/j.trecan.2018.04.001 |
| [2] |
ZHAO CF, GAO F, LI QW, et al. The distributional characteristic and growing trend of pancreatic cancer in China[J]. Pancreas, 2019, 48(3): 309-314. DOI:10.1097/MPA.0000000000001222 |
| [3] |
LAU E, SEDY J, SANDER C, et al. Transcriptional repression of IFNβ1 by ATF2 confers melanoma resistance to therapy[J]. Oncogene, 2015, 34(46): 5739-5748. DOI:10.1038/onc.2015.22 |
| [4] |
MA J, CHANG K, PENG JT, et al. SPOP promotes ATF2 ubiquitination and degradation to suppress prostate cancer progression[J]. J Exp Clin Cancer Res, 2018, 37(1): 145. DOI:10.1186/s13046-018-0809-0 |
| [5] |
BERTHAULT C, STAELS W, SCHARFMANN R. Purification of pancreatic endocrine subsets reveals increased iron metabolism in beta cells[J]. Mol Metab., 2020, 42: 101060. DOI:10.1016/j.molmet.2020.101060 |
| [6] |
贺龙梅, 蔡晓辉, 王晓倩, 等. CHI3L1在胰腺癌中的表达水平及其与患者预后的关系[J]. 临床医学研究与实践, 2022, 7(23): 1-4. DOI:10.19347/j.cnki.2096-1413.202223001 |
| [7] |
VERSTEIJNE E, VOGEL JA, BESSELINK MG, et al. Meta-analysis comparing upfront surgery with neoadjuvant treatment in patients with resectable or borderline resectable pancreatic cancer[J]. Br J Surg, 2018, 105(8): 946-958. DOI:10.1002/bjs.10870 |
| [8] |
PEIXOTO RD, HO M, RENOUF DJ, et al. Eligibility of metastatic pancreatic cancer patients for first-line palliative intent nab-paclitaxel plus gemcitabine versus FOLFIRINOX[J]. Am J Clin Oncol, 2017, 40(5): 507-511. DOI:10.1097/COC.0000000000000193 |
| [9] |
MCGUIGAN A, KELLY P, TURKINGTON RC, et al. Pancreatic cancer: a review of clinical diagnosis, epidemiology, treatment and outcomes[J]. World J Gastroenterol, 2018, 24(43): 4846-4861. DOI:10.3748/wjg.v24.i43.4846 |
| [10] |
GANDHI NS, FELDMAN MK, LE O, et al. Imaging mimics of pancreatic ductal adenocarcinoma[J]. Abdom Radiol (NY), 2018, 43(2): 273-284. DOI:10.1007/s00261-017-1330-1 |
| [11] |
FRANCOIS M, DONOVAN P, FONTAINE F. Modulating transcription factor activity: interfering with protein-protein interaction networks[J]. Semin Cell Dev Biol, 2020, 99: 12-19. DOI:10.1016/j.semcdb.2018.07.019 |
| [12] |
WATSON G, RONAI ZA, LAU E. ATF2, a paradigm of the multifaceted regulation of transcription factors in biology and disease[J]. Pharmacol Res, 2017, 119: 347-357. DOI:10.1016/j.phrs.2017.02.004 |
| [13] |
REN B, CUI M, YANG G, et al. Tumor microenvironment participates in metastasis of pancreatic cancer[J]. Mol Cancer, 2018, 17(1): 108. DOI:10.1186/s12943-018-0858-1 |
| [14] |
Reardon MJ. Malignant tumor overview[J]. Methodist Debakey Cardiovasc J, 2010, 6(3): 35-37. DOI:10.14797/mdcj-6-3-35 |
| [15] |
ZHANG J, PAN C, XU T, et al. Interleukin 18 augments growth ability via NF-κB and p38/ATF2 pathways by targeting cyclin B1, cyclin B2, cyclin A2, and Bcl-2 in BRL-3A rat liver cells[J]. Gene, 2015, 563(1): 45-51. DOI:10.1016/j.gene.2015.03.010 |
| [16] |
KIM J, JUNG KH, RYU HW, et al. Apoptotic Effects of xanthium strumarium via PI3K/AKT/mTOR pathway in hepatocellular carcinoma[J]. Evid Based Complement Alternat Med, 2019, 2019: 2176701. DOI:10.1155/2019/2176701 |
| [17] |
HASSAN M, WATARI H, ABUALMAATY A, et al. Apoptosis and molecular targeting therapy in cancer[J]. Biomed Res Int, 2014, 2014: 150845. DOI:10.1155/2014/150845 |
 2022, Vol. 51
2022, Vol. 51