文章信息
- 李妍, 张秀春, 赵传胜
- 笑气滥用致周围神经病的神经电生理特征分析
- Neuro-electrophysiological characteristics of peripheral neuropathy induced by nitrous oxide abuse
- 中国医科大学学报, 2022, 51(1): 86-90
- Journal of China Medical University, 2022, 51(1): 86-90
-
文章历史
- 收稿日期:2021-01-07
- 网络出版时间:2021-12-27 20:34
笑气化学名称为一氧化二氮,于1775年由约瑟夫·普里斯特利首次合成。因一氧化二氮具有令人欣快和轻松的特性,化学家汉弗莱·戴维由此发明了“笑气”一词[1]。笑气滥用可引起脊髓病、周围神经病、亚急性脊髓联合变性等多种神经系统并发症[2-4]。越来越多的研究[2-3, 5-6]显示,笑气滥用导致的神经并发症归因于笑气可致维生素B12失活的毒性作用。临床上有笑气滥用史的患者多表现出神经系统症状(麻木或无力),而笑气滥用者常常隐瞒吸入史,临床表现又与多种疾病相似,因此给临床诊断带来困难。
神经电生理检查是周围神经损伤诊断和损伤程度评估的重要方法。目前,对笑气滥用致周围神经病患者的电生理学特征的研究国内鲜有报道。本研究分析了于我科就诊的36例笑气滥用患者的电生理检查结果,总结其神经电生理特征,旨在为笑气滥用致周围神经病的诊断提供参考和依据。
1 材料与方法 1.1 临床资料收集2017年8月至2020年11月于我科诊断为笑气滥用致周围神经病患者(笑气滥用组)的临床资料。纳入标准:(1)笑气滥用时间 > 2周;(2)临床表现为以肢体麻木和无力为主要的神经系统症状,神经电生理检查结果异常;(3)无糖尿病、酒精中毒、3个月内感染史及慢性消化道疾病史。同期收集了2018年至2020年于我院进行电生理检查的36例年龄、性别与笑气滥用组相匹配的健康人作为对照组。纳入标准:(1)年龄18~40岁;(2)具有神经电生理检查结果,并排除可导致多种轻度临床症状的疾病,如肌无力、肌肉疼痛、四肢麻木的周围神经病,肌营养不良,代谢性疾病,周期性瘫痪,脊髓病;(3)无糖尿病、酒精中毒、3个月内感染史及慢性消化道疾病史。
笑气滥用组共纳入36例患者,年龄15~31岁,平均年龄(20.7±4.4)岁。吸入笑气的中位时间为12个月(1~60个月),吸入频率、数量约为1~20罐/d。从初始症状出现至神经电生理检查的中位间隔时间为20 d(7~60 d)。临床表现多为连续性及对称性的肢体麻木和正常活动受限;远端和下肢进行性无力及“手套-袜套样”感觉障碍较近端和上肢严重。根据医学研究委员会(Medical Research Council,MRC)量表[7],肢体肌力为0~3级。患者神经学检查显示四肢位置感、震动觉均有较严重的损害。双下肢腱反射减弱或消失。
笑气滥用组中7例血清维生素B12水平偏低,平均为(118.5±22.9)pmol/L(正常值:145~637 pmol/L)。4例表现为同型半胱氨酸水平升高(正常值:< 13.56 nmol/L),其中2例患者为血清维生素B12水平降低和同型半胱氨酸水平升高并存。另外,2例头部MRI检查,颅内均未见异常;6例颈椎及胸椎MRI检查,其中3例颈段脊髓、1例胸段脊髓内可见斑片状纵向长T2信号,提示存在脱髓鞘性改变;2例腰椎MRI检查未见明显异常。
对照组纳入36例,男20例,女16例,年龄16~36岁,平均年龄为(22.2±4.0)岁。
1.2 神经电生理检查所有神经电生理检查均由一位经验丰富的电生理医生根据标准方法[8],利用肌电描记仪(MEB-9200K,日本Nihon Kohden公司)完成。检测肢体的温度保持在32 ℃以上,运动神经的复合肌肉动作电位(compound muscle action potential,CMAP)由正中神经(腕、肘刺激,拇短展肌记录)、尺神经(腕、肘下、肘上刺激,小指展肌记录)、腓总神经(中踝和腓头下刺激,趾短伸肌记录)和胫神经(内踝、腘窝刺激,踇展肌记录)产生。感觉神经传导的检测采用顺向记录法,分别从正中神经(中指、掌心刺激,腕部记录)、尺神经(小指刺激,腕部记录)和腓肠神经(外踝刺激,小腿近端11 cm记录)测得。
记录的电生理参数包括远端潜伏期(distal motor latency,DML)、运动神经传导速度(motor nerve conduction velocity,MNCV)、远端刺激后复合肌肉动作电位(compound muscle action potential after distal stimulation,dCMAP)波幅、近端刺激后复合肌肉动作电位(compound muscle action potential after proximal stimulation,pCMAP)波幅、感觉神经传导速度(sensory nerve conduction velocity,SNCV)和感觉神经动作电位(sensory nerve action potential,SNAP)波幅。
超出正常参考值的平均值±2个标准差定义为异常[9]。DML延长、MNCV及SNCV减慢以及CAMP及SNAP波幅降低程度计算方法:(实际测量值-正常参考值)/正常参考值×100%。
1.3 统计学分析利用软件GraphPad Prism 7.04对数据进行统计分析。计量资料采用x±s表示,2组比较采用独立样本t检验。计数资料采用率(%)表示,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 笑气滥用组与对照组神经电生理特征比较与对照组比较,笑气滥用组运动神经DML延长,MNCV及SNCV减慢(均P < 0.01)。除尺神经外,笑气滥用组正中神经、腓总神经、胫神经的dCMAP及pCMAP波幅均较对照组降低(均P < 0.01)。2组正中神经、尺神经及腓肠神经的SNAP波幅比较无统计学差异(均P > 0.05)。见表 1。
| 项目 | 笑气滥用组(n = 36) | 对照组(n = 36) |
| 正中神经 | ||
| DML(ms) | 3.6±0.71) | 3.0±0.3 |
| MNCV(m/s) | 51.8±6.11) | 62.5±6.9 |
| dCMAP(mV,腕) | 14.2±4.51) | 17.7±4.5 |
| pCMAP(mV,肘) | 12.9±5.11) | 17.4±4.5 |
| SNCV(m/s,中指) | 48.2±5.81) | 57.0±4.8 |
| SNCV(m/s,掌) | 31.2±6.91) | 60.9±5.8 |
| SNAP(µV,中指) | 10.1±6.2 | 15.8±9.5 |
| SNAP(µV,掌) | 23.9±13.8 | 32.3±16.1 |
| 尺神经 | ||
| DML(ms) | 2.7±0.31) | 2.3±0.2 |
| MNCV(m/s,腕-肘下) | 52.6±5.51) | 62.2±5.1 |
| MNCV(m/s,肘下-肘上) | 57.7±10.81) | 64.8±10.5 |
| dCMAP(mV,腕) | 13.2±3.2 | 12.5±3.3 |
| pCMAP(mV,肘下) | 12.3±3.1 | 12.3±2.9 |
| pCMAP(mV,肘上) | 12.2±2.9 | 12.6±3.0 |
| SNCV(m/s) | 44.4±6.11) | 51.6±4.1 |
| SNAP(µV) | 7.9±4.3 | 10.2±4.6 |
| 胫神经 | ||
| DML(ms) | 5.3±1.31) | 3.4±0.4 |
| MNCV(m/s) | 35.5±5.91) | 50.4±3.5 |
| dCMAP(mV,踝) | 5.6±5.91) | 8.9±4.5 |
| pCMAP(mV,腘窝) | 4.2±4.61) | 8.2±4.3 |
| 腓总神经 | ||
| DML(ms) | 5.9±1.61) | 3.7±0.6 |
| MNCV(m/s) | 36.2±5.51) | 49.9±3.6 |
| dCMAP(mV,踝) | 2.9±3.61) | 21.8±6.8 |
| pCMAP(mV,腓骨小头下) | 2.3±3.11) | 19.0±6.3 |
| 腓肠神经 | ||
| SNCV(m/s) | 40.3±8.61) | 48.9±5.3 |
| SNAP(µV) | 8.9±6.0 | 13.8±8.0 |
| 1)与对照组比较,P < 0.05. | ||
2.2 笑气滥用组神经异常率及异常程度
结果显示,运动神经的异常主要发生在下肢,腓总神经、胫神经的DML(83.3%、52.8%)、MNCV(69%、72%)和CMAP波幅(80.6%、66.7%)的异常率明显高于正中神经和尺神经(均P < 0.05)。见表 2。
| 指标 | 运动神经 | |||
| 正中神经 | 尺神经 | 腓总神经 | 胫神经 | |
| DML | 14(38.9) | 9(25.0) | 30(83.3)1),2) | 19(52.8)1),2) |
| MNCV | 7(19.0) | 5(13.0) | 25(69.0) 1),2) | 26(72.0) 1),2) |
| CAMP波幅 | 3(8.3) | 1(2.8) | 29(80.6)1),2) | 24(66.7)1),2) |
| 1)与正中神经比较,P < 0.05;2)与尺神经比较,P < 0.05. | ||||
感觉神经中,正中神经、尺神经及腓肠神经的SNCV异常率分别为55.6%(20例)、66.7%(24例)、47.2%(14例);SNAP波幅的异常率分别为72.2%(26例)、52.8%(19例)、25.0%(9例)。异常主要发生在上肢,正中神经、尺神经SNAP的异常率高于腓肠神经(P < 0.05),但正中神经、尺神经及腓肠神经的SNCV的异常率比较无统计学差异(均P > 0.05)。
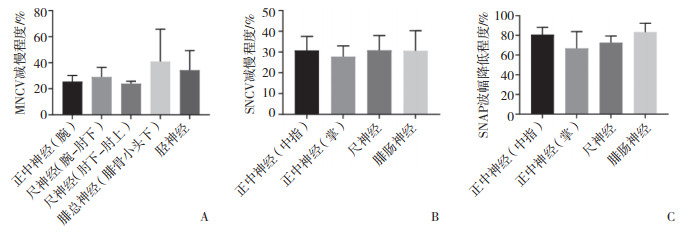
笑气滥组正中神经、尺神经、腓总神经、胫神经DML延长程度分别为36.9%±17.4%、32.3%±7.7%、108.8%±57.1%、55.3%±34.0%。与腓总神经比较,正中神经、尺神经、胫神经DML延长程度差异均有统计学意义(P分别为 < 0.001、0.028、0.017)。可见,下肢神经的DML延长程度高于上肢,以腓总神经的延长程度最为显著。正中神经(腕、肘)、腓总神经(踝、腓骨小头下)、胫神经(踝、腘窝)CMAP波幅降低程度分别为72.0%±12.5%、73.5%±10.1%、91.5%±11.1%、90.8%±12.2%、90.7%±9.3%、90.2%±10.7%。下肢CMAP(dCMAP、pCMAP)波幅下降程度均高于上肢(均P < 0.05)。
上下肢MNCV、SNCV减慢程度以及SNAP波幅下降程度比较均无统计学差异(均P > 0.05)。见图 1。
|
| A,MNCV减慢程度;B,SNCV减慢程度;C,SNAP波幅降低程度. 图 1 笑气滥用组各神经的MNCV、SNCV减慢程度及SNAP波幅降低程度比较 |
3 讨论
本研究结果显示,具有笑气滥用史患者的临床表现多为对称性肢体麻木和正常活动受限,且远端肢体重于近端,下肢重于上肢。电生理检查结果表现为下肢腓总神经及胫神经的DML、MNCV和CMAP波幅异常率均高于上肢正中神经和尺神经(均P < 0.05)。另外,腓总神经DML延长程度最显著,下肢CMAP波幅的降低程度也明显高于上肢,与临床症状一致。临床上DML和MNCV用于评价髓鞘功能,而CMAP波幅反映轴索功能,本研究结果提示笑气滥用造成的神经损伤呈“长度依赖性”,且轴索及髓鞘均有受累,与以往研究[3, 10-12]结果相近。
研究显示,笑气滥用引起的神经病变作用机制为一氧化二氮通过阻断蛋氨酸合酶(通过甲基化过程将同型半胱氨酸转化为蛋氨酸)造成维生素B12失活[13],导致维生素B12水平降低;“功能性”维生素B12缺乏阻止了髓鞘蛋白的甲基化,导致髓鞘减少和髓鞘形成异常[14]。这些机制可能是笑气滥用患者各神经DML和MNCV异常的原因。此外,最近的一项研究[16]显示笑气对结旁区具有毒性作用,可致神经纤维功能丧失或传导阻滞,推测此毒性作用也可能是导致神经传导速度减慢的原因之一。
本研究结果显示笑气滥用患者CMAP波幅异常,提示可能存在运动神经轴索损伤。CMAP波幅降低可能是由于阻断蛋氨酸代谢或影响结旁区的毒性所致[15]。此外,大多数与毒性或维生素缺乏相关的神经病变的特征主要为长度依赖的轴突损害,后期出现继发性脱髓鞘[16]。此病理特征已由腓肠神经活检证实[17],这可能也是笑气滥用患者CMAP异常的机制。
综上所述,笑气滥用可引起对称性肢体麻木和活动受限且远端重于近端。其电生理检查结果表现为DML延长,MNCV及SNCV减慢,CMAP及SNAP波幅降低,异常程度与其临床症状的严重程度一致。因此电生理检查可作为诊断及评估笑气滥用引起周围神经损害的重要手段。
本研究不足之处:样本量较小,且神经电生理评估结果仅提示功能异常,仅凭神经电生理结果并不能鉴别哪一种损伤(髓鞘损伤或轴索损伤)更为严重。因此,今后需扩大样本量,同时增加肌电图检查进一步研究论证。
| [1] |
RANDHAWA G, BODENHAM A. The increasing recreational use of nitrous oxide: history revisited[J]. Br J Anaesth, 2016, 116(3): 321-324. DOI:10.1093/bja/aev297 |
| [2] |
GARAKANI A, JAFFE RJ, SAVLA D, et al. Neurologic, psychiatric, and other medical manifestations of nitrous oxide abuse: a systematic review of the case literature[J]. Am J Addict, 2016, 25(5): 358-369. DOI:10.1111/ajad.12372 |
| [3] |
THOMPSON AG, LEITE MI, LUNN MP, et al. Whippits, nitrous oxide and the dangers of legal highs[J]. Pract Neurol, 2015, 15(3): 207-209. DOI:10.1136/practneurol-2014-001071 |
| [4] |
CHOI C, KIM T, PARK KD, et al. Subacute combined degeneration caused by nitrous oxide intoxication: a report of two cases[J]. Ann Rehabil Med, 2019, 43(4): 530-534. DOI:10.5535/arm.2019.43.4.530 |
| [5] |
MORRIS N, LYNCH K, GREENBERG SA. Severe motor neuropathy or neuronopathy due to nitrous oxide toxicity after correction of vitamin B12 deficiency[J]. Muscle Nerve, 2015, 51(4): 614-616. DOI:10.1002/mus.24482 |
| [6] |
FANG X, LI W, GAO H, et al. Skin hyperpigmentation: a rare presenting symptom of nitrous oxide abuse[J]. Clin Toxicol (Phila), 2020, 58(6): 476-481. DOI:10.1080/15563650.2019.1665181 |
| [7] |
MOORE GF, AUDREY S, BARKER M, et al. Process evaluation of complex interventions: medical research council guidance[J]. BMJ, 2015, 350: h1258. DOI:10.1136/bmj.h1258 |
| [8] |
WANG TY, CHEN SC, PENG CW, et al. Relevance of nerve conduction velocity in the assessment of balance performance in older adults with diabetes mellitus[J]. Disabil Rehabil, 2017, 39(5): 419-427. DOI:10.3109/09638288.2016.1146352 |
| [9] |
BAO L, LI Q, LI QJ, et al. Clinical, electrophysiological and radiological features of nitrous oxide-induced neurological disorders[J]. Neuropsychiatr Dis Treat, 2020, 16: 977-984. DOI:10.2147/NDT.S236939 |
| [10] |
董明睿, 王丽, 孙青, 等. 一氧化二氮滥用所致周围神经病的神经电生理特点[J]. 中国神经免疫学和神经病学杂志, 2019, 26(2): 116-120, 125. DOI:10.3969/j.issn.1006-2963.2018.02.009 |
| [11] |
HEW A, LAI E, RADFORD E. Nitrous oxide abuse presenting with acute psychosis and peripheral neuropathy[J]. Aust N Z J Psychiatry, 2018, 52(4): 388. DOI:10.1177/0004867417748752 |
| [12] |
RICHARDSON PG. Peripheral neuropathy following nitrous oxide abuse[J]. Emerg Med Australas, 2010, 22(1): 88-90. DOI:10.1111/j.1742-6723.2009.01262.x |
| [13] |
XIANG Y, LI L, MA X, et al. Recreational nitrous oxide abuse: prevalence, neurotoxicity, and treatment[J]. Neurotoxicity Res, 2021, 39(3): 975-985. DOI:10.1007/s12640-021-00352-y |
| [14] |
GREEN R, ALLEN LH, BJØRKE-MONSEN AL, et al. Vitamin B12 deficiency[J]. Nat Rev Dis Primers, 2017, 3(1): 1-20. DOI:10.1038/nrdp.2017.40 |
| [15] |
TANI J, WENG HY, CHEN HJ, et al. Elucidating unique axonal dysfunction between nitrous oxide abuse and vitamin B12 deficiency[J]. Front Neurol, 2019, 10: 704. DOI:10.3389/fneur.2019.00704 |
| [16] |
STAFF NP. Peripheral neuropathies due to vitamin and mineral deficiencies, toxins, and medications[J]. Continuum Minneap Minn, 2020, 26(5): 1280-1298. DOI:10.1212/CON.0000000000000908 |
| [17] |
SECHIG, FOISC, ADDISA, et al. Clinicopathologic features of folate-deficiency neuropathy[J]. Neurology, 2015, 85(12): 1090-1091. DOI:10.1212/01.wnl.0000471972.90236.b6 |
 2022, Vol. 51
2022, Vol. 51