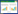文章信息
- 冯靖雯, 杨泽, 杨柯, 张扬
- FENG Jingwen, YANG Ze, YANG Ke, ZHANG Yang
- 317L-Cu抗菌不锈钢对小鼠成纤维细胞生物学行为的影响
- Influence of 317L-Cu antibacterial stainless steel on biological behavior of fibroblasts in mice
- 中国医科大学学报, 2022, 51(1): 59-64
- Journal of China Medical University, 2022, 51(1): 59-64
-
文章历史
- 收稿日期:2021-05-12
- 网络出版时间:2021-12-27 20:40
2. 中国科学院金属研究所前沿材料研究部, 沈阳 110016
2. Division of Frontier Materials, Institute of Metal Research, Chinese Academy of Sciences, Shenyang 110016, China
研究[1]显示,口腔菌群呈动态平衡状态。口腔治疗中使用的各种金属固定装置会导致患者口腔清洁能力下降,同时改变口内菌群环境,使细菌数量增加、菌斑滞留,导致炎症发生[2-3]。因此,研究者[4-5]在金属表面制备抗生素涂层或注入金属离子,从而有效减少感染的发生。CHAI等[6]将微量的Cu2+注入医用不锈钢中,研发了一种含有4.5%Cu2+的317L-Cu新型抗菌不锈钢(00Cr19Ni13Mo3-4.5 wt pct Cu,317L-Cu SS)。研究表明,317L-Cu SS不仅广谱抗菌性能优异,抗菌效果持久,且因其所含Cu2+高于316L-Cu约1%~2%而具有更加优良的耐腐蚀性和可加工性。317L-Cu SS有望应用于临床,特别是对于患有全身代谢性疾病的种植体周围炎易感人群意义重大。
对于新材料安全性、有效性的评价,除机械、物理和化学性能之外,生物相容性同样至关重要。含有微量Cu2+的317L-Cu SS的生物相容性符合标准是应用于正畸临床治疗的前提条件。本研究采取细胞形态学观察、活细胞计数试剂盒CCK-8法、流式细胞仪Annexin V-FITC /PI双染法及吖啶橙细胞黏附实验,探讨317L-Cu SS对小鼠成纤维细胞生物学行为(生长、增殖、黏附、凋亡)的影响。
1 材料与方法 1.1 材料小鼠成纤维细胞L-929购自中国医科大学中心实验室。5种金属材料包括317L-Cu SS、医用不锈钢(00Cr19Ni13Mo3,317L SS)、纯铜(99.95 Cu,Cu)、医用纯钛(99Ti,Ti)、铅(98.2Pb,Pb)。所有金属材料均购自中国科学院金属研究所。
1.2 方法 1.2.1 金属试件制备将5种金属材料分别制作成为直径30 mm、厚度1 mm的圆片,每种各5片,用于细胞增殖活性检测和细胞凋亡实验。另将5种金属材料分别制成直径10 mm、厚度1 mm的圆片,每种各10片,用于细胞黏附实验。
1.2.2 金属浸提液制备无菌条件下将制备完成的金属试件放于培养板中,金属表面积与培养液配比3 cm2∶1 mL为浸提液制备标准。
1.2.3 CCK-8法细胞毒性检测及细胞形态学观察实验分为6组,RPMI1640培养液组(阴性对照组)、Ti组、317L-Cu SS组、317L SS组、Cu组、Pb组(阳性对照组)。L-929细胞生长至对数生长期,将其制备成悬液并接种于培养板中,每孔加入相应的金属浸提液或培养液进行培养。培养至24 h、48 h、72 h时对细胞形态进行观察及细胞毒性检测。在490 nm波长下酶标仪法测量各孔吸光度(optical density,OD)值,相对增殖率(relative growth rate,RGR)计算方法[7]:RGR=ODe/ODc×100%,ODe为实验组、阳性对照组平均OD值,ODc为阴性对照组OD值。
1.2.4 细胞黏附实验将细胞分为4组,Ti组、317L-Cu SS组、317L SS组、Cu组。4种金属试件置于无菌24孔培养板中,材料表面接种L-929细胞,在培养至24 h、48 h、72 h时各组取出1块培养板进行吖啶橙染色,荧光显微镜下观察细胞黏附情况。
1.2.5 细胞凋亡实验将细胞分为阴性对照组、Ti组、317L-Cu SS组、317L SS组、Cu组5组。培养L-929细胞长满约80%孔底面积时,阴性对照组更换为原RPMI1640培养液,而其他组更换为金属浸提液,继续培养48 h后移除各孔中的金属浸提液或培养液,重悬细胞,使用AnnexinⅤ-FITC /PI双标记流式细胞仪测定细胞凋亡情况。
1.3 统计学分析使用SPSS 17.0统计软件进行统计分析,计量资料采用x±s表示,组间比较采用t检验或方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 各组细胞形态学比较倒置相差显微镜下观察L929细胞在培养24、48、72 h后6种材料浸提液中的细胞形态,结果显示,阴性对照组细胞生长旺盛。与阴性对照组比较,Ti组、317L-Cu SS组、317L SS组细胞生长速度略慢,但贴壁生长情况良好,随培养时间延长偶见少量细胞的细胞核固缩;Cu组细胞异常,呈空泡状中毒样;阳性对照组多见重度中毒样的悬浮死细胞,见图 1。

|
| 图 1 各组L929细胞培养24、48、72 h后的形态学比较×40 Fig.1 Morphological comparison of L929 cells in each group at 24, 48, and 72 h ×40 |
2.2 各组细胞毒性比较
CCK-8法检测6种材料浸提液培养24、48、72 h后的L929细胞OD值,结果显示,除Cu组和阳性对照组外,其他4组随着培养时间的延长L929细胞OD值均增加。在培养24 h、72 h后317L-Cu SS组L929细胞OD值低于Ti组(P < 0.05),而培养48 h后2组比较差异无统计学意义(P > 0.05)。317L SS组L929细胞OD值低于317L-Cu SS组(P < 0.05)。Cu组、阳性对照组L929细胞OD值均明显低于其他组(均P < 0.05)。见图 2。
|
| *P < 0.05 vs 317L-Cu SS group. 图 2 各组培养24、48、72 h后L929细胞OD值比较 Fig.2 Comparison of optical density values of L929 cells in each group at 24, 48, and 72 h |
由OD值计算出各组细胞培养24、48、72 h的相对增殖率及细胞毒性。结果显示,Ti组、317L-Cu SS组、317L SS组细胞毒性等级均为1级,无明显细胞毒性;Cu组、阳性对照组细胞毒性等级为3级或4级,表现出较明显的细胞毒性。见表 1。
| Group | Cell proliferation rate(%) | Toxicity classification | |||||
| 24 h | 48 h | 72 h | 24 h | 48 h | 72 h | ||
| Negative control | 100 | 100 | 100 | 0 | 0 | 0 | |
| Ti | 98 | 98.1 | 97.7 | 1 | 1 | 1 | |
| 317L-Cu SS | 93.4 | 95.3 | 93.9 | 1 | 1 | 1 | |
| 317L SS | 89.6 | 91.3 | 89.7 | 1 | 1 | 1 | |
| Cu | 35.4 | 28.9 | 25.1 | 3 | 4 | 4 | |
| Positive control | 34.6 | 28.4 | 24.6 | 3 | 4 | 4 | |
2.3 AnnexinⅤ-FITC/PI双标记流式细胞仪检测细胞凋亡
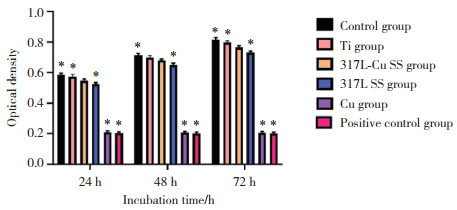
结果显示,各组凋亡细胞分布不均匀。阴性对照组、Ti组、317L-Cu SS组、317L SS组、Cu组的细胞凋亡率分别为(1.89±0.12)%、(2.28±0.13)%、(2.72± 0.19)%、(5.20±0.27)%、(38.77±1.99)%。阴性对照组、Ti组、317L-Cu SS组间细胞凋亡率差异无统计学意义(均P > 0.05),而其他各组间差异有统计学意义(均P < 0.05),见图 3。
|
| A, negative control group; B, Ti group; C, 317L-Cu SS group; D, 317L SS group; E, Cu group. 图 3 各组凋亡细胞流式细胞仪检测结果 Fig.3 Flow cytometry results of apoptotic cells in each group |
2.4 各组L929细胞的黏附情况
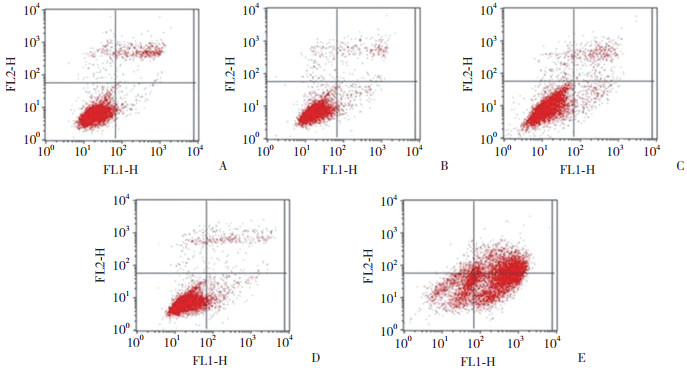
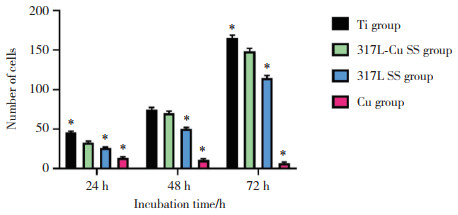
结果显示,随着培养时间的延长,Ti组、317L-Cu SS组、317L SS组黏附细胞数量逐渐增加,而Cu组逐渐减少。与Ti组比较,细胞培养24、48 h 317L-Cu SS组黏附细胞数量减少(P < 0.05),而在培养48 h时,2组差异无统计学意义(P > 0.05)。各时间点317L SS组黏附细胞数量均少于317L-Cu SS组(均P < 0.05)。各时间点Cu组细胞黏附数量明显少于其他各组(均P < 0.05),见图 4、5。
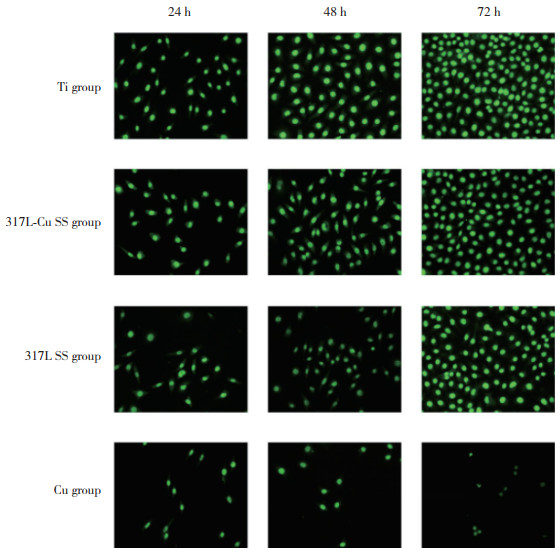
|
| 图 4 L929细胞培养24、48、72 h时各组的黏附情况比较×200 Fig.4 Comparison of the adhesion of L929 cells in each group at 24, 48, and 72 h ×200 |
|
| *P < 0.05 vs 317L-Cu SS group. 图 5 L929细胞培养24、48、72 h时各组黏附的细胞数量比较 Fig.5 Comparison of the number of adherent L929 cells in each group at 24, 48, and 72 h |
3 讨论
近年来,微种植体支抗广泛应用于正畸临床治疗中[8],然而种植体与天然牙在结构上有本质的区别,它的表面无牙骨质且无牙周膜纤维附着,生物屏障作用较弱,容易产生感染。为减少细菌感染的发生,本研究采用的317L-Cu SS是传统结构材料和功能材料完美结合的新一代抗菌不锈钢,与以往的抗菌不锈钢比较,其Cu2+含量更接近饱和注入量。体内和体外研究[9-11]已证实317L-Cu SS能够阻止细菌的黏附或在黏附的短期内有效杀灭金黄色葡萄球菌、大肠埃希菌等常见致病菌,具有比传统医用不锈钢材料更加优越的抗菌性、可加工性和耐腐蚀性。
细胞形态变化是启动一系列细胞生物学行为的信号,细胞的生物学行为包括细胞增殖、凋亡和坏死。体外细胞毒性实验对评价材料生物相容性具有重要意义,已有研究[12]报道,Cu2+的细胞毒性具有浓度依赖性。本研究探讨了317L-Cu SS的生物相容性。结果显示,317L-Cu SS组细胞凋亡率与阴性空白对照组、Ti组比较无统计学差异(均P > 0.05),而低于317L-SS组(P < 0.05),说明微量的Cu2+不促进或仅轻微促进细胞凋亡。Cu组凋亡率明显高于其他各组(均P < 0.05),说明高剂量的Cu2+可以诱导细胞凋亡,对细胞的正常生物学行为产生影响,与以往研究结果一致。
细胞能否大量黏附于金属材料表面也是评价植入材料生物相容性的重要指标。本研究结果显示,细胞培养24、48 h时317L-Cu SS组材料表面黏附的细胞数量少于Ti组(均P < 0.05),而在细胞培养72 h时2组材料表面黏附细胞数量差异无统计学意义(P > 0.05)。同时与317L SS组比较,317L-Cu SS组材料表面黏附的细胞数量增加(P < 0.05),且细胞形态良好,证明317L-Cu SS材料表面较317L SS更有利于细胞黏附。分析其原因可能是材料中含有的微量Cu2+参与了细胞代谢活动,加强了细胞的黏附。
综上所述,Cu2+的细胞毒性表现为双向性,纯铜材料具有明显的细胞毒性,但含有微量Cu2+的317L-Cu SS对细胞的形态、黏附、增殖、凋亡等一系列生物学行为无明显不良影响,且生物相容性良好,满足了口腔生物材料的临床应用要求。本研究仅局限于细胞水平,今后还需进一步论证。
| [1] |
ALNAZEH A, KAMRAN MA, ALSHAHRANI I, et al. Effect of fixed orthodontic appliance therapy on periodontal health status of patients evaluated through community periodontal index[J]. J Biol Regul Homeost Agents, 2020, 34(3): 1067-1070. DOI:10.23812/20-154-l-27 |
| [2] |
HEPYUKSELEN BG, CESUR MG. Comparison of the microbial flora from different orthodontic archwires using a cultivation method and PCR: a prospective study[J]. Orthod Craniofac Res, 2019, 22(4): 354-360. DOI:10.1111/ocr.12335 |
| [3] |
NIENKEMPER M, WILLMANN JH, BECKER K, et al. RFA measurements of survival midpalatal orthodontic mini-implants in comparison to initial healing period[J]. Prog Orthod, 2020, 21(1): 1-7. DOI:10.1186/s40510-020-0305-x |
| [4] |
ZHAO J, ZHAI Z, SUN D, et al. Antibacterial durability and biocompatibility of antibacterial-passivated 316L stainless steel in simulated physiological environment[J]. Mater Sci Eng C Mater Biol Appl, 2019, 100: 396-410. DOI:10.1016/j.msec.2019.03.021 |
| [5] |
ZHUANG Y, ZHANG S, YANG K, et al. Antibacterial activity of copper-bearing 316L stainless steel for the prevention of implant-related infection[J]. J Biomed Mater Res B Appl Biomater, 2020, 108(2): 484-495. DOI:10.1002/jbm.b.34405 |
| [6] |
CHAI H, GUO L, WANG X, et al. Antibacterial effect of 317L stainless steel contained copper in prevention of implant-related infection in vitro and in vivo[J]. J Mater Sci Mater Med, 2011, 22(11): 2525-2535. DOI:10.1007/s10856-011-4427-z |
| [7] |
JIN S, ZHANG Y, WANG Q, et al. Influence of TiN coating on the biocompatibility of medical NiTi alloy[J]. Colloids Surf B Biointerfaces, 2013, 101: 343-349. DOI:10.1016/j.colsurfb.2012.06.029 |
| [8] |
LIAO W, JIANG X. Mini-implant anchorage: much is still unknown[J]. Am J Orthod Dentofacial Orthop, 2019, 156(6): 709. DOI:10.1016/j.ajodo.2019.09.005 |
| [9] |
YIN H, WU Y, LI X, et al. Morphology and antibacterial properties of copper precipitates in ferrite stainless steel[J]. J Mater Eng Perform, 2021, 1-9. DOI:10.1007/s11665-020-05374-9 |
| [10] |
WANG S, YANG CG, REN L, et al. Study on antibacterial performance of Cu-bearing cobalt-based alloy[J]. Mater Lett, 2014, 129: 88-90. DOI:10.1016/j.matlet.2014.05.020 |
| [11] |
任玲, 杨春光, 杨柯. 抗菌医用金属材料的研究与发展[J]. 中国医疗设备, 2017, 32(1): 1-6, 13. DOI:10.3969/j.issn.1674-1633.2017.01.001 |
| [12] |
廖明阳, 刘华钢. 纳米铜的细胞毒性与溶出度分析[J]. 华西药学杂志, 2011, 26(1): 49-52. DOI:10.13375/j.cnki.wcjps.2011.01.003 |
 2022, Vol. 51
2022, Vol. 51