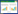文章信息
- 罗钢, 祝雪妍, 朱迪
- LUO Gang, ZHU Xueyan, ZHU Di
- 中期因子调控巨噬细胞活化在肾间质纤维化中的作用
- Role of midkine in regulating macrophage activation in renal interstitial fibrosis
- 中国医科大学学报, 2022, 51(1): 33-37
- Journal of China Medical University, 2022, 51(1): 33-37
-
文章历史
- 收稿日期:2021-07-16
- 网络出版时间:2021-12-27 20:28
2. 中国医科大学附属第一医院儿科, 沈阳 110001
2. Department of Pediatrics, The First Hospital of China Medical University, Shenyang 110001, China
慢性肾脏病是不可逆的肾组织损伤性疾病,肾间质纤维化(renal interstitial fibrosis,RIF)是慢性肾脏病的主要病理特点。尽管有药物用于治疗RIF,但大多数患者的疗效并不理想。RIF的发病机制复杂多样,目前尚无有效的治疗策略[1]。因此,研究RIF及其相关机制,可为防治RIF、阻止慢性肾脏病进展提供策略。单侧输尿管结扎(unilateral ureteral obstruction,UUO)是常用的建立研究肾脏炎症反应和瘢痕形成实验动物模型的方法,通过UUO可建立RIF模型。慢性炎症反应在RIF中发挥关键作用,巨噬细胞可释放多种促炎性细胞因子,如白细胞介素(interleukin,IL)-1b和IL-6等,诱导炎症反应,参与RIF的病理形成过程[2]。中期因子(midkine,MK)是一种肝素结合生长因子,具有促进细胞生长、存活、分化和迁移等功能[3]。最新研究[4]结果显示,MK具有多种免疫调节作用,与多种炎症疾病密切相关。本研究通过UUO建立小鼠RIF模型,观察MK参与RIF的形成及其相关机制,为RIF的防治提供新依据。
1 材料与方法 1.1 材料SPF级雄性小鼠24只(北京维通利华科技公司),饲养于中国医科大学实验动物部,6~8周龄,体质量18~22 g。小鼠RAW264.7巨噬细胞(中国科学院细胞库);DMEM培养基和胎牛血清(美国Gibco公司);实时荧光定量PCR试剂盒(日本TaKaRa公司);流式抗体、抗CD206同型对照、F4/80、CD11b、CD86抗体(美国Biolegend公司);实时荧光定量PCR仪(美国R & D公司);流式细胞仪(美国BD公司)。
1.2 方法 1.2.1 动物模型的制备和分组将24只小鼠适应性喂养1周,随机分为假手术(0 d)组、UUO 7 d组、UUO 14 d组,每组8只。0周时,小鼠以10%水合氯醛(0.35 mL/100 g)腹腔注射麻醉,固定于手术台上,腹部备毛,正中左侧旁切口,打开腹腔,暴露左肾,游离输尿管。UUO组小鼠在输尿管中间1/3处以4.0丝线结扎,中间离断关腹。假手术组小鼠仅游离左侧输尿管,不进行结扎。将小鼠放入饲养笼内等待苏醒,自由饮食。术后7 d处死8只小鼠,术后14 d处死余下8只小鼠,留取手术侧肾组织用于后续检测。
1.2.2 Masson染色取小鼠手术侧肾组织固定48 h,脱水,透明,包埋,切片后烘干。染色前,切片脱蜡,梯度乙醇脱水,放入Masson复合染液5 min,醋酸洗液洗片,磷钨酸染色8 min,醋酸洗液再次洗片,甲苯胺蓝染色3 min,醋酸洗液冲洗,经乙醇脱水、透明后封片。
1.2.3 流式细胞术分离小鼠肾组织,经胶原酶、透明质酸酶和DNANaseⅠ消化处理后,利用Percoll密度梯度离心法收集组织中的单个核细胞,4 ℃、1 500 r/min离心5 min,弃上清,加入各种流式抗体,避光常温孵育15 min,加0.5 mL PBS洗涤后上机检测。
1.2.4 实时荧光定量PCR检测相关mRNA表达常规培养小鼠RAW264.7巨噬细胞,调整细胞数为2.5×105/mL。铺于6孔板中,待细胞贴壁后,使用无血清DMEM饥饿培养30 min后添加1 μg/mL脂多糖(lipopolysaccharide,LPS),同时分别添加不同浓度的MK(10、50、100 ng/mL),即分为4组:LPS组、LPS+10 ng/mL MK组、LPS+50 ng/mL MK组、LPS+100 ng/mL MK组。加入MK阻断剂——MK反义寡脱氧核糖核苷酸(oligodeoxyribonucleotide,ODN),阻断MK表达。置于37 ℃、5% CO2培养箱内培养24 h。收集上述处理细胞,用TRIzol法提取细胞总RNA,应用Prismcript cDNA Synthesis Kit试剂盒反转录为cDNA。根据GenBank的基因序列设计PCR引物。引物序列IL-1b,正义,5’-CCTGCAGCTGGAGAGTGTG-3’,反义,5’-TG TGCTCTGCTTGTGAGGTGC-3’;IL-6,正义,5’-AGT TGCCTTCTTGGGACTGA-3’,反义,5’-TCCACGATT TCCCAGAGAAC-3’;IL-4,正义,5’-TGGGTCTCAAC CCCCAGCT-3’,反义,5’-TGCATGGCGTCCCTTCTC CTGT-3’;Arg-1,正义,5’-TTAGGCCAAGGTGCTTG CT-3’,反义,5’-TACCATGGCCCTGAGGAGGTTC-3’。检测IL-1b、IL-6、IL-4、Arg-1 mRNA表达水平,以GAPDH为内参照。PCR扩增条件:95 ℃预变性30 s;95 ℃预变性15 s;63 ℃退火60 s,共40个循环。每组设置3个复孔。以2-△△Ct值计算目的基因的相对表达量。
1.3 统计学分析应用Graphpad Prism8软件进行统计学分析。计量资料用x±s表示,采用方差分析或两独立样本t检验进行比较。P < 0.05为差异有统计学意义。
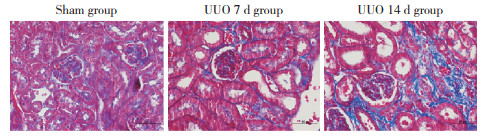
2 结果 2.1 MK在小鼠肾组织中的表达水平Masson染色结果(图 1)显示,与假手术组相比,UUO 7 d组小鼠肾组织结构紊乱,部分肾小球皱缩深染,肾间质区出现胶原蛋白沉积(呈蓝色);UUO 14 d组小鼠肾组织结构损伤较UUO 7 d组明显加重,肾小球和肾小管皱缩加重,肾间质区有大量胶原蛋白沉积(图 1)。实时荧光定量PCR结果(图 2)显示,假手术组小鼠肾组织MK mRNA的表达水平较低(P < 0.05),UUO 7 d组和UUO 14 d组小鼠肾组织MK mRNA的表达水平明显高于假手术组(P < 0.05)。
|
| 图 1 肾组织Masson染色×400 Fig.1 Masson staining of the renal tissues ×400 |
|
| * P < 0.05;** P < 0.01. 图 2 实时荧光定量PCR检测肾组织MK mRNA表达水平 Fig.2 Expression of MK mRNA in renal tissues detected using real time-polymerase chain reaction |
2.2 小鼠肾组织中巨噬细胞数量和炎性细胞因子的表达水平
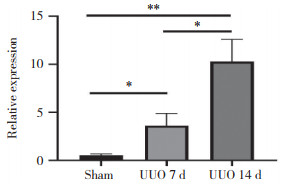
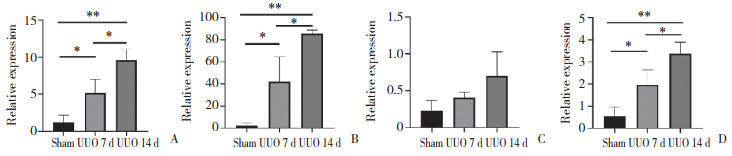
流式细胞术结果(图 3)显示,假手术组小鼠肾组织中CD11b+ F4/80+巨噬细胞数量较低;随时间延长,UUO 7 d组和UUO 14 d组小鼠肾组织中CD11b+ F4/80+巨噬细胞数量明显高于假手术组(P < 0.05)。实时荧光定量PCR结果(图 4)显示,虽然UUO组小鼠肾组织中IL-4 mRNA表达水平有升高趋势,但UUO 7 d组和UUO 14 d组与假手术组比较无统计学差异(P > 0.05);UUO组小鼠肾组织中IL-1b、IL-6、Arg-1 mRNA表达水平显著升高,UUO 7 d组和UUO 14 d组明显高于假手术组(P < 0.05),且随时间延长,IL-1b、IL-6、Arg-1 mRNA的表达水平逐渐升高,UUO 14 d组明显高于UUO 7 d组(P < 0.05)。
|
| A, flow cytometry staining of macrophages in the renal tissues; B, statistical analysis of macrophage frequency. * P < 0.05, ** P < 0.01. 图 3 流式细胞术分析肾组织中巨噬细胞的比例 Fig.3 Proportion of macrophages in the renal tissue analyzed using flow cytometry |
|
| A, IL-1b mRNA; B, IL-6 mRNA; C, IL-4 mRNA; D, Arg-1 mRNA. * P < 0.05, ** P < 0.01. 图 4 实时荧光定量PCR检测肾组织巨噬细胞中细胞因子的表达水平 Fig.4 Expression of cytokines in the renal tissue macrophages detected using real time-polymerase chain reaction |
2.3 MK对巨噬细胞活化的影响
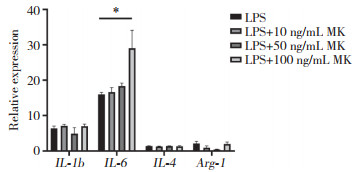
应用MK处理RAW264.7巨噬细胞,采用实时荧光定量PCR检测巨噬细胞炎性细胞因子IL-1b、IL-6、IL-4、Arg-1 mRNA的表达水平。与LPS组比较,MK作用呈剂量依赖性方式增强,分别用10、50、100 ng/mL MK处理巨噬细胞,可见RAW264.7巨噬细胞中IL-6 mRNA的表达水平升高,但未见IL-1b、IL-4、Arg-1 mRNA表达水平升高(图 5)。应用MK反义ODN处理后,可显著降低RAW264.7巨噬细胞IL-6 mRNA的表达水平(P < 0.05),见图 6。
|
| * P < 0.05. 图 5 实时荧光定量PCR检测MK刺激后的巨噬细胞中炎性细胞因子的表达水平 Fig.5 Expression of cytokines in the macrophages stimulated by MK detected using real time-polymerase chain reaction |

|
| * P < 0.05 图 6 实时荧光定量PCR检测MK反义ODN阻断MK表达后巨噬细胞中IL-6 mRNA的表达水平 Fig.6 Expression of IL-6 mRNA in macrophages blocked by MK antisense oligodeoxyribonucleotide detected using real time-polymerase chain reaction |
3 讨论
RIF是慢性肾脏病的主要病理特点,反复或持续的炎症反应导致组织修复不良是导致RIF的主要原因[5]。本研究通过UUO建立小鼠RIF模型,发现MK通过刺激巨噬细胞活化参与RIF过程。体外阻断MK可显著抑制巨噬细胞活化,提示MK可能是引起巨噬细胞活化、参与肾纤维化的关键调控因子。
RIF与肾组织中多种组织细胞的异常活化密切相关。肾小管上皮细胞是肾脏中含量最丰富的细胞,在肾脏损伤、修复以及纤维化过程中发挥关键作用。研究[6]显示,在急性炎症条件下,肾小管上皮细胞可通过去分化增殖再分化修复肾小管;而在持续的慢性感染刺激下,肾小管上皮细胞不仅可以上调表达促纤维化因子,促进RIF的形成,还可经上皮间质转化转分化为肌成纤维细胞。另外,在持续炎症条件下,肾脏成纤维细胞也可转化为肌成纤维细胞。肌成纤维细胞通过合成和分泌细胞外基质,如胶原蛋白和纤维,在肾脏瘢痕化和萎缩过程中发挥重要作用[7]。本研究显示,RIF小鼠肾组织结构紊乱,肾小球和肾小管均发生病理形态改变。特别是肾间质中胶原蛋白沉积呈进行性增加,提示肾间质的肌成纤维细胞高度活化,是导致RIF的主要原因。
MK是肝素结合生长因子,在细胞的发育分化过程中发挥关键作用。研究[4]发现,MK可作为重要的免疫调节因子,广泛参与免疫系统的生物学功能,如促进淋巴细胞存活,调控固有免疫细胞活化和功能,以及维持机体免疫稳态。最近的研究[8]证明,MK通过促进T细胞活化,参与肾脏炎症反应以及组织损伤。本研究发现,RIF小鼠肾组织中MK水平呈进行性上调,提示MK与RIF过程密切相关,MK的细胞来源以及产生特点需要深入探讨。
巨噬细胞是组织定居的固有免疫细胞,在介导组织炎症反应中发挥重要作用。持续活化的巨噬细胞可分泌多种炎性介质,诱导组织炎症反应,导致组织损伤。巨噬细胞在不同的微环境因子刺激下可分化为具有不同功能的巨噬细胞亚群:经典活化的M1型细胞可分泌炎性细胞因子IL-1、IL-6和肿瘤坏死因子-α等,诱导炎症反应和吞噬功能;而替代途径活化的M2型细胞则分泌IL-4、Arg-1和基质金属蛋白酶9等,具有抑制免疫应答、促进血管新生和组织修复等作用[9]。极化的M1型和M2型巨噬细胞在肾纤维化过程中的作用仍不清楚[10]。研究[11]显示,M1型巨噬细胞可产生肿瘤坏死因子-α诱导肾脏的局部炎症反应,进而活化肌成纤维细胞,诱导RIF;然而,也有研究[12]认为,持续活化的M2细胞可通过产生多种介质如转化生长因子-β和基质金属蛋白酶9等,促进细胞外基质积累和间质纤维化。因此,巨噬细胞极化的多样性在肾纤维化过程中的作用有待深入研究。
本研究显示,在第7和14天,RIF小鼠肾组织的巨噬细胞中炎性细胞因子IL-1、IL-6、Arg-1显著升高;体外研究显示,MK可增强巨噬细胞表达IL-6,抑制MK表达可显著抑制巨噬细胞表达IL-6。虽然本研究检测到RIF小鼠肾组织中巨噬细胞细胞上调表达IL-1b和Arg-1,但是体外实验未能观察到MK促进巨噬细胞IL-1b和Arg-1表达升高。上述研究结果提示,MK可通过促进巨噬细胞产生IL-6,进而使其向M1型极化,促进肾组织纤维化。
活化的M1样巨噬细胞促进肾纤维化的机制有待深入研究。组织浸润巨噬细胞活化可协同肾小管上皮细胞和成纤维细胞促进RIF。一方面,激活的巨噬细胞可通过多种炎性细胞因子作用于肾小管上皮细胞,促进其上皮间质转化转分化为肌纤维细胞,进而有助于RIF [13];另一方面,持续活化的巨噬细胞还可表达黏附分子galectin-3,与成纤维细胞相互作用,促进其活化并合成和分泌细胞外基质成分如胶原和纤维[14]。也有研究[15]发现,活化的巨噬细胞可转分化为肌成纤维细胞,促进RIF。
综上所述,本研究发现,活化巨噬细胞可介导慢性炎症反应,在肾纤维化过程中发挥重要作用。MK可通过激活M1型巨噬细胞促进RIF。因此,靶向阻断MK能够调控巨噬细胞的活化,改善RIF程度,进而抑制慢性肾脏病的进程。本研究有助于理解MK在RIF病理形成中的作用,为RIF以及慢性肾脏病的诊治提供新思路。
| [1] |
MENG XM, NIKOLIC-PATERSON DJ, LAN HY. Inflammatory processes in renal fibrosis[J]. Nat Rev Nephrol, 2014, 10(9): 493-503. DOI:10.1038/nrneph.2014.114 |
| [2] |
CALLE P, HOTTER G. Macrophage phenotype and fibrosis in diabetic nephropathy[J]. Int J Mol Sci, 2020, 21(8): 2806. DOI:10.3390/ijms21082806 |
| [3] |
GELA A, JOVIC S, NORDIN SL, et al. Midkine in host defence[J]. Br J Pharmacol, 2014, 171(4): 859-869. DOI:10.1111/bph.12402 |
| [4] |
SORRELLE N, DOMINGUEZ ATA, BREKKEN RA. From top to bottom: midkine and pleiotrophin as emerging players in immune regulation[J]. J Leukoc Biol, 2017, 102(2): 277-286. DOI:10.1189/jlb.3MR1116-475R |
| [5] |
QIAO Y, LIU L, YIN L, et al. FABP4 contributes to renal interstitial fibrosis via mediating inflammation and lipid metabolism[J]. Cell Death Dis, 2019, 10(6): 382. DOI:10.1038/s41419-019-1610-5 |
| [6] |
LIU Y. Cellular and molecular mechanisms of renal fibrosis[J]. Nat Rev Nephrol, 2011, 7(12): 684-696. DOI:10.1038/nrneph.2011.149 |
| [7] |
WEI Q, SU J, DONG G, et al. Glycolysis inhibitors suppress renal interstitial fibrosis via divergent effects on fibroblasts and tubular cells[J]. Am J Physiol Renal Physiol, 2019, 316(6): F1162-F1172. DOI:10.1152/ajprenal.00422.2018 |
| [8] |
MASUDA T, MAEDA K, SATO W, et al. Growth factor midkine promotes T-cell activation through nuclear factor of activated T cells signaling and Th1 cell differentiation in lupus nephritis[J]. Am J Pathol, 2017, 187(4): 740-751. DOI:10.1016/j.ajpath.2016.12.006 |
| [9] |
MURRAY PJ, ALLEN JE, BISWAS SK, et al. Macrophage activation and polarization: nomenclature and experimental guidelines[J]. Immu- nity, 2014, 41(1): 14-20. DOI:10.1016/j.immuni.2014.06.008 |
| [10] |
TANG PM, NIKOLIC-PATERSON DJ, LAN HY. Macrophages: versatile players in renal inflammation and fibrosis[J]. Nat Rev Nephrol, 2019, 15(3): 144-158. DOI:10.1038/s41581-019-0110-2 |
| [11] |
LEE S, HUEN S, NISHIO H, et al. Distinct macrophage phenotypes contribute to kidney injury and repair[J]. J Am Soc Nephrol, 2011, 22(2): 317-326. DOI:10.1681/ASN.2009060615 |
| [12] |
TSENG WC, TSAI MT, CHEN NJ, et al. Trichostatin A alleviates renal interstitial fibrosis through modulation of the M2 macrophage subpopulation[J]. Int J Mol Sci, 2020, 21(17): 5966. DOI:10.3390/ijms21175966 |
| [13] |
NIKOLIC-PATERSON DJ, WANG S, LAN HY. Macrophages promote renal fibrosis through direct and indirect mechanisms[J]. Kidney Int Suppl (2011), 2014, 4(1): 34-38. DOI:10.1038/kisup.2014.7 |
| [14] |
HENDERSON NC, MACKINNON AC, FARNWORTH SL, et al. Galectin-3 expression and secretion links macrophages to the promotion of renal fibrosis[J]. Am J Pathol, 2008, 172(2): 288-298. DOI:10.2353/ajpath.2008.070726 |
| [15] |
MENG XM, WANG S, HUANG XR, et al. Inflammatory macrophages can transdifferentiate into myofibroblasts during renal fibrosis[J]. Cell Death Dis, 2016, 7(12): e2495. DOI:10.1038/cddis.2016.402 |
 2022, Vol. 51
2022, Vol. 51