文章信息
- 刘兆奕, 吴桂平, 林瑶瑶, 赵红丽, 张晓丹
- LIU Zhaoyi, WU Guiping, LIN Yaoyao, ZHAO Hongli, ZHANG Xiaodan
- microRNA-328与心房颤动患者心房重构的相关性
- Relationship between microRNA-328 expression levels and atrial remodeling in patients with atrial fibrillation
- 中国医科大学学报, 2022, 51(1): 28-32
- Journal of China Medical University, 2022, 51(1): 28-32
-
文章历史
- 收稿日期:2021-02-05
- 网络出版时间:2021-12-27 20:41
2. 沈阳医学院研究生院, 沈阳 110002
2. Graduate School, Shenyang Medical College, Shenyang 110002, China
心房颤动(简称房颤)是一种不规则的心律,即规则有序的心房活动丧失,代之以快速无序的颤动波,是临床上最常见的快速型房性心律失常之一。其发病率随年龄的增长不断上升,在60~74岁人群中发病率高达8.0%[1],在全球每年影响约3 300多万患者。房颤引起的血流动力学异常和血栓事件(如心力衰竭、脑卒中等),使患者的致残率、死亡率明显增加。现今,房颤的治疗仍有很大的局限性,根本原因是其确切的发病机制尚不清楚。目前存在多种假说,包括多小波假说、局灶性冲动假说、心房重构假说和神经体液调节机制假说等。心房重构是房颤发生和维持的基础,心房重构主要包括电重构、结构重构和自主神经系统重构。结构重构的特点是心房纤维化、心房扩大以及细胞增殖、分化、凋亡等,是房颤的中心环节,与其相关的分子机制较多,关系错综复杂。因此,进一步研究心房重构的机制能够为房颤的防治提供重要的理论依据,便于早期对房颤进行安全、有效的干预和治疗。
微RNA(microRNA,miRNA)是一类由18~25个核苷酸组成的单链非编码小分子RNA,以mRNA为靶分子,与靶基因mRNA的3’-非翻译区结合,通过切割降解mRNA或者抑制转录后的靶基因、改变染色质的结构,从而调节基因的表达,实现其在体内的多种生物学功能。ZHAO等[2]通过组织学检查,证明转基因小鼠中miRNA-328以旁分泌方式将心肌细胞转化为心肌成纤维细胞,从而促进心肌纤维化,最终导致心肌重构。近年来,miRNA在心血管系统疾病发生、发展过程中的作用受到医学界广泛关注。已有研究[3]表明,miRNA-328在犬房颤模型中明显上调。但miRNA-328水平的升高与心房重构是否相关,以及miRNA-328对房颤的发生和维持是否发挥作用,未见研究报道。本研究首次探讨了miRNA-328在房颤患者血清中的表达水平及其与心房重构的相关性,从而为房颤患者心房重构的诊疗和干预提供新的思路。
1 材料与方法 1.1 研究对象根据《2016年欧洲心脏病学会房颤管理指南》,选取2019年1月10日至2020年5月31日于沈阳医学院附属第二医院心血管内科就诊的房颤患者120例(房颤组),并选择同期正常体检者40例作为对照组。房颤组分为阵发性房颤(40例)、持续性房颤(48例)和永久性房颤(32例)3个亚组。采用美国纽约心脏病协会标准对120例房颤患者进行心功能分级,其中Ⅰ级13例,Ⅱ级40例,Ⅲ级36例,Ⅳ级31例。所有患者行一般病史采集、心电图、动态心电图、心脏超声检查、血糖、血脂、miRNA-328定量检测。所有研究对象均自愿参加本研究并签署知情同意书。
排除标准:房颤病史不明,近期感染及电解质紊乱,先天性心脏病,恶性肿瘤,帕金森病,精神病不配合治疗,严重肝肾功能障碍,结缔组织病,自身免疫性疾病,哺乳和妊娠期妇女。
1.2 研究方法 1.2.1 一般资料收集入院后首日或次日空腹12 h以上采集肘静脉血,采用全自动生化仪测定血清总胆固醇(total cholesterol,TC)、甘油三酯(triglycerides,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、N端脑利钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)、肝肾功能等,并留取空腹血,按照RNA提取试剂盒说明离心取血清,储存于-80 ℃冰箱中待测。
1.2.2 心脏彩色多普勒超声检查记录左心室射血分数(left ventricular ejection fraction,LVEF)、左心房内径(left atrial diameter,LAD)。
1.2.3 实时荧光定量PCR检测miRNA-328相对表达量利用血液总RNA提取试剂盒(DP443,天根生化科技有限公司)提取总RNA,具体参照说明书进行,采用微升核酸分析(Nanodrop 2000c,美国Thermo Scientific公司)检测RNA的浓度和纯度。采用逆转录试剂盒(PCR-311F,日本TOYOBO公司)进行逆转录反应,采用SYBRTM Green试剂盒(QPK-201,美国ABI公司)分别检测样本中miRNA-328-5p和U6的表达水平。每个样本至少设置3个复孔,采用2-△△Ct法计算miRNA-328-5p在各组中的相对表达量。miRNA-328-5p和U6引物由广州锐博生物技术有限公司提供。
1.3 统计学分析应用SPSS 26.0软件进行统计学分析。计量资料用x±s表示,2组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t法,对于偏态或方差不齐的样本多组间比较采用多个独立样本的秩和检验。计数资料用百分比表示,采用χ2检验进行比较。采用Pearson相关分析和偏相关分析进行相关分析。采用受试者操作特征(receiver operating characteristic,ROC)曲线判断miRNA-328的诊断价值。P < 0.05为差异有统计学意义。
2 结果 2.1 一般资料的比较房颤组和对照组在年龄、性别、吸烟、糖尿病、TC、TG、HDL-C、LDL-C方面的差异无统计学意义(P > 0.05),具有可比性;房颤组中冠状动脉粥样硬化性心脏病和高血压的患者比例及LAD均高于对照组(P < 0.05)。3个房颤亚组比较,年龄、LAD、LVEF、NT-proBNP的差异有统计学意义(P < 0.05),见表 1、2。
| Item | Control group(n = 40) | Atrial fibrillation group(n = 120) | t/χ2 | P |
| Gender(male/female) | 23/17 | 68/52 | 0.008 | 0.927 |
| Age(year) | 56.87±3.50 | 58.67±6.13 | -1.743 | 0.083 |
| Smoking [n(%)] | 15(37.5) | 35(29.2) | 0.970 | 0.325 |
| Hypertension [n(%)] | 3(7.5) | 28(23.3) | 4.815 | 0.028 |
| Diabetes mellitus [n(%)] | 2(5.0) | 20(16.7) | 3.443 | 0.064 |
| Coronary heart disease [n(%)] | 0(0.0) | 15(12.5) | 5.517 | 0.019 |
| LAD(mm) | 38.61±2.51 | 44.55±3.24 | -11.194 | < 0.001 |
| TC(mmol/L) | 4.07±2.31 | 4.29±1.21 | -0.658 | 0.512 |
| TG(mmol/L) | 1.53±0.82 | 1.59±1.07 | -0.344 | 0.732 |
| HDL-C(mmol/L) | 0.99±0.17 | 1.02±0.20 | -0.884 | 0.378 |
| LDL-C(mmol/L) | 2.29±0.58 | 2.73±0.89 | -1.016 | 0.311 |
| Item | Paroxysmal atrial fibrillation(n = 40) | Persistent atrial fibrillation(n = 48) | Permanent atrial fibrillation(n = 32) | F/χ2 | P |
| Gender(male/female) | 22/18 | 25/23 | 21/11 | 1.502 | 0.472 |
| Age(year) | 57.23±4.51 | 56.37±5.13 | 63.92±6.17 | 21.56 | < 0.001 |
| Smoking [n(%)] | 10(25.0) | 15(31.3) | 10(31.3) | 0.504 | 0.777 |
| Hypertension [n(%)] | 8(20.0) | 11(22.9) | 9(28.1) | 0.664 | 0.718 |
| Diabetes mellitus [n(%)] | 6(15.0) | 7(14.6) | 7(21.9) | 0.855 | 0.652 |
| Coronary heart disease [n(%)] | 4(10.0) | 6(12.5) | 5(15.6) | 0.514 | 0.773 |
| LVEF(%) | 58.31±6.35 | 54.44±5.87 | 48.32±6.32 | 23.631 | < 0.001 |
| LAD(mm) | 42.35±4.23 | 43.02±3.76 | 49.60±5.32 | 29.308 | < 0.001 |
| TC(mmol/L) | 4.51±0.86 | 4.28±0.98 | 4.03±0.76 | 2.613 | 0.078 |
| TG(mmol/L) | 1.56±0.32 | 1.67±0.43 | 1.51±0.44 | 1.715 | 0.184 |
| HDL-C(mmol/L) | 1.08±0.32 | 1.00±0.23 | 0.98±0.28 | 1.406 | 0.249 |
| LDL-C(mmol/L) | 2.68±0.51 | 2.74±0.43 | 2.78±0.56 | 0.378 | 0.686 |
| NT-proBNP(pg/mL) | 823.45±433.76 | 1 175.76±754.32 | 1 457.05±687.56 | 8.740 | < 0.001 |
2.2 miRNA-328相对表达量
对照组和房颤组miRNA-328的表达水平分别为1.25±0.11和1.66±0.17,房颤组miRNA-328的表达水平显著高于对照组(P < 0.05)。阵发性、持续性和永久性房颤亚组miRNA-328的表达水平分别为1.54±0.09、1.61±0.05和1.84±0.14,永久性房颤亚组miRNA-328表达水平最高,与阵发性、持续性房颤亚组相比,差异有统计学意义(P < 0.05),持续性房颤亚组miRNA-328表达水平较阵发性房颤亚组高,但差异无统计学意义(P > 0.05)。Ⅰ、Ⅱ、Ⅲ、Ⅳ级心功能患者miRNA-328的表达水平分别为1.26±0.13、1.55±0.16、1.78±0.46和2.06±0.75,随着心功能分级的增加,miRNA-328表达水平也逐渐升高,不同心功能分级间miRNA-328表达水平的差异均有统计学意义(P < 0.05)。
2.3 Pearson相关性分析及偏相关分析Pearson相关性分析结果显示,房颤组中,miRNA- 328与LAD、年龄呈正相关(r = 0.264,P < 0.05;r = 0.611,P < 0.05)。偏相关分析结果显示,调整年龄、性别、冠状动脉粥样硬化性心脏病、糖尿病、高血压、吸烟等因素后,房颤组中miRNA-328表达水平仍与LAD呈正相关(r = 0.368,P < 0.05),提示miRNA-38参与心房重构过程。
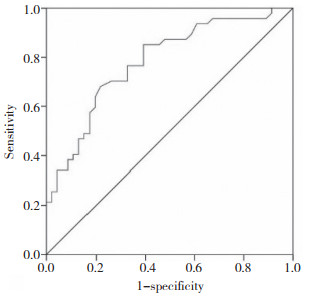
2.4 ROC曲线分析miRNA-328的预测价值血清miRNA-328的曲线下面积为0.782,95%置信区间为0.689~0.875(P < 0.01)。见图 1。
|
| 图 1 miRNA-328相对表达量的ROC曲线分析 Fig.1 ROC curve analysis of miRNA-328 relative expression level |
3 讨论
目前,房颤的治疗方式主要包括射频消融术、抗凝、转复窦性心律、控制心室率等药物治疗以及外科的改良迷宫手术治疗,但这些治疗都存在复发率高、有效性低等局限性,其根本原因是房颤的发生机制尚未明确。目前认为心房重构是房颤的主要发病机制,因此针对心房重构的房颤上游治疗成为研究的热点。
研究[4]表明,心房重构主要是细胞外基质增多,成纤维细胞增殖转化为肌成纤维细胞,间质中胶原蛋白和纤维蛋白合成增加导致心肌纤维化、心肌顺应性下降以及心房扩大等一系列病理生理改变。miRNA通过调节成纤维细胞的增殖分化,从而影响心房重构。已有研究[5-7]表明,miRNA-26、miRNA-328、miRNA-1、miRNA-133、miRNA-590、miRNA-21、miRNA-29等都与心房重构有关。这也提示,有众多miRNA参与调节心肌纤维化过程,分别影响房颤的发生和维持。SOEKI等[7]的研究提示,miRNA-328在左心房重构中的重要性大于miRNA-1。
miRNA-328是一种位于染色体16q22.1上的小分子RNA,已有研究[8-10]显示,miRNA-328不仅在心血管疾病的发生、发展中起重要作用,还参与调控细胞增殖和分化、肿瘤生长、炎症等一系列生物学过程,因此可作为多种疾病诊断和预后的标志物。MCMANUS等[11]发现,miRNA-328通过影响L型Ca2+通道密度促进心房电重构,认为miRNA-328可作为进一步探索房颤的重要标志物。LI等[12]采用RNA测序技术对房颤兔右心房进行研究,发现miRNA-328通过调节下游蛋白编码基因CACNA1C参与心房电重构。LU等[13]在房颤犬模型心房组织中证明了miRNA-328通过影响L型Ca2+通道基因,使动作电位时程缩短,从而诱导房颤的发生,下调miRNA-328表达水平或基因敲除miRNA-328可抑制房颤。既往研究[14]显示,LAD是发生房颤的独立危险因素,但房颤患者中miRNA-328水平与LAD的相关性少有文献报道。另外,动物模型中的房颤与临床患者房颤情况存在差异。
本研究以临床房颤患者为研究对象,检测其血清miRNA-328水平。结果发现,与对照组相比,房颤患者miRNA-328的表达水平明显升高。且在调整性别、年龄、高血压、糖尿病、冠状动脉粥样硬化性心脏病、吸烟等因素后,房颤组中血清miRNA-328表达水平仍与LAD呈正相关,提示miRNA-328可能参与房颤患者的心房重构过程。永久性房颤亚组中miRNA-328表达水平显著高于阵发性房颤亚组和持续性房颤亚组,差异有统计学意义(P < 0.05)。持续性房颤组中miRNA-328表达水平较阵发性房颤组高,但差异无统计学差异(P > 0.05),提示房颤持续时间越长,血清miRNA-328的表达水平越高,但在阵发性房颤和持续性房颤患者中差异不大。这与王玺等[15]的研究结果不同,考虑可能与样本量差异以及研究的房颤人群之间的异质性有关。同时,ROC曲线分析提示,miRNA-328对房颤的发生具有一定的预测价值。本研究提示,miRNA-328可能参与房颤患者的心房重构过程,可成为房颤早期预警的生物学标志物和未来治疗房颤的新靶点。
此外,房颤是心功能不全患者最常合并的心律失常,两者常同时存在,相互促进,互为因果。且心功能不全患者本身具有心律失常易感性,心功能不全的程度越重,发生心律失常的倾向性越大。本研究中,随着心功能分级的增加,房颤患者血清miRNA-328表达水平逐渐升高,提示在临床上心功能不全患者发生房颤的可能性大,miRNA-328有望作为预测心功能不全患者病情严重程度和心功能状态的一个指标。但本研究样本量少,缺乏多中心的研究,结果可能存在一定偏倚,对于心功能不全合并房颤患者的心功能分级是否与miRNA-328表达水平有直接关系,还需进行进一步的基础和临床研究。
| [1] |
吴丹丹, 陈瑜, 张腾. 房颤发病机制研究新进展[J]. 中西医结合心脑血管病杂志, 2016, 14(12): 1342-1346. DOI:10.3969/j.issn.1672-1349.2016.12.011 |
| [2] |
ZHAO D, LI C, YAN H, et al. Cardiomyocyte derived miR-328 promotes cardiac fibrosis by paracrinely regulating adjacent fibroblasts[J]. Cell Physiol Biochem, 2018, 46(4): 1555-1565. DOI:10.1159/000489201 |
| [3] |
吕云波, 曾秋棠, 钟金鹏. 螺内酯在犬心房颤动模型中对心房结构重构及电重构的影响[J]. 临床心血管病杂志, 2013, 29(6): 466-469. DOI:10.13201/j.issn.1001-1439.2013.06.014 |
| [4] |
李春生, 严中亚. 房颤心房重构与MicroRNA关系的最新研究进展[J]. 齐齐哈尔医学院学报, 2019, 40(5): 624-626. DOI:10.3969/j.issn.1002-1256.2019.05.040 |
| [5] |
LUO X, YANG B, NATTEL S. MicroRNAs and atrial fibrillation: mechanisms and translational potential[J]. Nat Rev Cardiol, 2015, 12(2): 80-90. DOI:10.1038/nrcardio.2014.178 |
| [6] |
DA SILVA AMG, DE ARAÚJO JNG, DE OLIVEIRA KM, et al. Circulating miRNAs in acute new-onset atrial fibrillation and their target mRNA network[J]. J Cardiovasc Electrophysiol, 2018, 29(8): 1159-1166. DOI:10.1111/jce.13612 |
| [7] |
SOEKI T, MATSUURA T, BANDO S, et al. Relationship between local production of microRNA-328 and atrial substrate remodeling in atrial fibrillation[J]. J Cardiol, 2016, 68(6): 472-477. DOI:10.1016/j.jjcc.2015.12.007 |
| [8] |
刘磊, 于宗良, 邓红平. miRNA-328在心血管疾病和肿瘤中的应用[J]. 医学综述, 2018, 24(3): 476-480. DOI:10.3969/j.issn.1006-2084.2018.03.012 |
| [9] |
WANG X, XIA Y, et al. microRNA-328 inhibits cervical cancer cell proliferation and tumorigenesis by targeting TCF7L2[J]. Biochem Biophys Res Commun, 2016, 475(2): 169-175. DOI:10.1016/j.bbrc.2016.05.066 |
| [10] |
冯荣, 傅广, 黄树斌, 等. miR-328、miR-147和miR-22在冠心病患者中的表达变化及临床意义[J]. 中国动脉硬化杂志, 2015, 23(8): 812-816. |
| [11] |
MCMANUS DD, LIN H, TANRIVERDI K, et al. Relations between circulating microRNAs and atrial fibrillation: data from the Framingham Offspring Study[J]. Heart Rhythm, 2014, 11(4): 663-669. DOI:10.1016/j.hrthm.2014.01.018 |
| [12] |
LI Z, WANG X, WANG W, et al. Altered long non-coding RNA expression profile in rabbit atria with atrial fibrillation: TCONS_00075467 modulates atrial electrical remodeling by sponging miR-328 to regulate CACNA1C[J]. J Mol Cell Cardiol, 2017, 108: 73-85. DOI:10.1016/j.yjmcc.2017.05.009 |
| [13] |
LU Y, ZHANG Y, WANG N, et al. MicroRNA-328 contributes to adverse electrical remodeling in atrial fibrillation[J]. Circulation, 2010, 122(23): 2378-2387. DOI:10.1161/circulationaha.110.958967 |
| [14] |
LIP GY, CLEMENTY N, PERICART L, et al. Stroke and major bleeding risk in elderly patients aged ≥ 75 years with atrial fibrillation: the Loire Valley atrial fibrillation project[J]. Stroke, 2015, 46(1): 143-150. DOI:10.1161/strokeaha.114.007199 |
| [15] |
王玺, 邱春光, 黄振文, 等. 血浆miR-328在心房颤动中的表达水平及其临床意义[J]. 中华心血管病杂志, 2013, 41(2): 126-129. DOI:10.3760/cma.j.issn.0253-3758.2013.02.010 |
 2022, Vol. 51
2022, Vol. 51