文章信息
- 赵磊, 杨笑薇, 左韬, 姜艳华, 周慧敏
- ZHAO Lei, YANG Xiaowei, ZUO Tao, JIANG Yanhua, ZHOU Huimin
- 杞参方对高渗诱导的干眼模型角膜上皮细胞保护机制的研究
- Protective mechanism of different Qishen prescriptions on corneal epithelial cells in a dry eye model induced by hypertonic fluid
- 中国医科大学学报, 2022, 51(1): 12-16, 22
- Journal of China Medical University, 2022, 51(1): 12-16, 22
-
文章历史
- 收稿日期:2021-08-25
- 网络出版时间:2021-12-28 7:02
2. 辽宁中医药大学附属第二医院眼科, 沈阳 110034;
3. 沈阳市第四人民医院眼科, 沈阳 110031
2. Department of Ophthalmology, The Second Affiliated Hospital of Liaoning University of Traditional Chinese Medicine, Shenyang 110034, China;
3. Department of Ophthalmology, The Fourth People's Hospital of Shenyang, Shenyang 110031, China
干眼是由泪液的质、量及动力学异常导致的泪膜不稳定或眼表微环境失衡的慢性眼表疾病,可伴有眼表炎症反应、组织及神经异常,造成眼部不适症状和(或)视功能障碍[1]。泪膜不稳定与眼表上皮细胞损伤互为因果,可形成恶性循环加重病情[2]。干眼的研究一直是眼科专业领域的焦点,中医药在干眼治疗方面具有独特优势[3]。左韬等[4]的研究显示,杞参方能有效改善干眼患者的眼部症状、泪液分泌量和泪膜破裂时间,但其机制尚未明确。本研究基于细胞外调节蛋白激酶1(extracellular regulated protein kinase 1,ERK1)/p38丝裂原活化蛋白激酶(p38 mitogen activated proein kinase,p38MAPK)通路研究杞参方对500 mOsm/L渗透压诱导的人角膜上皮细胞(human corneal epithelial cells,HCECs)干眼模型的调控机制。
1 材料与方法 1.1 材料人12-SV40角膜上皮细胞株(CRL-11135 HCECs)购自美国标准生物品收藏中心。杞参方(熟地黄20 g、山药9 g、山茱萸9 g、牡丹皮9 g、泽泻6 g、茯苓6 g、枸杞子6 g、菊花6 g、人参3 g、麦冬9 g、五味子6 g、通草6 g、黄精9 g、葛根9 g)由北京康仁堂药业有限公司提供。CCK-8试剂盒购自北京Solarbio公司,白细胞介素-1β(interlukin-1β,IL-1β)检测试剂盒(SEA563Mu)购自武汉优尔生商贸有限公司;IL-8酶联免疫检测试剂盒(F10850)购自上海西唐生物科技有限公司;Anti-caspase-3抗体、Anti-ERK1(phospho Y204)抗体(ab131438)、Anti-p38抗体(ab170099)、Anti-p38(phospho T180)抗体(ab178867),购自英国Abcam公司;ERK1抗体(G-8)sc-271269购自美国Santa Cruz Biotechnology公司。
1.2 方法 1.2.1 血清制备取SPF级成年雄性Wistar大鼠40只,体质量220~240 g,购自辽宁长生生物技术股份有限公司,动物生产许可证号SCXK辽2020-0001,饲养于辽宁中医药大学实验动物中心SPF级实验室[许可证编号:SYYK(辽)2019-0004]。适应性喂养大鼠2 d、禁食12 h后,空白血清组大鼠(10只)予蒸馏水灌胃,杞参方高、中、低含药血清组大鼠(每组10只)分别予高、中、低剂量杞参方颗粒蒸馏水冲服灌胃,2次/d,连续3 d。参考《药理实验方法学》折算,大鼠剂量按照成人日剂量的6.36倍分冲备用,成人用量为1.88 g·kg-1·d-1,折算后大鼠最终等效剂量为11.98 g·kg-1·d-1,则杞参方高、中、低剂量分别为23.96、11.98、5.99 g·kg-1·d-1。末次灌胃1 h后采血。室温静置离心以分离血清,56 ℃水浴灭活40 min,0.22 µm滤膜过滤除菌,-20 ℃保存备用。本研究通过辽宁中医药大学实验动物中心伦理委员会审核并认真执行(伦理批号210000420200010)。
1.2.2 高渗透压干眼HCECs造模在含10%胎牛血清、100 U/mL青霉素/链霉素的DMEM/F12培养基中加入无菌500 mOsm/L渗透压的饱和氯化钠溶液,培养基pH(7.2±0.2),培养HCECs。
1.2.3 细胞分组与给药(1)BC组,正常条件培养的HCECs;(2)HO组,干眼模型细胞加入15%空白血清15 μL;(3)HO+SH组,干眼模型细胞加入0.3%玻璃酸钠滴眼液15 μL;(4)HO+HD组,干眼模型细胞加入15%杞参方高剂量含药血清15 μL;(5)HO+MD组,干眼模型细胞加入15%杞参方中剂量含药血清15 μL;(6)HO+LD组,干眼模型细胞加入15%杞参方低剂量含药血清15 μL。
1.2.4 CCK-8法检测各组HCECs存活率将HCECs接种于96孔板(1×104/mL,100 μL/孔),置于37 ℃、5% CO2培养箱中培养24 h;弃培养基,分别加入100 μL渗透压为500 mOsm/L的含空白血清、玻璃酸钠、不同浓度杞参方含药血清的培养基,每组设3个复孔,继续培养24 h;弃旧培养基,加入CCK-8溶液10 μL,继续培养2 h,检测450 nm吸光度值(A)。计算细胞存活率=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
1.2.5 ELISA法检测IL-1β、IL-8的表达按照ELISA试剂盒说明书进行操作。
1.2.6 免疫细胞化学(immunocytochemistry,ICC)法检测凋亡因子caspase-3的表达制作细胞片后进行染色。PBS清洗3次,H2O2室温孵育10 min去除内源性过氧化物酶,山羊血清室温封闭10~15 min,caspase-3抗体4℃孵育过夜,PBS清洗,滴加生物素标记的抗鼠/兔IgG室温反应20 min,PBS清洗,滴加HRP标记的链霉亲和素室温反应20 min,DAB显色,苏木素复染。镜下观察并采集照片,测定5个随机视野的平均A值,作为该样本中目的蛋白表达水平。
1.2.7 Western blotting检测ERK1、p-ERK1、p38MAPK、p-p38MAPK蛋白的表达将HCECs以3×105/孔的密度接种于12孔细胞培养板,培养18~24 h至铺满培养板85%左右,弃去旧培养基,分别给予正常等渗培养基和渗透压为500 mOsm/L的含空白血清、0.3%玻璃酸钠滴眼液、不同浓度杞参方颗粒含药血清的培养基,培养4 h后,收集细胞备用。相同实验重复3次。提取各组细胞总蛋白质,BCA法测定蛋白质的浓度。蛋白配平变性后行SDS-PAGE电泳,300 mA恒流模式电流转膜1 h。室温封闭2 h。加入一抗稀释液(1︰500稀释),4 ℃孵育过夜。TBST洗膜。加入山羊抗兔HRP标记的二抗(1︰5 000稀释)中,摇床室温孵育2 h。TBST洗膜,ECL发光,Imaging System化学发光成像分析仪成像。通过Quantity-one分析软件对蛋白条带进行OD定量分析。
1.3 统计学分析采用SPSS 17.0软件进行统计分析。计量资料以x±s表示。多组间比较采用one-way ANOVA,两两比较采用LSD-t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各组HCECs存活率比较各组HCECs存活率[BC组(1.083±0.069 5)%,HO组(0.379±0.044 6)%,HO+SH组(0.601±0.046 8)%,HO+HD组(0.968±0.133 1)%,HO+MD组(0.676± 0.098 7)%,HO+LD组(0.642±0.084 3)%]比较,差异有统计学意义(F = 91.221,P < 0.01)。与BC组相比,各组HCECs存活率均显著减少(P < 0.01);与HO组相比,各用药组HCECs存活率均显著增加(P < 0.01);与HO+SH组相比,HO+HD组HCECs存活率显著增加(P < 0.01)。
2.2 各组细胞外液IL-1β、IL-8表达水平比较ELISA结果显示,与BC组相比,各组细胞外液炎性细胞因子IL-1β、IL-8表达水平均显著增高(P < 0.01);与HO组相比,各用药组的IL-1β、IL-8表达水平均减少(P < 0.05、0.01);与HO+SH组相比,HO+HD、HO+MD组IL-1β与HO+HD、HO+LD组IL-8表达水平均显著减少(P < 0.01)。见表 1。
| Group | IL-1β | IL-8 |
| BC | 32.473±2.080 | 34.873±3.497 |
| HO | 105.750±17.4961) | 105.731±18.7691) |
| HO+SH | 88.451±13.5471),3) | 77.376±14.0381),3) |
| HO+HD | 54.051±7.2601),3),4) | 49.618±7.3441),3),4) |
| HO+MD | 70.457±10.6691),3),4),5) | 77.167±4.9581),3),5) |
| HO+LD | 91.598±14.2031),2),5),6) | 92.071±14.0771),2),4),5),6) |
| F | 50.955 | 49.703 |
| P | < 0.01 | < 0.01 |
| 1)P < 0.01 vs BC group;2)P < 0.05,3)P < 0.01 vs HO group;4)P < 0.01 vs HO+SH group;5)P < 0.01 vs HO+HD group;6)P < 0.01 vs HO+MD group. | ||
2.3 各组细胞凋亡因子caspase-3表达水平比较
ICC结果显示,各组HCECs凋亡因子caspase-3表达水平[HO组0.256±0.029,HO+SH组0.222±0.034,HO+HD组0.188±0.027,HO+MD组0.192±0.019,HO+LD组0.227±0.027]比较,差异有统计学意义(F = 23.588,P < 0.01)。与BC组相比,各组HCECs中caspase-3蛋白表达水平均显著增高(P < 0.01);与HO组相比,HO+SH、HO+HD、HO+MD组caspase-3表达水平均减少(P < 0.05、0.01);与HO+SH组相比,HO+HD组caspase-3蛋白表达水平减少(P < 0.05)。见图 1。
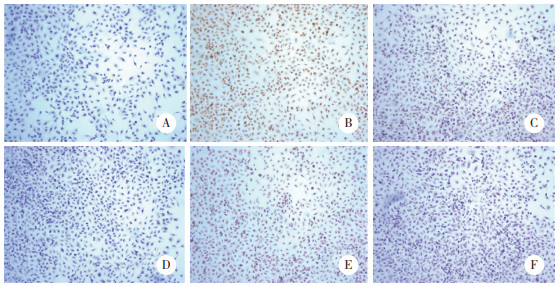
|
| A, BC group; B, HO group; C, HO+SH group; D, HO+HD group; E, HO+MD group; F, HO+LD group. 图 1 各组HCECs中凋亡因子caspase-3表达HE×200 Fig.1 Comparison of expression of apoptosis factor caspase-3 in HCECs HE ×200 |
2.4 各组HCECs中ERK1、p-ERK1、p38MAPK、p-p38MAPK蛋白表达水平比较
Western blotting结果显示,各组HCECs中ERK1、p38MAPK蛋白表达水平组间比较,差异无统计学意义(P > 0.05)。而各组HCECs的p-ERK1、p-p38MAPK蛋白表达水平组间比较,差异有统计学意义;与BC组相比,各组HCECs中的p-ERK1、p-p38MAPK蛋白表达均显著增高(P < 0.01);与HO组相比,HO+SH、HO+HD、HO+MD组的p-ERK1与HO+HD、HO+MD组的p-p38MAPK蛋白表达均减少(P < 0.05、< 0.01);与HO+SH组相比,HO+HD、HO+MD组p-ERK1、p-p38MAPK蛋白表达水平减少(P < 0.05,0.01)。见表 2、图 2。
| Group | ERK1 | p-ERK1 | p38MAPK | p-p38MAPK |
| BC | 0.595±0.114 | 0.229±0.034 | 0.562±0.084 | 0.241±0.032 |
| HO | 0.610±0.101 | 0.592±0.0741) | 0.574±0.083 | 0.580±0.0521) |
| HO+SH | 0.565±0.072 | 0.517±0.0591),2) | 0.564±0.087 | 0.531±0.0321) |
| HO+HD | 0.567±0.028 | 0.419±0.0581),3),5) | 0.555±0.056 | 0.393±0.0991),3),5) |
| HO+MD | 0.524±0.022 | 0.451±0.0491),3),4) | 0.570±0.055 | 0.442±0.0421),3),4) |
| HO+LD | 0.594±0.048 | 0.552±0.0421),6),8) | 0.598±0.069 | 0.526±0.0761),6),7) |
| F | 1.062 | 34.471 | 0.253 | 24.957 |
| P | 0.401 | < 0.01 | 0.935 | < 0.01 |
| 1)P < 0.01 vs BC group;2)P < 0.05,3)P < 0.01 vs HO group;4)P < 0.05,5)P < 0.01 vs HO+SH group;6)P < 0.01 vs HO+HD group;7)P < 0.05,8)P < 0.01 vs HO+MD group. | ||||
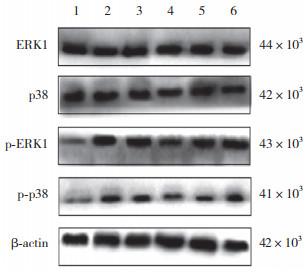
|
| 1, BC group; 2, HO group; 3, HO+SH group; 4, HO+HD group; 5, HO+MD group; 6, HO+LD group. 图 2 各组HCECs的ERK1、p38MAPK、p-ERK1、p-p38MAPK蛋白表达 Fig.2 Expression of ERK1, p38MAPK, p-ERK1, and p-p38MAPK proteins in HCECs of each groups |
3 讨论
杞参方由杞菊地黄丸合生脉饮再加通草、黄精、葛根组合而成。杞菊地黄丸滋补肝肾之阴,为滋阴润目名方。相关meta分析显示,杞菊地黄丸联合西药治疗干眼的疗效优于单纯应用西药组[5-6]。杞菊地黄丸还可降低泪液中IL-1β、IL-8、MMP-9的表达水平[7]。生脉饮具有补益肺肾之气、养阴生津之效,具有抑制炎症反应的作用[8]。加葛根、黄精、通草以补气养阴,健脾益肾,通利三焦。前期研究[9]证实,杞参方可降低炎性细胞因子表达水平,减少大鼠干眼模型角膜上皮损伤及泪腺细胞凋亡。
泪膜和眼表协会国际干眼工作小组第2次报告(Tear Film and Ocular Surface Society Dry Eye Workshop,TFOSDEWS Ⅱ)得出结论:干眼的核心机制是蒸发诱导的泪液高渗直接损害眼表,引起炎症反应,最常见为丝裂原活化蛋白激酶(mitogen activated proein kinase,MAPK)与核因子κB(nuclear factor kappa-B,NF-κB)介导[10]。MAPK主要负责从细胞表面到核内部的信号传递,调控炎症、细胞凋亡、肿瘤细胞侵袭等生理活动[11]。ERK1、p38MAPK为MAPK的亚族。研究[12-14]证实,炎性细胞因子在干眼发病过程中表达明显增强,而其表达及释放与ERK1、p38MAPK通路的激活密切相关,通过干预ERK1、p38MAPK表达可抑制干眼的炎症信号向细胞凋亡通路转导。本研究结果显示,各组HECEs中ERK1、p38MAPK蛋白表达水平比较,差异无统计学意义。在未受刺激的细胞内,MAPK在细胞质内处于静止状态,当细胞受到刺激后,MAPK被激活而发生逐级磷酸化,磷酸化后的MAPK蛋白则会进入细胞核内,故而出现各组HCECs中ERK1、p38MAPK蛋白表达水平组间比较无统计学差异,而各组p-ERK1、p-p38MAPK蛋白表达水平组间比较有统计学差异。这与郭宣妮等[15]的研究结果基本一致。郭宣妮等[15]发现干眼组患者泪液中p-ERK1、p-p38MAPK蛋白表达与泪膜破裂时间和基础泪液分泌试验均呈显著负相关,与角膜荧光素染色评分呈显著正相关,与本研究的HO组p-ERK1、p-p38MAPK蛋白表达增高的结果一致。本研究发现,杞参方高、中剂量组可减少干眼模型HCECs内p-ERK1、p-p38MAPK蛋白的表达,提示高、中剂量杞参方可能对干眼模型HCECs具有抗炎及抗细胞凋亡的作用。ERK1、p38MAPK通路可促进干眼模型角结膜上皮IL-1、IL-6、TNF-α等炎性细胞因子的释放及细胞凋亡[16-17]。本研究中,加入空白血清的HO组干眼模型细胞IL-1β、IL-8、caspase-3表达均增高,而高、中剂量杞参方血清组细胞IL-1β、IL-8与caspase-3则明显低于HO组。提示杞参方可能通过降低ERK1、p38MAPK的磷酸化来减少IL-1β、IL-8与caspase-3的表达治疗干眼。
综上,杞参方可降低高渗诱导HCECs的ERK1、p38MAPK的磷酸化蛋白表达,降低细胞外液炎性细胞因子IL-1β、IL-8和细胞凋亡因子caspase-3的表达,最终有效抑制炎症反应和细胞凋亡。
| [1] |
亚洲干眼协会中国分会, 海峡两岸医药卫生交流协会眼科学专业委员会眼表与泪液病学组, 中国医师协会眼科医师分会眼表与干眼学组. 中国干眼专家共识: 定义和分类(2020年)[J]. 中华眼科杂志, 2020, 56(6): 418-422. DOI:10.3760/cma.j.cn112142-20200316-00190 |
| [2] |
王杨, 黄钰清, 杨燕宁. 地夸磷索钠滴眼液对中重度干眼患者眼表状况和视觉质量的影响[J]. 中华眼视光学与视觉科学杂志, 2021, 23(5): 329-335. DOI:10.3760/cma.j.cn115909-20201029-00418 |
| [3] |
孙旭光. 解读国际泪膜与眼表协会2017年干眼专家共识中的性别及性激素与干眼[J]. 中华眼科杂志, 2018, 54(2): 90-92. DOI:10.3760/cma.j.issn.0412-4081.2018.02.004 |
| [4] |
左韬, 赵磊, 张祝强, 等. 杞参膏治疗气阴两虚型干眼症临床观察[J]. 辽宁中医杂志, 2016, 43(3): 548-551. DOI:10.13192/j.issn.1000-1719.2016.03.038 |
| [5] |
杨稀瑞, 王继雪, 袁星星, 等. 杞菊地黄丸联合常规西药治疗干眼随机对照试验的系统评价及Meta分析[J]. 中国中医眼科杂志, 2020, 30(10): 756-760. DOI:10.13444/j.cnki.zgzyykzz.2020.10.017 |
| [6] |
肖西立, 李涓. 杞菊地黄丸治疗干眼症有效性及安全性的Meta分析[J]. 国际眼科杂志, 2020, 20(1): 96-102. DOI:10.3980/j.issn.1672-5123.2020.1.22 |
| [7] |
陈爱菊, 杨涛, 徐静. 杞菊地黄丸对干眼症基础泪液分泌的影响[J]. 中华中医药学刊, 2021, 39(2): 222-224. DOI:10.13193/j.issn.1673-7717.2021.02.056 |
| [8] |
周凯旋, 张亚杰, 关婉辰, 等. 基于整合药理学平台分析生脉饮人参方与党参方差异[J]. 中华中医药学刊, 2021, 39(2): 151-155, 275. DOI:10.13193/j.issn.1673-7717.2021.02.039 |
| [9] |
陈艳梅. 杞参膏联合角膜局部氧疗对干眼模型小鼠抗凋亡作用的实验研究[D]. 沈阳: 辽宁中医药大学, 2019.
|
| [10] |
CRAIG JP, NELSON JD, AZAR DT, et al. TFOS DEWS II report executive summary[J]. Ocul Surf, 2017, 15(4): 802-812. DOI:10.1016/j.jtos.2017.08.003 |
| [11] |
苏健, 苏恒. 脂肪细胞分化过程中MAPK信号通路的调控机制[J]. 生命的化学, 2016, 36(2): 252-256. DOI:10.13488/j.smhx.20160219 |
| [12] |
曹婷, 杨燕宁, 严江波, 等. 氟西汀对培养的人结膜上皮细胞炎性因子及丝裂原活化蛋白激酶信号通路的影响[J]. 武汉大学学报(医学版), 2018, 39(1): 74-79. DOI:10.14188/j.1671-8852.2017.0328 |
| [13] |
秦爽, 周文君, 李华, 等. p38/MAPK信号通路在高渗透压破坏角膜上皮屏障功能中的作用[J]. 第三军医大学学报, 2017, 39(23): 2282-2288. DOI:10.16016/j.1000-5404.201707055 |
| [14] |
MA B, LIU R, HU C, et al. The anti-inflammatory role of corneal epithelium-derived PEDF via inhibition of p38 activation in dry eye disease: in vivo and in vitro study[J]. Invest Ophthalmol Vis Sci, 2020, 61(7): 159. |
| [15] |
郭宣妮, 姜春辉, 朱安泰, 等. 青光眼术后干眼患者泪液中MAPK、Sirt1水平与泪膜功能的相关性分析[J]. 眼科新进展, 2020, 40(7): 663-666. DOI:10.13389/j.cnki.rao.2020.0152 |
| [16] |
彭晓芳, 彭清华, 彭俊, 等. 密蒙花滴眼液对去势雄兔干眼结膜炎性因子IL-1β和黏蛋白5AC及P38MAPK表达的影响[J]. 国际眼科杂志, 2020, 20(3): 426-431. DOI:10.3980/j.issn.1672-5123.2020.3.06 |
| [17] |
李彦霖, 郁叶, 郭婷莉, 等. 氧化应激和炎症反应中Nrf2/HO-1与MAPK的相关性[J]. 医学综述, 2021, 27(1): 8-13. DOI:10.3969/j.issn.1006-2084.2021.01.002 |
 2022, Vol. 51
2022, Vol. 51