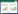文章信息
- 高超, 蒋林君, 毛明焕, 王平
- GAO Chao, JIANG Linjun, MAO Minghuan, WANG Ping
- 不同分期膀胱癌患者白蛋白与球蛋白比值的临床意义
- Clinical significance of the albumin to globulin ratio in patients with different stages of bladder cancer
- 中国医科大学学报, 2021, 50(9): 833-837
- Journal of China Medical University, 2021, 50(9): 833-837
-
文章历史
- 收稿日期:2020-10-12
- 网络出版时间:2021-09-09 12:05
膀胱癌是泌尿系统最常见的肿瘤[1],近年来发病率和死亡率均呈现增高趋势[2]。根据肿瘤浸润深度,膀胱癌分为非肌层浸润性膀胱癌(non muscle-invasive bladder cancer,NMIBC) 和肌层浸润性膀胱癌(muscle-invasive bladder cancer,MIBC)。经尿道膀胱肿瘤电切术(transurethral resection of bladder tumor,TURBT) 和膀胱根治性切除术(radical cystectomy,RC) 分别是NMIBC、MIBC主要治疗方法[3-4]。NMIBC患者预后通常较好,但仍有很高的复发风险[5]。而MIBC患者多是伴有基础疾病的老年人,围术期并发症发生率及死亡率均较高[6]。近年来研究显示很多指标(异常表达基因[7]、microRNAs[8]、长链非编码RNAs[9]) 可于预测癌症的风险和生存时间,但由于个体差异大、成本高等问题使这些指标不能成为临床检查的常规项目。因此,找到成本小且方便快捷的生物学标志物是目前亟待解决的问题。
白蛋白和球蛋白是血清蛋白的主要成分,白蛋白与球蛋白比值(albumin to globulin ratio,AGR) 在鼻咽癌[10]、非小细胞肺癌[11]、胃癌[12]、食管癌[13]、结直肠癌[14]、乳腺癌[15]等恶性肿瘤中与预后相关。本研究拟探讨不同分期膀胱癌患者AGR的临床意义,旨在为临床上找到可评估膀胱癌预后的生物学标志物提供依据。
1 材料与方法 1.1 临床资料及分组收集2013年5月至2016年9月中国医科大学附属第四医院病理诊断为膀胱癌患者的临床资料。纳入标准:(1) 病理学诊断为膀胱尿路上皮癌,NMIBC肿瘤分期为TaN0M0或T1M0N0,MIBC肿瘤分期为T2-3N0M0;(2) 患者术前无其他系统严重感染及严重营养不良;(3) 无其他恶性肿瘤病史,未采用放化疗;(4) 临床资料完整。排除标准:(1) 严重肝肾疾病影响白蛋白及球蛋白指标患者;(2) 临床资料不完整。其中,NMIBC患者115例(NMIBC组,均行TURBT治疗),MIBC患者36例(MIBC组,均行RC治疗)。另选取49例同期健康体检者为对照组。
1.2 评价指标收集NMIBC组、MIBC组性别、年龄、肿瘤数量、肿瘤大小、肿瘤分期、肿瘤分级及术前AGR各临床指标数据,同时记录对照组AGR值。通过随访获得NMIBC组3年无复发生存率和MIBC组3年无瘤生存率。随访时间:术后2年1次/3个月,第3年1次/6个月。研究终点NMIBC组为肿瘤复发,MIBC组为肿瘤进展或死亡。随访方式为电话、门诊及住院等。随访内容包括症状、体征、血尿常规、血生化指标、泌尿系统超声、肺CT、腹部CT、膀胱镜等检查。
1.3 统计学分析采用SPSS 21.0软件进行统计分析。计量资料采用x±s表示,组间比较采用独立样本t检验;计数资料采用率(%) 表示,组间比较采用χ2检验。使用受试者工作特征(receiver operator characteristic,ROC) 曲线来确定AGR的最佳截断值。Kaplan-Meier法评估3年无复发生存率和3年无瘤生存率,生存率比较采用log-rank检验。采用Cox回归分析评估可能的危险因素。P < 0.05为差异有统计学意义。
2 结果 2.1 3组AGR值比较结果显示,NMIBC组、MIBC组、对照组AGR分别为1.45±0.332、1.32±0.231、1.54±0.174,3组两两比较差异有统计学意义(均P < 0.05)。
2.2 NMIBC组AGR与其他临床指标的相关分析NMIBC组患者Roc曲线见图 1。AGR最佳截断值为1.37 (约登指数最大,兼顾灵敏度和特异度),灵敏度为0.922,特异度为0.843,曲线下面积为0.922。AGR≤1.37患者为低AGR组(n = 50),AGR>1.37患者为高AGR组(n = 65)。
|
| 图 1 NMIBC组患者Roc曲线 Fig.1 ROC curve of the NMIBC group |
与低AGR组比较,高AGR组肿瘤大小、肿瘤分期、肿瘤分级差异有统计学意义(均P < 0.05),见表 1。
| Item | Low AGR group (n = 50) | High AGR group (n = 65) | χ2 | P |
| Sex | 1.912 | 0.167 | ||
| Male | 40(34.8) | 58(50.4) | ||
| Female | 10(8.7) | 7(6.1) | ||
| Age (year) | 1.700 | 0.192 | ||
| < 60 | 10(8.7) | 20(17.4) | ||
| ≥60 | 40(34.8) | 45(39.1) | ||
| Tumor number | 1.145 | 0.285 | ||
| Solitary | 25(21.7) | 39(33.9) | ||
| Multiple | 25(21.7) | 26(22.6) | ||
| Tumor size (cm) | 4.253 | 0.039 | ||
| < 3 | 41(35.7) | 42(36.5) | ||
| ≥3 | 9(7.8) | 23(20.0) | ||
| Tumor category | 4.668 | 0.031 | ||
| Ta | 8(7.0) | 22(19.1) | ||
| T1 | 42(36.5) | 43(37.4) | ||
| Tumor differentiation | 7.739 | 0.007 | ||
| Low | 15(13.0) | 36(31.3) | ||
| High | 35(30.4) | 29(25.2) |
将单因素分析有统计学意义(P < 0.05) 指标进行多因素Cox回归分析结果显示,AGR值与肿瘤大小、肿瘤分期、肿瘤分级相关(均P < 0.05),见表 2。
| Viable | B | SE | Wald | P | Exp (B) | 95% CI |
| Tumor size | 1.345 | 0.387 | 12.064 | 0.001 | 3.840 | 1.797-8.203 |
| Tumor category | -3.249 | 1.019 | 10.172 | 0.001 | 0.039 | 0.005-0.286 |
| Tumor differentiation | -0.627 | 0.317 | 3.907 | 0.048 | 0.534 | 0.287-0.995 |
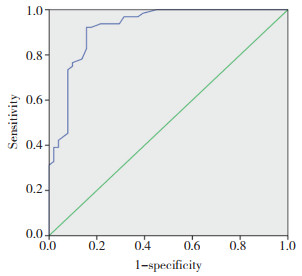
3年无复发生存率高AGR组为88%,低AGR组为14%,低AGR组明显低于高AGR组(χ2=86.842,P < 0.001)。见图 2。
|
| 图 2 2组3年无复发生存曲线 Fig.2 Three-year relapse-free survival curves for the two groups |
2.3 MIBC组AGR与其他临床指标的相关分析
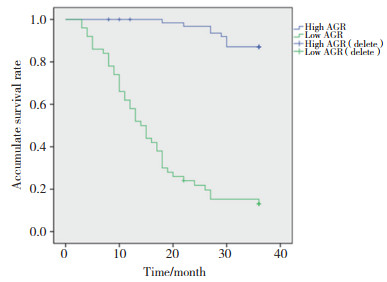
MIBC组患者Roc曲线见图 3。根据Roc曲线确定AGR的最佳截断值为1.33 (约登指数最大,兼顾灵敏度和特异度),灵敏度为0.609,特异度为0.769,曲线下面积为0.719。AGR≤1.33患者为低AGR组(n = 19),AGR>1.33患者为高AGR组(n = 17)。与低AGR组比较,高AGR组患者肿瘤分期有统计学差异(P < 0.05),见表 3。
|
| 图 3 MIBC组患者Roc曲线 Fig.3 ROC curve for the MIBC group |
| Item | Low AGR group (n = 19) | High AGR group (n = 17) | χ2 | P |
| Sex | 1.726 | 0.342 | ||
| Male | 15(41.7) | 16(44.4) | ||
| Female | 4(11.1) | 1(2.8) | ||
| Age (year) | 0.380 | 0.650 | ||
| < 60 | 2(5.6) | 3(8.3) | ||
| ≥60 | 17(47.2) | 14(38.9) | ||
| Tumor number | 1.673 | 0.299 | ||
| Solitary | 14(38.9) | 9(25.0) | ||
| Multiple | 5(13.9) | 8(22.2) | ||
| Tumor size (cm) | 0.290 | 0.717 | ||
| < 3 | 6(16.7) | 4(11.1) | ||
| ≥3 | 13(36.1) | 13(36.1) | ||
| Tumor category | 7.646 | 0.008 | ||
| T2 | 7(19.4) | 14(38.9) | ||
| T3 | 12(33.3) | 3(8.3) | ||
| Tumor differentiation | 0.007 | 1.000 | ||
| Low | 1(13.0) | 1(31.3) | ||
| High | 18(30.4) | 16(25.2) |
根据临床[16]及单因素分析结果,将年龄及肿瘤分期进行多因素Cox回归分析。结果显示,AGR值与肿瘤分期相关(P < 0.05),见表 4。
| Viable | B | SE | Wald | P | Exp (B) | 95% CI |
| Age | -1.189 | 1.414 | 0.707 | 0.400 | 0.304 | 0.019-4.870 |
| Tumor category | -2.881 | 1.047 | 7.578 | 0.006 | 0.056 | 0.007-0.436 |
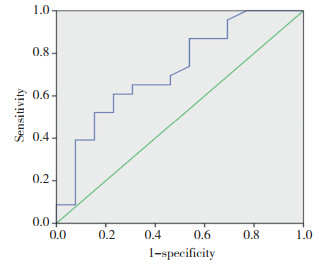
3年无瘤生存率统计结果显示,高AGR组为82%,低AGR组为47%,低AGR组明显低于高AGR组(χ2=5.195,P = 0.023)。见图 4。
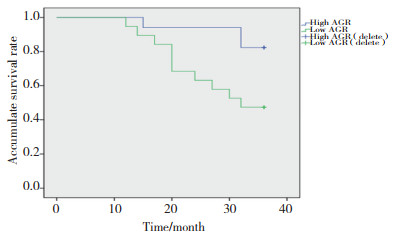
|
| 图 4 2组3年无瘤生存曲线比较 Fig.4 Comparison of 3-year disease-free survival curves for the two groups |
3 讨论
白蛋白由肝脏产生,主要发挥维持机体营养、控制渗透压稳定、运输各种物质等作用,临床上可作为评估患者营养状况的指标。球蛋白是一种慢性炎症标志物,球蛋白水平高意味着炎症反应严重,可以反映白细胞介素(白细胞介素-6、白细胞介素-1b) 和肿瘤坏死因子-α累积暴露[17]。
AGR反映患者的营养和炎症情况,可作为癌症患者预后的一个生物标志物。DU等[10]研究发现,AGR可能是评估未分化鼻咽癌患者长期预后的生物学标志物。ZHANG等[11]发现术前AGR是非小细胞肺癌患者无病生存期和生存期的预测因子,也是Ⅱ期和Ⅲ期非小细胞肺癌患者术后化疗疗效的预测指标。AZAB等[14]研究显示,低AGR (< 1.028) 可作为评估结直肠癌患者死亡率的独立预测因子。OTSUKA等[18]研究发现AGR是上尿路上皮癌预后的独立预测因子。本研究结果显示AGR值在对照组、NMIBC组、MIBC组中存在统计学差异(均P < 0.05),NMIBC患者中低AGR组(AGR≤1.37) 3年无复发生存率明显低于高AGR组(AGR>1.37,P < 0.05)。MIBC患者低AGR组(AGR≤1.33) 3年无瘤生存率明显低于高AGR组(AGR>1.33,P < 0.05)。NMIBC患者AGR与肿瘤分期、肿瘤大小及肿瘤分级相关(均P < 0.05),MIBC患者AGR与肿瘤分期相关(均P < 0.05),与以往研究结果[3, 19]一致。
综上所述,AGR与浸润性膀胱癌肿瘤分期相关,低AGR患者的3年无复发生存率、3年无瘤生存率均较高AGR患者降低。AGR容易测得,经济成本小,临床上可作为评估不同分期膀胱癌预后的生物学标志物。本研究存在以下不足之处:(1) 指标选取单一,未对其他炎性细胞因子(中性粒细胞与淋巴细胞的比值[20],血小板与淋巴细胞的比值[21]) 指标进行分析;(2) AGR值确定没有进行标准化,可能产生偏倚。今后需要多中心、多指标、更大样本量研究来进一步论证。
| [1] |
CHAVAN S, BRAY F, LORTET-TIEULENT J, et al. International variations in bladder cancer incidence and mortality[J]. Eur Urol, 2014, 66(1): 59-73. DOI:10.1016/j.eururo.2013.10.001 |
| [2] |
ROSE TL, MILOWSKY MI. Improving systemic chemotherapy for bladder cancer[J]. Curr Oncol Rep, 2016, 18(5): 27. DOI:10.1007/s11912-016-0512-2 |
| [3] |
BABJUK M, BÖHLE A, BURGER M, et al. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder: update 2016[J]. Eur Urol, 2017, 71(3): 447-461. DOI:10.1016/j.eururo.2016.05.041 |
| [4] |
BISCHOFF CJ, CLARK PE. Bladder cancer[J]. Curr Opinion Oncol, 2009, 21(3): 272-277. DOI:10.1097/cco.0b013e328329f184 |
| [5] |
SYLVESTER RJ, VAN DER MEIJDEN AP, OOSTERLINCK W, et al. Predicting recurrence and progression in individual patients with stage TaT1 bladder cancer using EORTC risk tables: a combined analysis of 2596 patients from seven EORTC trials[J]. Eur Urol, 2006, 49(3): 466-477. DOI:10.1016/j.eururo.2005.12.031 |
| [6] |
MAFFEZZINI M, GERBI G, CAMPODONICO F, et al. A multimodal perioperative plan for radical cystectomy and urinary intestinal diversion: effects, limits and complications of early artificial nutrition[J]. J Urol, 2006, 176(3): 945-948. DOI:10.1016/j.juro.2006.04.076 |
| [7] |
COLLIER LS, LARGAESPADA DA. Transforming science: cancer gene identification[J]. Curr Opin Genet Dev, 2006, 16(1): 23-29. DOI:10.1016/j.gde.2005.11.001 |
| [8] |
HE Y, LIN J, KONG D, et al. Current state of circulating microRNAs as cancer biomarkers[J]. Clin Chem, 2015, 61(9): 1138-1155. DOI:10.1373/clinchem.2015.241190 |
| [9] |
CHENG W, ZHANG Z, WANG J. Long noncoding RNAs: new players in prostate cancer[J]. Cancer Lett, 2013, 339(1): 8-14. DOI:10.1016/j.canlet.2013.07.008 |
| [10] |
DU XJ, TANG LL, MAO YP, et al. The pretreatment albumin to globulin ratio has predictive value for long-term mortality in nasopharyngeal carcinoma[J]. PLoS One, 2014, 9(4): e94473. DOI:10.1371/journal.pone.0094473 |
| [11] |
ZHANG H, ZHANG B, ZHU K, et al. Preoperative albumin-to-globulin ratio predicts survival in patients with non-small-cell lung cancer after surgery[J]. J Cell Physiol, 2019, 234(3): 2471-2479. DOI:10.1002/jcp.26766 |
| [12] |
MAO MJ, WEI XL, SHENG H, et al. Clinical significance of preoperative albumin and globulin ratio in patients with gastric cancer undergoing treatment[J]. Biomed Res Int, 2017, 2017: 3083267. DOI:10.1155/2017/3083267 |
| [13] |
TOIYAMA Y, YASUDA H, OHI M, et al. Clinical impact of preoperative albumin to globulin ratio in gastric cancer patients with curative intent[J]. Am J Surg, 2017, 213(1): 120-126. DOI:10.1016/j.amjsurg.2016.05.012 |
| [14] |
AZAB B, KEDIA S, SHAH N, et al. The value of the pretreatment albumin/globulin ratio in predicting the long-term survival in colorectal cancer[J]. Int J Colorectal Dis, 2013, 28(12): 1629-1636. DOI:10.1007/s00384-013-1748-z |
| [15] |
AZAB BN, BHATT VR, VONFROLIO S, et al. Value of the pretreatment albumin to globulin ratio in predicting long-term mortality in breast cancer patients[J]. Am J Surg, 2013, 206(5): 764-770. DOI:10.1016/j.amjsurg.2013.03.007 |
| [16] |
ALJABERY F, LIEDBERG F, HAGGSTROM C, et al. Management and outcome of muscle-invasive bladder cancer with clinical lymph node metastases. A nationwide population-based study in the bladder cancer data base Sweden (BladderBaSe)[J]. Scand J Urol, 2019, 53(5): 332-338. DOI:10.1080/21681805.2019.1681504 |
| [17] |
GABAY C, KUSHNER I. Acute-phase proteins and other systemic responses to inflammation[J]. N Engl J Med, 1999, 340(6): 448-454. DOI:10.1056/nejm199902113400607 |
| [18] |
OTSUKA M, KAMASAKO T, UEMURA T, et al. Prognostic role of the preoperative serum albumin: globulin ratio after radical nephroureterectomy for upper tract urothelial carcinoma[J]. Int J Urol, 2018, 25(10): 871-878. DOI:10.1111/iju.13767 |
| [19] |
毛士玉, 黄天宝, 熊大波, 等. 吸烟影响非肌层浸润性膀胱癌预后的研究进展[J]. 现代泌尿外科杂志, 2016, 21(1): 73-76. DOI:10.3969/j.issn.1009-8291.2016.01.021 |
| [20] |
MARCHIONI M, PRIMICERI G, INGROSSO M, et al. The clinical use of the neutrophil to lymphocyte ratio (NLR) in urothelial cancer: a systematic review[J]. Clin Genitourin Cancer, 2016, 14(6): 473-484. DOI:10.1016/j.clgc.2016.04.008 |
| [21] |
YOU J, ZHU GQ, XIE L, et al. Preoperative platelet to lymphocyte ratio is a valuable prognostic biomarker in patients with colorectal cancer[J]. Oncotarget, 2016, 7(18): 25516-25527. DOI:10.18632/oncotarget.8334 |
 2021, Vol. 50
2021, Vol. 50