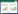文章信息
- 吴灵霞, 韩雪, 高康宁, 祁赞梅
- WU Lingxia, HAN Xue, GAO Kangning, QI Zanmei
- Listr1遗传位点对小鼠非酒精性脂肪性肝病易感性的影响
- Influence of the Listr1 gene locus on murine susceptibility to non-alcoholic fatty liver disease
- 中国医科大学学报, 2021, 50(9): 809-813, 819
- Journal of China Medical University, 2021, 50(9): 809-813, 819
-
文章历史
- 收稿日期:2020-09-24
- 网络出版时间:2021-09-09 16:27
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD) 是慢性肝病(如肝癌和肝硬化) 常见的原因,包括单纯性脂肪肝和非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH),后者伴有不同程度的纤维化[1]。固有免疫反应的活化及肝内炎症对NAFLD的病理机制具有重大影响,并且导致单纯性脂肪肝进展为NASH [2-4]。巨噬细胞是固有免疫的关键细胞组分,肝脏内巨噬细胞包括枯否细胞和单核来源巨噬细胞。研究[4-7]表明,枯否细胞最早对肝细胞损伤作出反应。肝内巨噬细胞分泌炎症介质如白细胞介素(interleukine,IL) -1β和肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α),刺激肝细胞和肝星状细胞诱导肝脂肪变性和纤维化;同时,研究[8-9]发现去除枯否细胞或者体内单核细胞显著抑制NAFLD的进展。
此前的研究[10-11]提示Listr1遗传位点可能通过影响稳态下肝内巨噬细胞亚群数量调控小鼠肝内天然抗感染免疫,由于肝内巨噬细胞在NAFLD的发生发展中具有重要作用,因此推测Listr1遗传位点可能控制小鼠对NAFLD的易感性。
1 材料与方法 1.1 实验动物及分组C.B6By-Listr1是以BALB/c小鼠为基因的背景鼠,通过杂交和回交方式引入C57BL/6小鼠的Listr1等位基因而得到的同系类小鼠,由美国麻省大学医学院Victor Boyartchuk实验室赠送。C.B6By-Listr1实验组及BALB/c对照组小鼠为6~8周龄、雄性。通过喂养小鼠45%的高脂高糖饮食诱导NAFLD模型[12],高脂饲料购自北京华阜康生物技术有限公司[饲料编号:H10045,许可证号:SCXK (京) 2014-2008]。果糖添加于饮用水中(终浓度为42.0 g/L)。
1.2 检测小鼠各项生理指标每周称量小鼠体质量,监测并分析体质量变化情况。于第4、8、12、16、20周取小鼠眼球静脉血,检测丙谷氨酸转氨酶(alanine aminotransferase,ALT),动态监测小鼠肝功能变化。
1.3 肝脏病理检查喂养高脂高果糖饮食4、8、12、16、20周后,脱颈处死小鼠,通过门静脉灌流30 mL PBS,取肝脏放入4%多聚甲醛中固定,常规制备石蜡切片进行HE染色及天狼猩红染色,观测肝内脂肪变性、气球样变性及纤维化程度。抗巨噬细胞半乳糖特异性凝集素(macrophage galactose specific lectin,Mac-2) 抗体免疫组化染色,观察巨噬细胞活化。肝脏组织进行OCT包埋,冰冻切片后进行油红O染色,观察肝脏脂肪变性。图像用ImageJ软件定量分析。
1.4 实时PCR检测肝内细胞因子及趋化因子表达水平取少量肝脏组织,使用Trizol试剂提取总RNA,按PrimeScriptTMRT reagent Kit with gDNA Eraser说明书进行反转录。根据SYBR Premix Ex TaqTM Ⅱ试剂盒说明书进行扩增(美国Applied Biosystems Quant Studio公司),检测小鼠肝脏单核细胞趋化蛋白-1 (monocyte chemoattractant protein-1,MCP-1)、IL-1β、TNF-α和IL-6 mRNA表达水平。β-actin作为内参基因,引物序列见表 1。
| Gene | Forward primers (5’- 3’) | Reversed primers (5’-3’) |
| β-actin | GATTACTGCTCTGGCTCCTAGC | GACTCATCGTACTCCTGCTTGC |
| IL-1β | GAAATGCCACCTTTTGACAGTG | CTGGATGCTCTCATCAGGACA |
| IL-6 | AGACTTCCATCCAGTTGCCT | CAGGTCTGTTGGGAGTGGTA |
| TNF-α | CCCTCACACTCAGATCATCTTC | GTTGGTTGTCTTTGAGATCCAT |
| MCP-1 | TTAAAAACCTGGATCGGAACCAA | GGCTAAGTGATAATCATTGCAGG |
1.5 统计学分析
采用Graphad Prism统计软件对数据进行处理,组间比较采用配对样本t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 C57BL/6来源的Listr1遗传位点抑制高脂高糖饮食诱导的肝脂肪变性C.B6By-Listr1小鼠体质量明显低于BALB/c小鼠(图 1A),同时其肝脏质量也低于BALB/c小鼠,第8周和12周差异有统计学意义,C.B6By-Listr1小鼠和BALB/c小鼠第8和12周具体肝脏质量分别为(1.723±0.109) g vs (2.185±0.082) g,(1.914±0.06) g vs (2.253±0.116) g (图 1B)。随着高脂高糖饮食喂养时间的延长,C.B6By-Listr1和BALB/c小鼠的肝脏结构紊乱进行性加重(图 1C),第4周和第8周小鼠肝脏病理显示轻微的气球样变,第12周小鼠肝脏出现脂肪样变性且逐渐加重。油红O染色评估肝脏脂肪变性发现C.B6By-Listr1小鼠脂肪变性程度低于BALB/c小鼠(图 1D),第4、8和20周差异有统计学意义(图 1E)。因此,推断C57BL/6来源的Listr1遗传位点有抑制饮食诱导肝脂肪变性的作用。
|
| A, weight gain; B, liver weight; C, HE staining (×100);D, oil red O-staining (×200);E, oil red O-stained area were quantified. * P < 0.001;# P < 0.05;** P < 0.01. 图 1 Listr1遗传位点对饮食诱导的肝脂肪变性的影响 Fig.1 Impact of the Listr1 gene locus on diet-induced hepatic steatosis |
2.2 C57BL/6来源的Listr1遗传位点减轻高脂高糖饮食诱导的肝炎
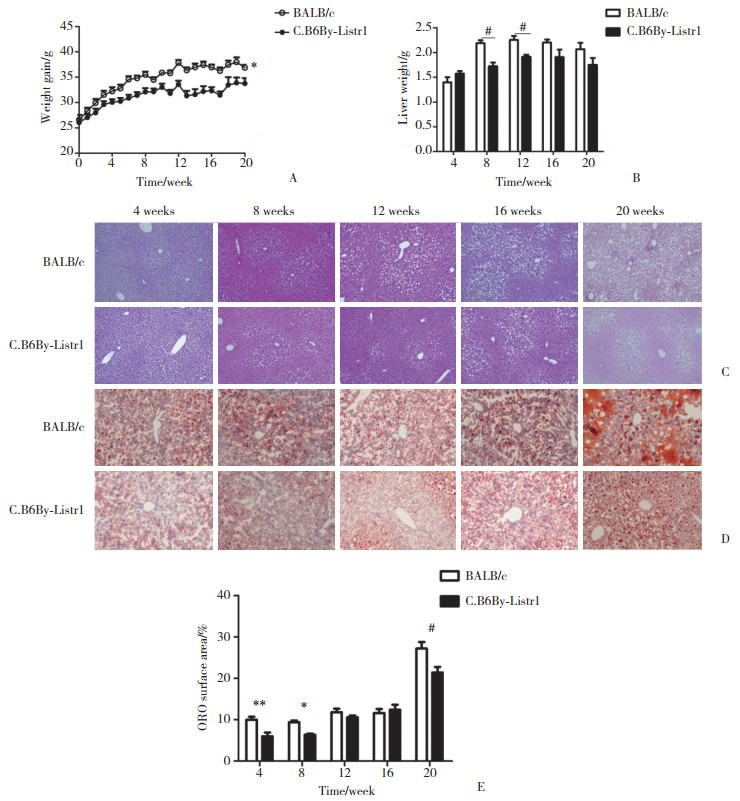
慢性肝损伤通常诱导炎症细胞活化以及细胞因子和趋化因子的表达。在疾病早期,2种小鼠炎症因子表达水平无明显差异,但是12周后C.B6By-Listr1小鼠肝内IL-1β、MCP-1和TNF-α mRNA表达水平明显低于BALB/c小鼠(图 2A~2C,表 2)。高脂高糖饮食诱导20周,C.B6By-Listr1小鼠肝内IL-6表达水平明显低于BALB/c小鼠(0.139±0.017 vs 0.837±0.167),差异有统计学意义(图 2D)。Mac-2是一种巨噬细胞活化标志[13]。第16周和第20周C.B6By-Listr1小鼠巨噬细胞活化少于BALB/c小鼠(分别为0.603±0.086 vs 1.667±0.471;0.833±0.236 vs 3±0.816) (图 2E、2F)。以上结果表明C.B6By-Listr1小鼠肝内炎症更轻,C57BL/6来源的Listr1遗传位点可能抑制饮食诱导的肝炎的形成。
|
| A, IL-1β; B, MCP-1;C, TNF-α; D, IL-6;E, Mac-2;F, immunohistochemistry (×200). * P < 0.05;# P < 0.001. 图 2 Listr1遗传位点对饮食诱导的肝炎的影响 Fig.2 Impact of the Listr1 gene locus on diet-induced hepatic inflammation |
| Gene | 12 weeks | 16 weeks | 20 weeks | |||||
| C.B6By-Listr1 | BALB/c | C.B6By-Listr1 | BALB/c | C.B6By-Listr1 | BALB/c | |||
| IL-1β | 1.070±0.171 | 3.080±0.366 | 1.568±0.071 | 5.114±0.257 | 1.461±0.071 | 3.920±0.122 | ||
| MCP-1 | 0.500±0.061 | 1.168±0.133 | 0.976±0.059 | 2.952±0.242 | 1.401±0.010 | 4.571±0.653 | ||
| TNF-α | 0.832±0.113 | 1.507±0.297 | 1.328±0.016 | 3.405±0.527 | 3.569±0.308 | 5.124±0.154 | ||
2.3 C57BL/6来源的Listr1遗传位点缓解高脂高糖饮食诱导的肝纤维化
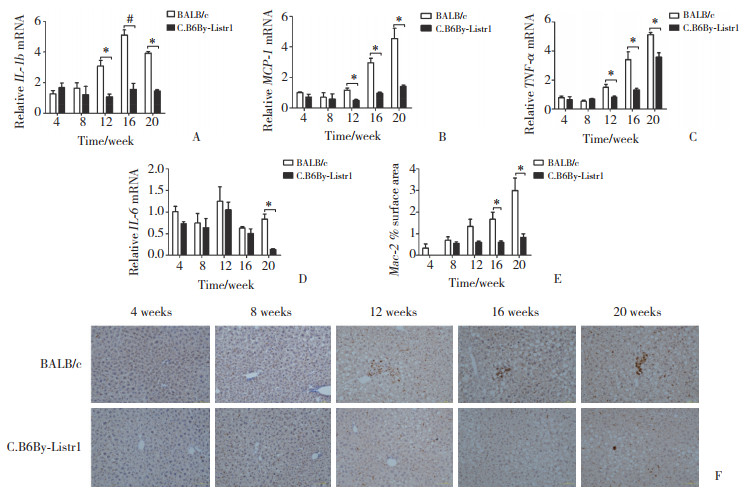
对不同时期肝脏切片进行天狼星红染色,结果显示,诱导16周的小鼠肝脏出现纤维化,并且C.B6By-Listr1小鼠纤维化程度低于BALB/c小鼠(图 3A),纤维化阳性表面积定量分析展示第16和20周差异有统计学意义(1.833±0.236 vs 3.833±0.850;2.333±0.471 vs 5.472±0.579) (图 3B)。通过ALT评价肝功能发现第12、16和20周C.B6By-Listr1小鼠ALT水平明显低于BALB/c小鼠,分别为(54.0±2.0) U/L vs (85.5±3.5) U/L、(61.5±5.5) U/L vs (113.5±8.5) U/L和(53.5±0.5) U/L vs (183.5±22.5) U/L,差异有统计学意义(图 3C)。因此,推测Listr1遗传位点具有缓解肝纤维化和肝损伤的作用。
|
| A, sirius red staining (×100);B, sirius red-stained area were quantified; C, ALT. * P < 0.05;** P < 0.01. 图 3 Listr1遗传位点对饮食诱导的肝纤维化的影响 Fig.3 Impact of the Listr1 gene locus on diet-induced hepatic fibrosis |
3 讨论
Listr1遗传位点是控制小鼠对单核细胞增生性李斯特菌易感性的数量性状位点,此前的研究[10-11]提示该位点可能通过影响肝内固有免疫发挥作用。本研究进一步探讨了Listr1遗传位点对小鼠NAFLD易感性的影响。
喂养高脂高糖饮食诱导的小鼠NAFLD模型与人类NAFLD高度相似,主要表现具有相同的炎症细胞活化、肝脏脂肪变性、纤维化和代谢综合征[4, 12]。给予高脂高糖饮食后,C.B6By-Listr1小鼠体质量和肝脏质量低于BALB/c小鼠,同时C.B6By-Listr1小鼠脂肪变性的发生晚于BALB/c小鼠,且程度更轻。目前尚不清楚导致这些差异的直接原因,但是第12周开始,研究检测到C.B6By-Listr1小鼠炎性细胞因子IL-1β、MCP-1、TNF-α和IL-6水平明显低于BALB/c小鼠。有文献[14-15]报道肝细胞内脂质聚积和脂滴形成激活枯否细胞释放促炎因子,炎性细胞因子促进脂肪酸合成,导致甘油三酯向肝脏聚集加重肝脂肪变性;MCP-1也可以通过减少M2巨噬细胞极化,降低能量消耗[16]。据此推测BALB/c小鼠脂肪变性更严重可能与肝脏高水平炎性细胞因子密切相关,两者相互促进,导致NAFLD的形成和进展。
慢性炎症是肝纤维化的主要原因,C.B6By-Listr1小鼠纤维化和肝细胞损伤程度轻于BALB/c小鼠,与肝脏炎症、脂肪变性结果相一致,进一步证实高脂高糖饮食在BALB/c小鼠肝脏中诱发更加强烈的免疫反应。肝内巨噬细胞是诱导肝脏炎症和肝星型细胞活化的关键细胞,C.B6By-Listr1小鼠肝内巨噬细胞活化少于BALB/c小鼠,此前在李斯特菌感染的小鼠模型中也观察到Listr1位点影响巨噬细胞亚群的数量与功能[10]。故此推测Listr1遗传位点可能通过相似的机制控制小鼠对肝内感染性疾病和非感染性疾病的易感性,C57BL/6来源的Listr1遗传位点具有减少巨噬细胞活化,抑制IL-1β、MCP-1、TNF-α和IL-6表达的作用。
本课题组的前期研究[10-11]提示,Listr1遗传位点中候选易感基因是趋化因子CXCL11编码基因,BALB/c小鼠的CXCL11编码基因为功能性基因,而C57BL/6小鼠携带缺陷等位基因。CXCL11与CXCL9、CXCL10共用同一受体CXCR3,具有趋化活化的T细胞和多种固有免疫细胞的作用。有研究[13]显示CXCR3及其配体在慢性肝炎的进展中发挥重要作用。慢性肝病患者CXCL9、CXCL10、CXCL11水平明显升高,并且CXCL9、CXCL10与肝纤维化严重程度呈正相关。CXCR3-/-小鼠与野生型小鼠相比,对饮食诱导的NAFLD具有更强的抵抗性,这主要是由于CXCR3-/-小鼠显著减少促炎因子的表达。在CXCL10-/-和野生型NAFLD小鼠模型中,CXCL10-/-小鼠可以通过减少肝脏巨噬细胞浸润、缓解炎症水平和纤维化程度,从而改善肝功能[13]。这些研究以及本文中的发现都提示CXCR3及其配体在NAFLD的发生发展中发挥重要作用,但是这一通路的具体作用机制仍不清楚。
Listr1遗传位点不仅控制小鼠对李斯特菌的易感性,也控制小鼠对NAFLD的易感性,深入研究其调控肝内免疫应答的机制特别是对巨噬细胞数量和亚群的调控机制具有重要意义。
| [1] |
MUSSO G, CASSADER M, GAMBINO R. Non-alcoholic steatohepatitis: emerging molecular targets and therapeutic strategies[J]. Nat Rev Drug Discov, 2016, 15(4): 249-274. DOI:10.1038/nrd.2015.3 |
| [2] |
IBRAHIM SH, HIRSOVA P, GORES GJ. Non-alcoholic steatohepatitis pathogenesis: sublethal hepatocyte injury as a driver of liver inflammation[J]. Gut, 2018, 67(5): 963-972. DOI:10.1136/gutjnl-2017-315691 |
| [3] |
ARRESE M, CABRERA D, KALERGIS AM, et al. Innate immunity and inflammation in NAFLD/NASH[J]. Dig Dis Sci, 2016, 61(5): 1294-1303. DOI:10.1007/s10620-016-4049-x |
| [4] |
YU Y, LIU Y, AN W, et al. STING-mediated inflammation in Kupffer cells contributes to progression of nonalcoholic steatohepatitis[J]. J Clin Invest, 2019, 129(2): 546-555. DOI:10.1172/jci121842 |
| [5] |
TOSELLO-TRAMPONT AC, LANDES SG, NGUYEN V, et al. Kuppfer cells trigger nonalcoholic steatohepatitis development in diet-induced mouse model through tumor necrosis factor-α production[J]. J Biol Chem, 2012, 287(48): 40161-40172. DOI:10.1074/jbc.m112.417014 |
| [6] |
KLEIN I, CORNEJO JC, POLAKOS NK, et al. Kupffer cell heterogeneity: functional properties of bone marrow derived and sessile hepatic macrophages[J]. Blood, 2007, 110(12): 4077-4085. DOI:10.1182/blood-2007-02-073841 |
| [7] |
TRAN S, BABA I, POUPEL L, et al. Impaired kupffer cell self-renewal alters the liver response to lipid overload during non-alcoholic steatohepatitis[J]. Immunity, 2020, 53(3): 627-640. DOI:10.1016/j.immuni.2020.06.003 |
| [8] |
YANG YY, HUANG YT, TSAI TH, et al. Kupffer cell depletion attenuates leptin-mediated methoxamine-stimulated portal perfusion pressure and thromboxane A2 release in a rodent model of NASH-cirrhosis[J]. Clin Sci (Lond), 2012, 123(12): 669-680. DOI:10.1042/cs20110572 |
| [9] |
MIURA K, YANG L, VAN ROOIJEN N, et al. Hepatic recruitment of macrophages promotes nonalcoholic steatohepatitis through CCR2[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302(11): G1310-G1321. DOI:10.1152/ajpgi.00365.2011 |
| [10] |
QI ZM, WANG J, HAN X, et al. Listr1 locus regulates innate immunity against Listeria monocytogenes infection in the mouse liver possibly through Cxcl11 polymorphism[J]. Immunogenetics, 2014, 66(4): 231-242. DOI:10.1007/s00251-014-0761-x |
| [11] |
张一彤, 韩雪, 张毅, 等. Listr1遗传位点影响小鼠对约氏疟原虫易感性的研究[J]. 微生物学杂志, 2019, 39(3): 58-63. DOI:10.3969/j.issn.1005-7021.2019.03.009 |
| [12] |
CHARLTON M, KRISHNAN A, VIKER K, et al. Fast food diet mouse: novel small animal model of NASH with ballooning, progressive fibrosis, and high physiological fidelity to the human condition[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 301(5): G825-G834. DOI:10.1152/ajpgi.00145.2011 |
| [13] |
TOMITA K, FREEMAN BL, BRONK SF, et al. CXCL10-mediates macrophage, but not other innate immune cells-associated inflammation in murine nonalcoholic steatohepatitis[J]. Sci Rep, 2016, 6: 28786. DOI:10.1038/srep28786 |
| [14] |
NEGRIN KA, ROTH FLACH RJ, DISTEFANO MT, et al. IL-1 signaling in obesity-induced hepatic lipogenesis and steatosis[J]. PLoS One, 2014, 9(9): e107265. DOI:10.1371/journal.pone.0107265 |
| [15] |
MA M, DUAN R, ZHONG H, et al. The crosstalk between fat homeostasis and liver regional immunity in NAFLD[J]. J Immunol Res, 2019, 2019: 3954890. DOI:10.1155/2019/3954890 |
| [16] |
RAJASEKARAN M, SUL OJ, CHOI EK, et al. MCP-1 deficiency enhances browning of adipose tissue via increased M2 polarization[J]. J Endocrinol, 2019, 242(2): 91-101. DOI:10.1530/joe-19-0190 |
 2021, Vol. 50
2021, Vol. 50