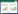文章信息
- 韩冲, 于洋洋, 党军, 姚雷, 李光
- HAN Chong, YU Yangyang, DANG Jun, YAO Lei, LI Guang
- Raf激酶抑制蛋白表达水平与非小细胞肺癌放射敏感性的关系
- The relationship between RKIP expression and non-small cell lung cancer radiosensitivity
- 中国医科大学学报, 2021, 50(9): 789-793
- Journal of China Medical University, 2021, 50(9): 789-793
-
文章历史
- 收稿日期:2020-11-24
- 网络出版时间:2021-09-09 15:24
肺癌是目前全世界发病率最高的恶性肿瘤,其中非小细胞肺癌(non-small cell lung cancer,NSCLC) 约占肺癌总数的85%~90%[1]。放射治疗是局部进展期NSCLC的主要治疗手段[2],但局部进展期NSCLC的5年生存率不足15%[3],局部未控率高达70%,放射抗拒是影响放射治疗效果的主要生物学因素[4]。深入了解细胞放射敏感性的影响因素,找出特异性的分子靶点,在放射治疗前准确预测NSCLC的放射敏感性是实现NSCLC个体化、高效治疗的关键。
Raf激酶抑制蛋白(Raf kinase inhibitor protein,RKIP) 在乳腺癌、前列腺癌、肺癌等多种恶性肿瘤中表达减少[5],与Raf-1/MEK/ERK、G蛋白耦联受体、核因子κB (nuclear factor-kappa B)、Wnt等多种信号通路的调节有关,导致肿瘤进展及治疗抵抗[6]。本研究通过检测放射治疗前NSCLC组织中RKIP的表达,分析RKIP蛋白表达与放射敏感性的相关关系。
1 材料与方法 1.1 材料选择2012年至2014年在我院行根治性放射治疗的NSCLC患者,共106例,卡氏(Karnofsky,KPS) 评分均≥80分。其中,男76例,女30例;年龄40~83岁(中位年龄61岁);鳞状细胞癌72例,腺癌34例。参考国际抗癌联盟第八版肺癌TNM分期标准分期,T1 12例,T2 49例,T3 38例,T4 7例,N0~1期52例,N2~3期54例;临床分期Ⅱ期59例,Ⅲ期47例。所有病例入组时均无手术适应证,均未行同期化学治疗。
1.2 放射治疗用真空垫及热塑体模固定患者,行C4~L2椎体下缘范围5 mm层厚CT增强定位;将CT扫描信息传输至Pinnacle9.0 (美国ADAC公司) 放射治疗计划系统,由2名临床医师勾画大体肿瘤区(gross target volume,GTV) 和危及器官(organ at risk,OAR);原发病灶为GTV,纵隔区肿大淋巴结(短径>1 cm) 为GTVnd。GTV外放6~8 mm为临床靶区(clinical target volume,CTV),不做纵隔淋巴引流区预防性照射。计划靶区(planning target volume,PTV) 在CTV的基础上前后左右外放5 mm,上下外放10 mm。采用适形调强放射治疗技术,6 MV-X线照射,2 Gy/次,1次/d,5次/周。初治剂量达到40 Gy时再次行CT定位,根据瘤体变化情况修改肿瘤靶区继续放射治疗,总剂量达到60~66 Gy/30~33次。
1.3 放射敏感性及近期疗效评价放射治疗至40 Gy时再次行CT定位,并将图像与放射治疗前图像融合,利用TPS系统的体积计算模块计算原发病灶GTV缩小百分率,应用受试者工作特征(receiver operating characteristic,ROC) 曲线截点值区分以GTV缩小百分率为评价指标的放射敏感性。
1.4 免疫组化染色及判定放射治疗前病理活检组织标本均以10%甲醛固定,石蜡包埋封存,并经HE染色病理确诊。采用兔抗人RKIP多克隆抗体(sc-28837,美国santa cruz生物工程公司)。切片微波抗原修复后,行SP法免疫组化染色,DAB显色,RKIP定位于细胞质。判定标准:高倍镜下(×400) 每张切片随机选择5个视野,计数200个细胞/视野,辅以计算机图像分析结果,以细胞质中出现棕黄色颗粒为阳性细胞。RKIP蛋白表达无阳性细胞为0分,阳性细胞簇≤25%为1分,>25%~50%为2分,>50%~75%为3分,>75%为4分。着色强度无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。阳性细胞积分与着色强度积分分别相加:0~2为低表达(-),3~5分为中表达(+),6~7分为高表达(++),其中(+) 和(++) 判定为阳性[7]。所有结果均由2名病理医师采用盲法单独判定。
1.5 统计学分析采用SPSS 19.0统计软件包进行数据处理。评分截点值采用ROC曲线分析,率的比较采用χ2检验,放射敏感性相关的多因素分析应用logistic回归分析,指标间相关性分析应用Spearman等级相关分析,P < 0.05为差异有统计学意义。
2 结果 2.1 RKIP表达水平及其与NSCLC临床病理特征的关系免疫组化染色结果显示,RKIP蛋白阳性表达率为65.1% (69/106),见图 1。无纵膈淋巴结转移(N0~1) 的NSCLC患者RKIP阳性表达率[84.6% (44/52)]高于有纵膈淋巴结转移(N2~3) 的患者[46.3% (25/54)],差异有统计学意义(P < 0.05)。临床分期Ⅱ期的NSCLC患者RKIP阳性表达率为[79.7% (47/59)]高于Ⅲ期患者[46.8% (22/47)],差异有统计学意义(P < 0.05)。
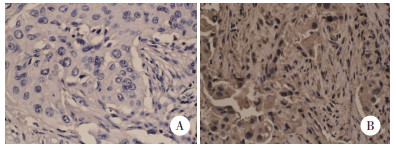
|
| A, RKIP (-); B, RKIP (+). 图 1 NSCLC中RKIP的表达SP法×400 Fig.1 Expression of RKIP in NSCLC SP ×400 |
RKIP表达与患者的性别、年龄、病理类型及原发肿瘤T分期之间无相关性(P > 0.05),见表 1。
| Clinicopathological factors | n | RKIP | ||
| Positive [n (%)] | χ2 | P | ||
| Gender | 0.046 | 0.831 | ||
| Male | 76 | 49(64.5) | ||
| Female | 30 | 20(66.7) | ||
| Age (year) | 0.804 | 0.370 | ||
| ≤60 | 55 | 38(69.1) | ||
| >60 | 51 | 31(60.8) | ||
| Pathological pattern | 0.665 | 0.415 | ||
| SCC | 72 | 45(62.5) | ||
| ADC | 34 | 24(70.6) | ||
| T stage | 7.629 | 0.054 | ||
| T1 | 12 | 4(33.3) | ||
| T2 | 49 | 31(63.3) | ||
| T3 | 38 | 29(76.3) | ||
| T4 | 7 | 5(71.4) | ||
| N stage | 17.119 | < 0.001 | ||
| N0-1 | 52 | 44(84.6) | ||
| N2-3 | 54 | 25(46.3) | ||
| Clinical stage | 12.426 | < 0.001 | ||
| Ⅱ | 59 | 47(79.7) | ||
| Ⅲ | 47 | 22(46.8) | ||
| SCC, squamous cell carcinoma;ADC, adenocarcinoma. | ||||
2.2 NSCLC放射敏感性与临床分期及RKIP表达水平的Spearman相关性分析
对106例NSCLC患者GTV缩小百分率进行ROC曲线分析,截点值为33.6%,特异度84.1%,灵敏度81.4%,见图 2。将 < 33.6%定义为低放射敏感,≥33.6%定义为高放射敏感,低放射敏感者37例,高放射敏感者69例。Spearman相关分析显示,临床分期及RKIP表达水平与NSCLC的放射敏感性具有相关性(r = -0.235,P < 0.05;r = 0.257,P < 0.05),临床分期早、RKIP表达水平高的NSCLC患者放射敏感性高。而性别、年龄、病理类型及原发肿瘤T分期、淋巴结转移N分期与NSCLC患者放射敏感性无明显相关性(r分别为-0.072、-0.091、0.003、0.166、-0.040,P > 0.05),见表 2。
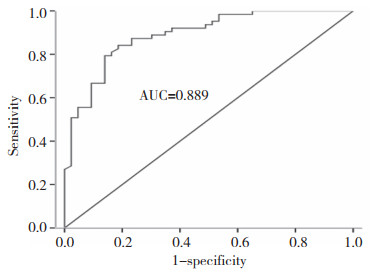
|
| 图 2 NSCLC患者GTV缩小ROC曲线 Fig.2 GTV reduces ROC curve in NSCLC |
| Clinicopathological factors | Radiosensitivity | |
| r | P | |
| Gender (male vs female) | -0.072 | 0.466 |
| Age (≤60 years old vs >60 years old) | -0.091 | 0.355 |
| Pathological pattern (SCC vs ADC) | 0.003 | 0.975 |
| T stage (T1-3 vs T4) | 0.166 | 0.089 |
| N stage (N0-1 vs N2-3) | -0.040 | 0.683 |
| Clinical stage (Ⅱ vs Ⅲ) | -0.235 | 0.015 |
| RKIP expression [(-) vs (+)] | 0.257 | 0.009 |
2.3 影响NSCLC放射敏感性的logistic多因素分析
将上述P < 0.05的因素(临床分期以及RKIP表达情况) 纳入logistic回归模型中,分析结果显示,RKIP表达水平是NSCLC放射敏感性的独立相关因素(Wald=4.041,P = 0.044),见表 3。
| Variable | B | SE | Wald | df | P | OR |
| RKIP | 0.608 | 0.302 | 4.041 | 1 | 0.044 | 1.837 |
| Clinical stage | -0.759 | 0.422 | 3.242 | 1 | 0.072 | 0.468 |
| Constant | 0.984 | 1.287 | 0.585 | 1 | 0.444 | 2.676 |
3 讨论
RKIP属于磷脂酰乙醇胺结合蛋白家族,是近年来发现的一种新的肿瘤转移抑制因子,在多种人类恶性肿瘤(如肺癌、前列腺癌、肝细胞癌、结直肠癌、乳腺癌及鼻咽癌) 中,RKIP蛋白的表达明显减少[5],尤其在转移的淋巴结中RKIP蛋白不表达或者显著降低[8-9],RKIP蛋白表达下降与肿瘤的发生、发展及侵袭转移相关,增加RKIP的蛋白表达可以调控细胞通路,抑制血管生成,阻止脉管入侵,显著抑制肿瘤的侵袭、转移能力。文献[6]报道,RKIP蛋白过表达可逆转肿瘤细胞的化学、免疫、放射治疗抵抗性,并重启免疫系统对肿瘤细胞的监视及清除作用。胡春杰等[10]发现,上调宫颈癌细胞RKIP基因的表达能够抑制宫颈癌细胞的增殖、侵袭和转移,是宫颈癌治疗的新靶点。刘学飞等[11]研究发现RKIP与乳腺癌的恶化程度有关,RKIP能够抑制乳腺癌细胞的迁移和侵袭,且其作用机制可能是通过对NF-κB的负调控而实现。
NSCLC具有高侵袭性、高转移性及放化疗抵抗,与肿瘤细胞逃逸宿主免疫监视及异常免疫应答有关,严重影响肺癌患者的治疗效果,是导致患者高死亡率的重要原因。肺癌侵袭与转移的分子机制是目前急需研究探讨的课题。本研究结果显示,随临床分期进展,NSCLC组织中RKIP蛋白表达阳性率逐步降低(P < 0.05);RKIP蛋白表达在有纵隔淋巴结转移的NSCLC中较无纵隔淋巴转移者明显降低(P < 0.05);RKIP蛋白表达与患者的性别、年龄、病理类型及原发肿瘤T分期无关,证实了RKIP蛋白在NSCLC的发生、发展和淋巴结转移的机制中起重要作用,提示RKIP在肺癌中可能是肿瘤抑制因子。其具体机制可能与参与Raf-1/MEK/ERK、G蛋白耦联受体和NF-κB等多种信号通路的调节有关[12]。RKIP也可通过干扰GSK3β影响细胞分裂和凋亡[6, 13]。
迄今为止的癌症模型中,RKIP被认为具有细胞凋亡诱导剂的作用,并能够启动抗性肿瘤细胞对常规治疗方式的再敏化和对宿主免疫监视的敏感性。RKIP是一种可提高化学治疗效果的增敏剂,已在宫颈癌、肺腺癌、胃癌、前列腺癌和乳腺癌等多种肿瘤中得以证实[13]。最近,YUAN等[14]发现RKIP表达低的鼻咽癌患者临床分期及淋巴结转移率均高,且放射敏感性低,预后不良,是鼻咽癌的独立预后因素。体外培养细胞研究发现,沉默RKIP表达后,鼻咽癌细胞的放射敏感性降低,而上调鼻咽癌细胞RKIP表达则可通过减少Raf-1/MEK/ERK通路中MEK和ERK的磷酸化作用,提高放射诱导的细胞凋亡,从而提高鼻咽癌细胞的放射敏感性。目前,RKIP蛋白表达与NSCLC放射敏感性相关关系的报道极少,近年有研究[7]发现RKIP基因沉默和RKIP蛋白表达下降可能激活了NSCLC中Shh信号转导通路的表达,使NSCLC细胞具有肿瘤干细胞属性,产生几乎无限的复制潜力,将明显提高肿瘤细胞的放射抵抗能力。本研究中,Spearman相关性分析结果显示,临床分期及RKIP表达水平与NSCLC的放射敏感性具有相关性,临床分期早、RKIP表达水平高的NSCLC患者放射敏感性高。多因素分析显示,RKIP表达水平是NSCLC放射敏感性的独立相关因素。表明RKIP可做为预测NSCLC放射敏感性的有效生物学指标,对实现NSCLC放射敏感性的基因靶向调节、有针对性地进行个体化治疗具有重要意义。
| [1] |
ZAKARIA N, SATAR NA, ABU HALIM NH, et al. Targeting lung cancer stem cells: research and clinical impacts[J]. Front Oncol, 2017, 7: 80. DOI:10.3389/fonc.2017.00080 |
| [2] |
JONES CM, BRUNELLI A, CALLISTER ME, et al. Multimodality treatment of advanced non-small cell lung cancer: where are we with the evidence?[J]. Curr Surg Rep, 2018, 6(2): 5. DOI:10.1007/s40137-018-0202-0 |
| [3] |
POLANSKI J, JANKOWSKA-POLANSKA B, ROSINCZUK J, et al. Quality of life of patients with lung cancer[J]. Onco Targets Ther, 2016, 9: 1023-1028. DOI:10.2147/ott.s100685 |
| [4] |
CHEN X, XU Y, LIAO X, et al. Plasma miRNAs in predicting radiosensitivity in non-small cell lung cancer[J]. Tumour Biol, 2016, 37(9): 11927-11936. DOI:10.1007/s13277-016-5052-8 |
| [5] |
FAROOQI AA, LI Y, SARKAR FH. The biological complexity of RKIP signaling in human cancers[J]. Exp Mol Med, 2015, 47: e185. DOI:10.1038/emm.2015.70 |
| [6] |
ZARAVINOS A, BONAVIDA B, CHATZAKI E, et al. RKIP: a key regulator in tumor metastasis initiation and resistance to apoptosis: therapeutic targeting and impact[J]. Cancers, 2018, 10(9): 287. DOI:10.3390/cancers10090287 |
| [7] |
XIE SY, LI G, HAN C, et al. RKIP reduction enhances radioresistance by activating the Shh signaling pathway in non-small-cell lung cancer[J]. Onco Targets Ther, 2017, 10: 5605-5619. DOI:10.2147/OTT.S149200 |
| [8] |
WANG A, DUAN G, ZHAO C, et al. Reduced RKIP expression levels are associated with frequent non-small cell lung cancer metastasis and STAT3 phosphorylation and activation[J]. Oncol Lett, 2017, 13(5): 3039-3045. DOI:10.3892/ol.2017.5846 |
| [9] |
PING FM, LIU GJ, LIU ZJ, et al. Expression of RKIP, E-cadherin and NF-κB p65 in esophageal squamous cell carcinoma and their correlations[J]. Int J Clin Exp Pathol, 2015, 8(9): 10164-10170. |
| [10] |
胡春杰, 周磊, 赵宏辉, 等. RKIP影响人宫颈癌hela细胞增殖、侵袭及其机制的研究[J]. 哈尔滨医科大学学报, 2018, 52: 238-241. DOI:10.3969/j.issn.1000-1905.2018.03.009 |
| [11] |
刘学飞, 张俊梅, 徐龙. RKIP在人乳腺癌组织及细胞中的表达及其通过NF-κB信号通路对乳腺癌细胞迁移和侵袭作用的研究[J]. 癌症进展, 2018, 16(13): 1668-1671. DOI:10.11877/j.issn.1672-1535.2018.16.13.28 |
| [12] |
AL-MULLA F, BITAR MS, TAQI Z, et al. RKIP: much more than Raf kinase inhibitory protein[J]. J Cell Physiol, 2013, 228(8): 1688-1702. DOI:10.1002/jcp.24335 |
| [13] |
BONAVIDA B. RKIP-mediated chemo-immunosensitization of resistant cancer cells via disruption of the NF-κB/Snail/YY1/RKIP resistance-driver loop[J]. Crit Rev Oncog, 2014, 19(6): 431-445. DOI:10.1615/critrevoncog.2014011929 |
| [14] |
YUAN L, YI HM, YI H, et al. Reduced RKIP enhances nasopharyngeal carcinoma radioresistance by increasing ERK and AKT activity[J]. Oncotarget, 2016, 7(10): 11463-11477. DOI:10.18632/oncotarget.7201 |
 2021, Vol. 50
2021, Vol. 50