文章信息
- 呼虹宇, 张天鼎, 赵君爽, 李龙, 景治涛
- HU Hongyu, ZHANG Tianding, ZHAO Junshuang, LI Long, JING Zhitao
- 神经内镜联合多模态神经导航系统切除无功能性垂体大腺瘤的临床应用
- Clinical application of neuroendoscopy in resection of large nonfunctional pituitary adenomas under a multimodal neuronavigation system
- 中国医科大学学报, 2021, 50(8): 728-731
- Journal of China Medical University, 2021, 50(8): 728-731
-
文章历史
- 收稿日期:2021-04-01
- 网络出版时间:2021-07-27 16:29
垂体腺瘤是鞍区内常见的良性肿瘤,多数起源于腺垂体细胞,占颅内肿瘤发病率的10%~20%,仅次于脑胶质瘤和脑膜瘤[1]。垂体瘤的治疗方式包括手术、药物和放射治疗,目前以经鼻蝶垂体瘤切除术为主要治疗方式。在垂体瘤中,直径≤1 cm的垂体瘤临床上称为垂体微腺瘤;直径 > 1 cm的垂体瘤为垂体大腺瘤;直径 > 4 cm的垂体瘤为垂体巨腺瘤[2]。垂体瘤还可根据是否具有内分泌功能分为分泌型(临床表现为垂体激素异常)和无功能型(垂体激素无异常分泌),无功能性垂体瘤约占垂体腺瘤发病率的14%~54%[3]。无功能性垂体瘤因其没有分泌激素的功能,生长缓慢,且在临床表现上有很大差异。早期无明显症状,后期逐渐出现视力、视野障碍,头痛,垂体前叶功能下降等症状[4]。
随着神经内镜和多模态神经导航技术的不断发展,将两者和术前鼻咽部、颅底部电子计算机X线断层扫描三维重建成像(three-dimensional computerized tomography,3D-CT)、颅脑磁共振(magnetic resonance imaging,MRI)、磁共振血管成像(magnetic resonance angiography,MRA)及弥散张量成像(diffusion tensor imaging,DTI)等有效结合,可以在术中实时提供图像,以展示颅内鞍区病变及病变周围的解剖结构,同时联合术中多普勒超声和电生理监测等技术手段为手术切除肿瘤提供更加可靠的安全保障。本研究拟探讨神经内镜联合多模态神经导航系统手术切除无功能性垂体大腺瘤的临床应用价值。
1 材料与方法 1.1 研究对象纳入标准:(1)术前影像学检查为垂体腺瘤,肿瘤直径1~4 cm;(2)患者有完整的术前和术后的血液化验、影像学及视力、视野检查等相关临床资料;(3)术后病理支持垂体腺瘤的诊断;(4)就诊时为首次接受手术治疗并且术式为神经内镜下经鼻蝶入路垂体瘤切除术。
排除标准:(1)携带心脏起博器或术后安置金属物(眼球异物、金属固定器、人工关节等);(2)体内有金属性药物泵;(3)合并心脏、肺、肝脏、肾脏等重要器官功能障碍;(4)哺乳期和妊娠期妇女;(5)存在凝血功能障碍。以上因素会影响MRI及存在手术相关禁忌证,故排除在外。
本研究选取在2017年6月至2020年6月于我院经神经内镜手术切除无功能性垂体大腺瘤的76例患者,其中,观察组38例,对照组38例。男35例(46.05%),女41例(53.95%),年龄21~72岁,中位年龄为49岁,病程9~24个月。收集患者的病史、术前及术后的血化验结果、视力及视野变化、影像学检查、肿瘤切除情况以及术后并发症和患者的生活质量等资料。
1.2 临床表现最早及最常出现的临床症状为头痛,早期疼痛多位于眼眶后侧,呈间歇性发作性疼痛。随后由于肿瘤体积变大,导致鞍区压力增高,出现视神经和相应血管受压,表现出其他相关临床症状,如视力下降,视野变窄等。术前主要症状包括头痛16例,视力减退及视野缺损6例,复视1例。术后新出现的主要症状包括内分泌功能紊乱(甲状腺功能、肾上腺功能及性腺功能减退)7例,尿崩症7例,颅内感染4例,嗅觉减退4例,脑脊液鼻漏3例,鼻部出血1例,视力下降1例。
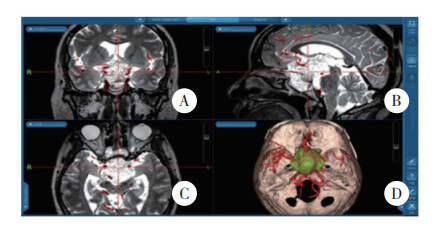
1.3 术中导航患者术前均行鼻咽部3D-CT、颅底3D-CT、颅脑MRI和MRA及DTI相关导航影像学检查,将检查的相关序列导入神经导航系统中(神经导航系统设备及厂家:Medtronic;导航软件名称:Cranial;导航型号:S7),通过图像融合后进行三维重建,将不同的结构给予相应的成像模式和颜色分配,准确地展示鞍区肿瘤与周围血管、颅骨和神经结构的毗邻解剖关系,见图 1。
|
| A-C, magnetic resonance imaging of the brain revealed tumor invasion of bilateral cavernous sinuses; D, three-dimensional reconstruction, bilateral internal carotid artery surrounding the tumor. 图 1 多模态神经导航系统图像三维重建 Fig.1 Three-dimensional reconstruction of multimodal neuronavigation system image |
1.4 统计学分析
采用SPSS 22.0进行统计分析,计量资料以x±s 表示,采用t检验。计数资料以率(%)表示,采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 2组术中出血量、手术时间和术后住院时间比较观察组术中出血量(术中失血量=吸引器吸出总量-术中生理盐水冲洗总量)少于对照组,差异有统计学意义(P < 0.05)。2组手术时间及术后住院时间无统计学差异(P > 0.05)。见表 1。
| Group | n | Intraoperative blood loss(mL) | Operation time(min) | Duration of postoperative hospital stay(d) |
| Control group | 38 | 63.37±11.21 | 86.43±9.76 | 8.23±2.63 |
| Observation group | 38 | 52.36±9.23 | 85.94±7.54 | 7.87±1.45 |
| t | 4.674 | 0.245 | 0.739 | |
| P | 0.001 | 0.807 | 0.462 |
2.2 2组术前及术后视觉功能比较
患者术前、术后视觉功能检查结果显示,视野计检查(mean deviation,MD)、模式标准差(pattern standard deviation,PSD)及视野指数(visual field index,VFI)的变化情况。术前及术后2组视觉功能比较无统计学差异(P > 0.05)。见表 2。
| Group | n | MD(dB) | PSD(dB) | VTF(%) | |||||
| Prior to treatment | Posttreatment | Prior to treatment | Posttreatment | Prior to treatment | Posttreatment | ||||
| Control group | 38 | 10.34±2.15 | 3.67±0.44 | 8.67±1.73 | 4.03±0.67 | 67.43±3.54 | 89.78±8.45 | ||
| Observation group | 38 | 10.42±3.34 | 3.73±0.56 | 8.73±1.56 | 3.97±0.54 | 66.57±2.87 | 90.96±6.77 | ||
| t | -0.124 | -0.519 | -0.159 | 0.430 | 1.163 | -0.672 | |||
| P | 0.902 | 0.605 | 0.874 | 0.669 | 0.248 | 0.504 | |||
2.3 2组术后并发症比较
2组患者均出现内分泌功能紊乱、尿崩症、颅内感染、嗅觉减退、脑脊液漏、鼻部出血和视力下降等术后并发症,观察组的术后总并发症发生率低于对照组,差异有统计学意义(P < 0.05)。见表 3。
| Group | n | Endocrine dysfunction | Diabetes insipidus | Intracranial infection | Hyposmia | Cerebrospinal fluid rhinorrhea | Epistaxis | Diminution of vision | Incidence rate(%) |
| Control group | 38 | 5(13.16) | 5(13.16) | 3(7.89) | 2(5.26) | 2(5.26) | 1(2.63) | 1(2.63) | 50.00 |
| Observation group | 38 | 2(5.26) | 2(5.26) | 1(2.63) | 2(5.26) | 1(2.63) | 0(0) | 0(0) | 21.05 |
| χ2 | 0.727 | 0.727 | 1.064 | 0.352 | 0.568 | 0.294 | 0.294 | 6.951 | |
| P | 0.006 | 0.006 | 0.017 | 0.003 | 0.005 | 0.002 | 0.002 | 0.008 |
2.4 2组垂体瘤全切率和复发率比较
观察组和对照组的垂体瘤全切率和复发率比较,无统计学差异(P > 0.05)。见表 4。
| Group | n | Total tumor resection rate(%) | Tumor recurrence rate(%) |
| Control group | 38 | 30(78.94) | 3(7.89) |
| Observation group | 38 | 32(84.21) | 2(5.26) |
| χ2 | 0.350 | - | |
| p | 0.554 | 1.000 |
3 讨论
目前,越来越多的临床医生使用神经内镜经鼻腔-蝶窦切除垂体瘤,因为内镜可使术者视野扩大且更加直观,减少手术创伤[5]。然而,神经内镜也有不足之处,通过内镜展现的二维图像缺乏立体感,且图像变形使手术操作变得困难;当血管大量出血时,容易污染镜头,使术野模糊[6]。多模态神经导航系统能实时向术者传递病变区域及周围相关解剖结构信息,同时融合3D图像,立体显示出颅骨、血管、神经及病变的相互关系[7]。但是在使用过程中发现,切开硬脑膜后,由于颅内压改变,脑组织、神经纤维和血管发生位置改变,称之为“漂移”[8]。这种误差使导航的精确度下降,影响病变解剖毗邻关系的判断。所以,在神经导航提供信息的基础上结合术中超声,可以识别肿瘤的供血血管与颈内动脉的关系,避免在手术过程中损伤颈内动脉造成大出血;还可以结合术中电生理检查,在切除侵袭性垂体瘤手术时,为神经损伤提供预警,改善患者的预后[9]。
脑脊液鼻漏是经鼻垂体瘤切除术中撕裂鞍膈或在术后由于脑脊液冲击薄弱的鞍膈使其破裂而造成的[10]。本研究中有3例患者术后出现脑脊液鼻漏,均留置腰大池引流管,抗感染治疗后1~2周,关闭腰大池引流管,其中对照组和观察组分别有1例患者鼻漏停止。另有1例观察组患者仍有脑脊液鼻漏,再次手术,采用患者自体脂肪和筋膜填补鞍底漏口,并覆盖生物膜和预留蝶窦前壁黏膜瓣,术后脑脊液鼻漏停止。
下丘脑功能障碍常表现为术后尿崩症和内分泌功能紊乱,本研究中有7例患者出现内分泌功能紊乱,7例出现术后尿崩症。应在手术时注意辨认垂体柄结构,避免在垂体柄上过多操作,术后并发尿崩症患者口服弥凝醋酸去氨加压素片1~2周,患者症状均逐渐缓解且检验相关生化指标正常。
本研究中所有术后患者进行嗅阈、气味区分及气味辨别检查,发现有4例患者术后出现嗅觉减退,可能由鼻黏膜及嗅觉通路的损伤所引起。术后鼻腔喷激素可抑制小息肉芽肿形成,促进黏膜再生,防止术腔粘连,促进黏膜术腔上皮化和再生;嗅觉训练可以刺激嗅神经元再生[11]。本研究嗅觉减退的4例患者术后采取鼻腔喷激素和嗅觉训练治疗,随访期间4例患者嗅觉均改善。另有对照组1例患者术后出现鼻部大量出血,视力下降,急查头部CT,见鞍区有高密度影,急诊在内镜下探查发现颈内动脉分支的其中一个小动脉出血,内镜下经鼻再次手术,出血区域止血后患者安返病房,出院时视力恢复至术前。
综上所述,神经内镜联合多模态神经导航系统再辅以术中多普勒超声和电生理监测为无功能性垂体大腺瘤手术顺利切除及良好预后提供了更安全的保障。结合术中MRI和术中CT,进一步提高手术的精准度和安全性,增加肿瘤的全切率,使得患者术后并发症的发生率及肿瘤复发率降低。
| [1] |
曾彦超, 易凤琼. 神经内镜下经鼻蝶窦垂体瘤切除术手术部位感染的影响因素[J]. 中国感染控制杂志, 2018, 17(7): 577-580. DOI:10.3969/j.issn.1671-9638.2018.07.005 |
| [2] |
冯斌, 黄立超, 蔡明, 等. 神经内镜下经单鼻孔蝶窦入路垂体瘤切除术的临床效果分析[J]. 河北医学, 2018, 24(10): 1739-1743. DOI:10.3969/j.issn.1006-6233.2018.10.038 |
| [3] |
PLEDGER CL, ELZOGHBY MA, OLDFIELD EH, et al. Prospective comparison of sinonasal outcomes after microscopic sublabial or endoscopic endonasal transsphenoidal surgery for nonfunctioning pituitary adenomas[J]. J Neurosurg, 2016, 125(2): 323-333. DOI:10.3171/2015.6.jns142695 |
| [4] |
毛建辉, 郭洪, 郭昊, 等. 显微镜与神经内镜下单鼻孔经鼻蝶手术治疗功能性垂体瘤的疗效及对激素的影响[J]. 河北医学, 2016, 22(6): 925-929. DOI:10.3969/j.issn.1006-6233.2016.06.016 |
| [5] |
王宁, 刘重霄. 神经内镜和显微镜下经鼻蝶垂体瘤切除术的疗效及安全性对比研究[J]. 解放军医药杂志, 2018, 30(5): 22-25. DOI:10.3969/j.issn.2095-140X.2018.05.006 |
| [6] |
KUO CH, YEN YS, WU JC, et al. Primary endoscopic transnasal transsphenoidal surgery for giant pituitary adenoma[J]. World Neurosurg, 2016, 91: 121-128. DOI:10.1016/j.wneu.2016.03.092 |
| [7] |
李洋, 许健, 王洋, 等. 神经导航及内镜辅助下经鼻蝶鞍区肿瘤显微切除的临床疗效分析[J]. 中国微侵袭神经外科杂志, 2017, 22(10): 448-450. DOI:10.11850/j.issn.1009-122X.2017.10.005 |
| [8] |
陈露露, 李健, 苏贺先. 神经内镜与神经导航辅助显微镜下经鼻蝶入路垂体腺瘤切除术的临床疗效对比分析[J]. 中国微侵袭神经外科杂志, 2016, 21(7): 307-309. DOI:10.11850/j.issn.1009-122X.2016.07.006 |
| [9] |
ZHAN R, LI X, LI X. Endoscopic endonasal transsphenoidal approach for apoplectic pituitary tumor: surgical outcomes and complications in 45 patients[J]. J Neurol Surg B Skull Base, 2016, 77(1): 54-60. DOI:10.1055/s-0035-1560046 |
| [10] |
吴毅, 刘成辉, 陈旭, 等. 经鼻孔蝶窦入路神经内镜下垂体瘤切除术临床分析[J]. 中国实用神经疾病杂志, 2018, 21(8): 846-849. DOI:10.12083/SYSJ.2018.08.212 |
| [11] |
BASTOS RV, SILVA CM, TAGLIARINI JV, et al. Endoscopic versus microscopic transsphenoidal surgery in the treatment of pituitary tumors: systematic review and meta-analysis of randomized and non-randomized controlled trials[J]. Arch Endocrinol Metab, 2016, 60(5): 411-419. DOI:10.1590/2359-3997000000204 |
 2021, Vol. 50
2021, Vol. 50