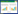文章信息
- 赵晶莹, 吴玉斌
- ZHAO Jingying, WU Yubin
- 槐耳对急性肾损伤后肾纤维化小鼠内质网应激和凋亡的影响
- Effect of Huaier on endoplasmic reticulum stress and apoptosis in mice with renal fibrosis after acute kidney injury
- 中国医科大学学报, 2021, 50(7): 632-636
- Journal of China Medical University, 2021, 50(7): 632-636
-
文章历史
- 收稿日期:2020-11-13
- 网络出版时间:2021-06-22 17:09
近年来,急性肾损伤(acute kidney injury,AKI)和慢性肾脏病(chronic kidney disease,CKD)的发病率呈上升趋势。研究[1]表明AKI是CKD的独立危险因素。AKI后肾脏不良修复会导致进行性肾纤维化和CKD。由AKI发展而来的CKD称为AKI-CKD转变[1-2]。研究[3-5]表明,AKI后随着时间延长,血清肌酐可以回归到基线水平,但肾内细胞炎症反应仍持续存在,导致肾纤维化和长期肾功能不全。在这过程中,缺氧、营养物质不足、ATP消耗、活性氧产生和Ca2+稳态破坏可引起内质网应激(endoplasmic reticulum stress,ERS)。
槐耳是一种生长在槐树树干上的浅褐色伞菌类真菌,作为中药已有1 500余年历史。研究[6]显示槐耳提取物治疗的不良反应很少。已有研究[7-8]表明槐耳对肾脏损伤有保护作用。然而槐耳在AKI-CKD转变中的作用及其与ERS的关系研究鲜有报道。本研究采用缺血再灌注损伤(ischemia reperfusion injury,IRI)建造AKI-CKD小鼠模型,探讨槐耳对AKI-CKD转变的影响及其作用机制。
1 材料与方法 1.1 实验动物、药品及分组72只雄性6~8周龄C57BL/6小鼠购自辽宁长生生物有限公司,动物饲养于SPF级实验室,温度为(25±2) ℃,湿度50%~70%,昼夜节律12 h光照/12 h黑暗,正常饮食。槐耳浸膏由启东盖天力药业有限公司提供。将小鼠随机分为3组:假手术(Sham)组、IRI组和槐耳治疗(IRI+Huaier)组,每组24只。
1.2 模型制备与给药IRI组进行缺血再灌注手术,小鼠戊巴比妥(40 mg/kg)腹腔注射麻醉后固定在手术台上,局部皮肤脱毛,无菌下行腹部正中切口,找到肾动脉,利用非创伤性微血管夹,夹闭双侧肾蒂30 min;Sham组只开腹;在肾缺血期间暂时关腹,去除微血管夹后确定肾动脉再灌注成功后分层缝合关闭腹腔。IRI+Huaier组操作同IRI组,手术后3 d开始槐耳浸膏[6 g/ (kg·d)]灌胃,持续至术后28 d。
1.3 方法 1.3.1 肾功能检测各组小鼠分别于造模后24 h、3 d、7 d、14 d、28 d尾静脉采血,常温静置2 h,4 ℃离心10 min,分离血清,留取标本后-20 ℃保存。采用脲酶UV法检测血肌酐水平。
1.3.2 ELISA检测血清中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinaseassociated lipocalin,NGAL)水平测定按照ELISA试剂盒(SEB388Mu,武汉Uscnk公司)说明书操作进行。
1.3.3 肾组织形态学观察于造模后28 d处死各组小鼠,剖腹取肾,用10%多聚甲醛固定,制作石蜡切片(片厚3 μm),HE染色,复染,脱水、透明后用中性树胶封片,光镜下观察肾组织形态学改变。肾组织中胶原形成情况检测:各组小鼠于造模后28 d处死,剖腹取肾,10%多聚甲醛固定,制作石蜡切片(片厚3 μm),Masson染色观察肾脏胶原形成、肾脏纤维化程度,计算各组肾小管损伤评分和间质纤维化百分比[9]。
1.3.4 Western blotting检测ERS相关分子GRP78、CHOP表达提取造模后28 d肾组织蛋白,加入上样缓冲液后依次上样,并加入Marker蛋白,电泳起始电压为80 V,当溴酚兰移动到分离胶时改为120 V电压,当溴酚兰跑出胶面时关闭电源终止电泳。电泳结束后,将分离的蛋白条带转膜至PVDF膜上,5%脱脂奶粉封闭,进行一抗(GRP78、CHOP抗体)孵育,随后进行二抗孵育,洗膜,配制ECL底物发光液,化学发光成像系统C300进行显色发光,采用Image J软件分析蛋白质条带的光密度值。
1.3.5 TUNEL实验组织切片脱蜡至水后滴加0.1% Triton X-100 (0.1%柠檬酸钠盐配置) 50 μL,室温放置8 min。PBS漂洗3次,5 min/次。配制TUNEL反应液:Enzyme solution及Label Solution按1:9配制,滴加TUNEL反应液(50 μL)。保湿、避光、37 ℃孵育60 min。PBS漂洗,滴加DAPI至完全覆盖组织,避光复染5 min。PBS漂洗,滴加荧光淬灭剂封片。显微镜下观察染色效果并拍照。
1.4 统计学分析数据处理采用SPSS 17.0统计软件,计量资料以x±s表示,组间比较采用方差分析,两两比较用LSD-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 小鼠AKI后肾纤维化模型构建结果显示,术后IRI组各时间点肌酐水平均较Sham组升高(P < 0.05)。小鼠在IRI术后24 h血肌酐明显升高,达到最高峰,术后第3天肌酐水平下降,第7天肌酐迅速下降,第28天肌酐显著下降,肾功能明显恢复。说明小鼠AKI后肾纤维化模型成功构建。IRI+Huaier组术后7 d和28 d肌酐水平均较IRI组下降,肾功能较IRI组恢复明显(P < 0.05)。见图 1。
|
| *P < 0.05, **P < 0.01 vs sham group; #P < 0.05 vs IRI group. 图 1 各组小鼠术后各时间血清肌酐水平比较 Fig.1 Comparison of serum creatinine levels after surgery among the three groups |
2.2 各组肾组织形态学观察结果
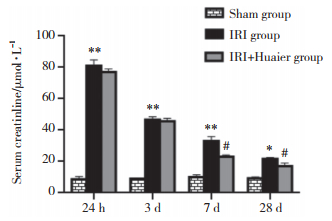
HE染色结果:光镜下可见Sham组小鼠肾小管基底膜完整,小管上皮细胞结构清晰,无炎症细胞浸润;IRI组肾小管弥漫性扩张,肾小管上皮细胞肿胀变性、坏死,部分萎缩、刷状缘消失,间质可见弥漫单核细胞浸润,间质纤维化;IRI+Huaier组小鼠肾间质纤维化程度明显减轻,肾小管上皮细胞无萎缩和代偿性肥大,未见间质水肿。Masson染色结果:与Sham组比较,IRI组胶原纤维增多,肾间质增宽,间质细胞及细胞外基质成分增多,表现为多灶状纤维化;IRI+Huaier组肾脏纤维化程度低于IRI组,但仍高于Sham组。术后28 d IRI组肾脏损伤及纤维化程度较Sham组升高(P < 0.01),而IRI+Huaier组较IRI组肾脏损伤及纤维化程度减轻(P < 0.01)。IRI组术后28 d NGAL水平较Sham组明显上调(P < 0.001);而IRI+ Huaier组NGAL水平较IRI组明显降低(P < 0.001),见图 2。
|
| A, morphological results ×400;B, renal tubular injury index and fibrotic area, and the serum level of NGAL. *P < 0.01, ** P < 0.001 vs sham group; #P < 0.01, ##P < 0.001 vs IRI group. 图 2 3组肾损伤和纤维化程度比较 Fig.2 Degree of renal injury and fibrosis in each group |
2.3 Western blotting检测各组小鼠肾组织GRP78、CHOP蛋白的表达
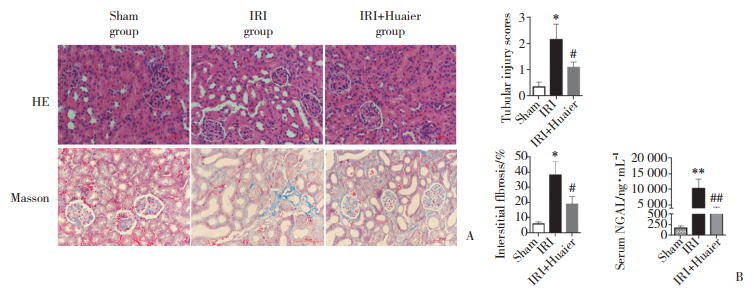
结果显示,IRI组GRP78、CHOP表达与Sham组比较明显增加(P < 0.01),IRI+Huaier组GRP78表达与IRI组比较显著下降(P < 0.05)。见图 3。
|
| **P < 0.01vs sham group; ##P < 0.01 vs IRI group. 图 3 Western blotting检测各组GRP78、CHOP蛋白的表达 Fig.3 GRP78 and CHOP protein expression in the kidneys by Western blotting |
2.4 TUNEL法检测各组细胞凋亡结果
Annexin V/PI双染色显示,sham组、IRI组、IRI+ Huaier组凋亡细胞百分比分别为(1.32±0.36) %、(12.34±1.99) %、(8.16±1.60) %,与Sham组比较,IRI组凋亡细胞明显增加(P < 0.001);与IRI组比较,IRI+ Huaier组凋亡细胞明显减少(P < 0.001),见图 4。
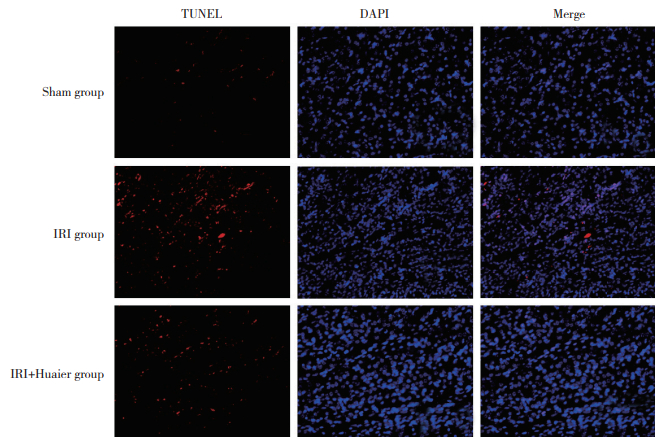
|
| 图 4 TUNEL法测定各组细胞凋亡情况比较×400 Fig.4 Apoptosis was determined among the three groups by TUNEL assay ×400 |
3 讨论
本研究以IRI后小鼠作为AKI动物模型来研究槐耳对AKI-CKD作用。造模采用常用的双侧肾脏缺血再灌注模型,结果显示,IRI后肾功能随着时间延长逐渐恢复,术后28 d时血肌酐接近正常值,但HE、Masson染色结果和血清NGAL水平升高说明肾脏损伤及间质纤维化仍十分明显。IRI+Huaier组血肌酐水平较IRI组下降,说明槐耳可保护AKI后肾功能;28 d时HE、Masson染色结果显示肾脏损伤及纤维化程度较IRI组减轻,说明槐耳可以减轻AKI后肾损伤及纤维化程度。
最近,研究[10]指出肾脏近曲小管的ERS在IRI损伤导致的AKI后肾纤维化过程中持续存在,参与肾脏纤维化的发生发展,持续的ERS可引发凋亡[11],GRP78表达于细胞质,是ERS的标志性蛋白之一,当内质网功能紊乱时,非折叠蛋白在内质网腔内堆积,致使GRP78与PERK、ATF6、IRE1分离,GRP78表达增高是ERS发生和存在的标志[12],CHOP主要表达于细胞核,是转录因子家族C/EBP的成员之一,在正常生理情况下表达极低,而当发生过度的ERS时其表达显著被诱导,调控下游细胞凋亡相关基因表达[13]。XU等[14]在UUO模型中发现ERS活化并能促进肾脏纤维化。
研究[15]显示,槐耳通过刺激细胞因子释放和产生活性氧、一氧化氮来调节先天免疫,潜在的不良反应是恶心和呕吐。槐耳浸膏对顺铂诱导的小鼠AKI具有保护作用,可能机制是通过抑制肾小管上皮细胞炎症、凋亡发生而实现[7]。槐杞黄(槐耳为主要成分)可通过抑制ESR,抑制足细胞GRP78和CHOP表达,保护高糖诱导的小鼠足细胞损伤,降低细胞凋亡[8]。目前尚无槐耳在AKI-CKD转变过程中的作用及机制研究。参照既往药物干预AKI-CKD转变的相关研究[16],本研究发现IRI组内质网相关分子GRP78和CHOP表达较Sham组明显升高,提示AKI-CKD进展过程中,ERS参与肾脏纤维化损伤的过程,与SHU等[17]研究结果一致。此外,本研究结果显示槐耳治疗显著减少了细胞凋亡,保护了IRI诱导的肾小管细胞,推测这种保护作用是通过抑制ERS和凋亡介导的。FANG等[18]发现槐耳通过减少顺铂诱导的肾脏损伤和凋亡来改善肾功能,与本研究结果一致。
综上所述,槐耳能够改善AKI后肾纤维化小鼠肾功能,延缓肾损伤及肾间质纤维化进程,其机制可能是通过抑制ERS和凋亡实现的。槐耳不良反应小,对肾脏有着强大的保护作用,它在AKI-CKD转变过程中的其他作用机制还需进一步研究探索,以便为肾纤维化的治疗提供新的思路。
| [1] |
WANG Y, CAI J, TANG CY, et al. Mitophagy in acute kidney injury and kidney repair[J]. Cells, 2020, 9(2): 338. DOI:10.3390/cells9020338 |
| [2] |
KURZHAGEN JT, DELLEPIANE S, CANTALUPPI V, et al. AKI:an increasingly recognized risk factor for CKD development and progression[J]. J Nephrol, 2020, 33(6): 1171-1187. DOI:10.1007/s40620-020-00793-2 |
| [3] |
ZHANG J, BI J, REN Y, et al. Involvement of GPX4 in irisin's protection against ischemia reperfusion-induced acute kidney injury[J]. J Cell Physiol, 2021, 236(2): 931-945. DOI:10.1002/jcp.29903 |
| [4] |
HE W, QIN D, LI B, et al. Immortalized canine adipose-derived mesenchymal stem cells alleviate gentamicin-induced acute kidney injury by inhibiting endoplasmic Reticulum stress in mice and dogs[J]. Res Vet Sci, 2021, 136: 39-50. DOI:10.1016/j.rvsc.2021.02.001 |
| [5] |
JOHNSON BG, DANG LT, MARSH G, et al. Uromodulin p.Cys147Trp mutation drives kidney disease by activating ER stress and apoptosis[J]. J Clin Invest, 2017, 127(11): 3954-3969. DOI:10.1172/JCI93817 |
| [6] |
LI Y, QI W, SONG X, et al. Huaier extract suppresses breast cancer via regulating tumor-associated macrophages[J]. Sci Rep, 2016, 6: 20049. DOI:10.1038/srep20049 |
| [7] |
GUO Y, WANG M, MOU J, et al. Pretreatment of Huaiqihuang extractum protects against cisplatin-induced nephrotoxicity[J]. Sci Rep, 2018, 8(1): 7333. DOI:10.1038/s41598-018-25610-6 |
| [8] |
LI TX, MAO JH, HUANG L, et al. Beneficial effects of Huaiqihuang on hyperglycemia-induced MPC5 podocyte dysfunction through the suppression of mitochondrial dysfunction and endoplasmic reticulum stress[J]. Mol Med Rep, 2017, 16(2): 1465-1471. DOI:10.3892/mmr.2017.6753 |
| [9] |
ZHANG B, ZHAO CG, HOU L, et al. Silencing of the lncRNA TUG1 attenuates the epithelial-mesenchymal transition of renal tubular epithelial cells by sponging miR-141-3p via regulating β-catenin[J]. Am J Physiol Renal Physiol, 2020, 319(6): F1125-F1134. DOI:10.1152/ajprenal.00321.2020 |
| [10] |
SHU S, ZHU J, LIU Z, et al. Endoplasmic reticulum stress is activated in post-ischemic kidneys to promote chronic kidney disease[J]. EBioMedicine, 2018, 37: 269-280. |
| [11] |
HU H, TIAN MX, DING C, et al. The C/EBP homologous protein (CHOP) transcription factor functions in endoplasmic reticulum stress-induced apoptosis and microbial infection[J]. Front Immunol, 2018, 9. DOI:10.3389/fimmu.2018.03083 |
| [12] |
SHIMIZU A, KAIRA K, YASUDA M, et al. Clinical and pathological significance of ER stress marker (BiP/GRP78 and PERK) expression in malignant melanoma[J]. Pathol Oncol Res, 2017, 23(1): 111-116. DOI:10.1007/s12253-016-0099-9 |
| [13] |
DAISUKE A, HIDEROU Y, YUKIHIRO H. Endoplasmic reticulum (ER) stress and endocrine disorders[J]. Int J Mol Sci, 2017, 18(2): 382. DOI:10.3390/ijms18020382 |
| [14] |
XU Y, LIU Y, GUO H, et al. Apoptosis-associated speck-like protein containing a CARD deletion ameliorates unilateral ureteral obstruction induced renal fibrosis and endoplasmic Reticulum stress in mice[J]. Mediators Inflamm, 2018, 2018: 6909035. DOI:10.1155/2018/6909035 |
| [15] |
CHEN Q, SHU C, LAURENCE AD, et al. Effect of Huaier granule on recurrence after curative resection of HCC:a multicentre, randomised clinical trial[J]. Gut, 2018, 67(11): 2006-2016. DOI:10.1136/gutjnl-2018-315983 |
| [16] |
ZHANG W, SHA Y, WEI K, et al. Rotenone ameliorates chronic renal injury caused by acute ischemia/reperfusion[J]. Oncotarget, 2018, 9(36): 24199-24208. DOI:10.18632/oncotarget.24733 |
| [17] |
SHU S, ZHU J, LIU Z, et al. Endoplasmic reticulum stress is activated in post-ischemic kidneys to promote chronic kidney disease[J]. EBioMedicine, 2018, 37: 269-280. DOI:10.1016/j.ebiom.2018.10.006 |
| [18] |
FANG L, ZHANG Y, WANG Q, et al. A polysaccharide from Huaier ameliorates cisplatin nephrotoxicity by decreasing oxidative stress and apoptosis via PI3K/AKT signaling[J]. Int J Biol Macromol, 2019, 139: 932-943. DOI:10.1016/j.ijbiomac.2019.07.219 |
 2021, Vol. 50
2021, Vol. 50