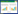文章信息
- 崔畅婉, 孙峥嵘
- CUI Changwan, SUN Zhengrong
- 骆驼奶对噁唑酮诱导的小鼠肠炎的作用
- Effects of camel milk on oxazolone-induced colitis in mice
- 中国医科大学学报, 2021, 50(7): 593-596
- Journal of China Medical University, 2021, 50(7): 593-596
-
文章历史
- 收稿日期:2020-08-31
- 网络出版时间:2021-06-22 16:17
炎症性肠病包括克罗恩病和溃疡性结肠炎,作为多种因素诱导的肠道疾病在世界范围流行,其流行病学、病因学、遗传学和表型被广泛研究[1]。炎症性肠病手术有关的并发症如狭窄、瘘管和脓肿较为常见,因此探索预防和辅助治疗机制势在必行。有研究[2]证实,骆驼奶在某些疾病中可能具有治疗作用,包括糖尿病、自闭症、癌症和酒精引起的中毒等,但骆驼奶的临床疗效和治疗价值目前尚不十分清楚。先前的研究[3]表明,骆驼奶可能参与调节免疫细胞增殖、分化和细胞因子分泌,对维持机体内环境稳定具有重要作用。本研究采用噁唑酮(oxazolone,OXA)诱导的小鼠肠炎模型模拟人炎症性肠病发病过程,通过灌胃方式给予骆驼奶,检测肠黏膜免疫细胞和免疫因子的改变,探讨骆驼奶对小鼠肠炎的作用机制。
1 材料与方法 1.1 实验动物和试剂SPF级BALB/c小鼠40只,由北京维通利华生物科技有限公司提供,18~20 g,5~6周龄,雄性,实验动物使用经中国医科大学实验动物管理委员会批准。骆驼奶(新疆旺源有限公司),DMEM培养基、乙二胺四乙酸、胶原酶、DNA酶(美国Gibco公司),胎牛血清、离子霉素、佛波酯、蛋白转运抑制剂布雷非德菌素A、OXA (美国Sigma公司),流式抗体CD4-异硫氰酸荧光素、CD3-紫草素叶绿素、γ干扰素(interferon γ,IFN-γ) -别藻蓝蛋白、白细胞介素(interleukin,IL) - 17-藻红蛋白、CD25-别藻蓝蛋白、ELISA试剂盒(美国R & D Systems公司)。
1.2 实验方法 1.2.1 动物模型的建立5~6周BALB/c小鼠40只,在特定的无病原体条件(温度25 ℃,湿度60%~65%,12 h光照)下饲养和繁殖。在适应性喂养1周后的第1~2天戊巴比妥钠(8 µL/g)注射给药,待小鼠麻醉后,剃毛并暴露皮肤,涂擦3% OXA溶液(溶于100%乙醇,200 µL/只),并于第6天将l% OXA溶液(溶于50%乙醇,150 µL/只)经肛门给药,通过直径2.5 mm的硅胶细软管插入距肛缘4 cm左右,注意避免用力过大造成肠壁损伤。经肛门给药后,将小鼠保持倒立1 min,使药物充分接触肠壁,确保造模成功。将小鼠随机分为实验组和对照组,每组20只。l% OXA给药当天起,实验组小鼠每天骆驼奶灌胃(2 g/kg,溶于200 µL双蒸水),对照组连续200 µL双蒸水灌胃,7 d后断颈法处死小鼠,进行后续实验。
1.2.2 疾病活动指数(disease activity index,DAI)评分每天记录小鼠体质量、大便形态和隐血改变情况,用DAI评估结肠炎严重程度。体质量改变:体质量减轻 < 1%,0分;体质量减轻1%~ < 5%,1分;体质量减轻5%~ < 10%,2分;体质量减轻10%~ < 15%,3分;体质量减轻≥15%,4分。大便形态:正常,0分;稍稀,2分;稀便,3分;水样便,4分。隐血试验:阴性,0分;弱阳性,1分;阳性,2分;强阳性,3分;肉眼血便,4分。计算DAI= (体质量改变得分+大便形态得分+隐血试验得分) /3。
1.2.3 肠黏膜固有层细胞提取断颈法处死小鼠后,剥离干净结肠至肛门段肠管,在含有乙二胺四乙酸的DMEM培养基中剪碎并移至离心管。固有层细胞提取参见文献[4]。在含有100 U/mL胶原酶和5 U/mL DNA酶Ⅰ的DMEM培养基中37 ℃孵育90 min,之后4 ℃、3 000 r/min离心10 min。弃上清,保留细胞沉淀,以梯度离心分离液分离细胞并回收中间段液体,3 000 r/min离心10 min,保留细胞沉淀,弃上清。
1.2.4 流式细胞分析提取小鼠肠黏膜固有层淋巴细胞,并于细胞混悬液中加入胞外染色抗体进行流式细胞术表面染色。向细胞培养上清中加入佛波酯25 ng/mL,离子霉素1 μg/mL,布雷非德菌素A 10 μg/mL,37 ℃、5% CO2细胞培养箱孵育5 h。之后将细胞破膜固定,再加入胞内染色抗体,4 ℃孵育30 min,之后高速离心机4 ℃、4 800 r/min离心1 min,弃掉上清后重悬沉淀。FACS Canto Ⅱ流式细胞仪检测,应用FlowJo7.6软件进行数据分析。
1.2.5 ELISA台盼蓝染色计数细胞,稀释后将细胞接种于96孔板,每孔2×105/mL,200 μL,37 ℃、5% CO2细胞培养箱孵育48 h,回收上清,加入一抗室温避光过夜。第2天弃掉孔中液体,洗涤3次,并以封闭液封闭。加入标准品和样品(50 μL/孔),静置2 h。加二抗,室温静置2 h。弃去孔中液体,加辣根过氧化物酶(50 μL/孔),静置20 min后加入底物,20 min后以终止液终止反应,立即上机检测450 nm处吸光度。
1.3 统计学分析采用SPSS 20.0软件进行统计学分析,结果以x±s表示,组间比较采用单因素方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 小鼠体质量变化和DAI评分1% OXA灌肠给药当天作为第1天,记录小鼠体质量和排便情况。给药第1天小鼠体质量记为1,每日记录体质量比值(当日小鼠体质量/第1天小鼠体质量)。与对照组小鼠相比,实验组小鼠体质量下降程度减弱、DAI评分低,差异有统计学意义(P < 0.05)。提示骆驼奶灌胃后,OXA诱导的小鼠结肠炎发展缓解,骆驼奶可能对肠道有保护作用。见图 1。
|
| A, change in body weight; B, DAI score. * P < 0.05. 图 1 实验组和对照组小鼠体质量和DAI评分 Fig.1 Body weight and disease activity index (DAI) score of mice in experimental and control groups |
2.2 小鼠肠道黏膜淋巴细胞比例
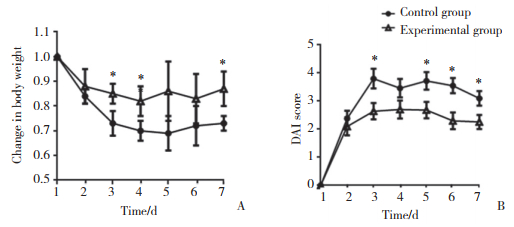
流式细胞术结果显示,与对照组相比,实验组小鼠肠黏膜淋巴细胞中CD4+ CD25+ T细胞(分别为5.78%±0.34%和10.91%±0.86%)和CD4+ IFN-γ+ T细胞比例(分别为9.48%±0.92%和15.95%±1.13%)升高,CD4+ IL-17+ T细胞比例(分别为8.23%±1.16%和4.07%±1.02%)下降,差异有统计学意义(P < 0.05)。提示骆驼奶可能具有调节小鼠肠道黏膜免疫细胞增殖分化的作用,促进IFN-γ+辅助性T细胞(helper T cell,Th细胞)和调节性T细胞(regulatory T cell,Treg细胞)增殖,抑制Th17细胞增殖。骆驼奶可能通过抵抗OXA诱导的免疫细胞比例失衡,从而缓解肠道炎症。见图 2。
|
| A, proportion of CD4+ CD25+ T cells; B, proportion of CD4+ IFN-γ+ T cells and CD4+ IL-17+ T cells. 图 2 小鼠肠道淋巴细胞比例 Fig.2 Proportions of lymphocytes in mice colon |
2.3 小鼠肠道黏膜细胞因子分泌
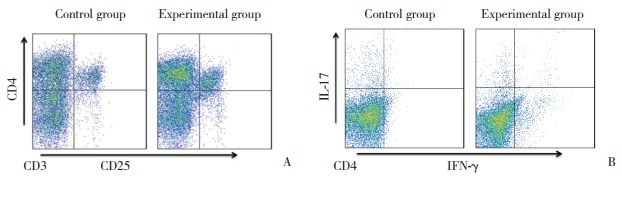
ELISA结果表明,与对照组相比,实验组小鼠肠黏膜淋巴细胞培养上清中IL-17、IL-4、IL-13浓度降低,IFN-γ浓度升高,差异有统计学意义(P < 0.05)。提示骆驼奶可能通过调节免疫细胞分泌细胞因子的浓度,缓解OXA诱导的小鼠肠炎。见图 3。
|
| A, IL-17;B, IL-4;C, IL-13;D, IFN-γ. * P < 0.05 vs control group. 图 3 小鼠肠道黏膜固有层细胞培养上清中细胞因子浓度 Fig.3 Concentration of cytokines in the culture supernatant of lamina propria cells from mice colon |
3 讨论
炎症性肠病是由易感基因、环境、宿主肠道微生物群数量和种类、病毒和真菌以及免疫稳态失衡等多种因素引起的一系列复杂的病理改变。肠黏膜免疫系统与炎症性肠病的发病机制有关,包括肠上皮细胞、固有层淋巴细胞、巨噬细胞/单核细胞、中性粒细胞、树突状细胞和Treg细胞/B淋巴细胞及其分泌的细胞因子和趋化因子[5]。根据HELLER等[6]的方法,OXA诱导的BALB/c小鼠急性肠炎模型,在疾病进展、病理改变以及免疫状态改变等方面,均可作为溃疡性结肠炎的实验模型,探讨其发病机制和药物应用。
骆驼科与牛科有很大的进化差异,因此骆驼奶与牛奶的蛋白质组成不同,骆驼奶是对牛奶过敏的人群较好的一种替代选择。研究[7]证明,骆驼奶中富含的胰岛素和不饱和脂肪酸能够调节糖尿病患者的血糖水平,增加患者血清中的超氧化物酶歧化酶、谷胱甘肽过氧物酶活性,降低糖尿病发生率。放化疗或长期应用抗生素会对人体免疫系统造成破坏,对骨髓祖细胞造成损伤,引起免疫细胞减少,引起患者免疫抑制,增加病原微生物感染概率。有研究[8]表明,饮用骆驼奶可以调节免疫功能,促进免疫稳态恢复。溃疡性结肠炎作为一种不典型CD4+ Th2型淋巴细胞因子反应性疾病,其特征性免疫因子改变,包括IL-13等表达增多[9]。Th17细胞分泌IL-17A、IL-17F、IL-21等多种细胞因子,在炎症性肠病发病机制中起关键作用。
本研究以OXA诱导的BALB/c小鼠急性肠炎模型作为实验模型,模拟患者溃疡性结肠炎发病过程,探究骆驼奶对小鼠肠道黏膜免疫的调节机制,进一步探究骆驼奶的辅助治疗作用。本研究中,CD4+ IFN-γ+ T细胞比例增加,说明骆驼奶对小鼠肠炎的保护作用可能与调节T细胞向Th1型细胞分化有关。促炎的Th2型细胞因子包括IL-4和IL-13水平降低,也提示了小鼠肠道免疫稳态恢复。Treg细胞激活后高水平表达CD25[10]。本研究中,实验组小鼠CD4+ CD25+ T细胞比例较对照组增加,而Treg细胞的增加有助于肠炎恢复。结果提示,饮用骆驼奶可能缓解肠炎进展。
总之,本研究表明,骆驼奶可能通过调节Th1-Th2/Treg细胞增殖及其细胞因子分泌,纠正失衡的细胞因子网络,从而改善OXA诱导的小鼠溃疡性结肠炎模型的疾病进展。这些结果表明,骆驼奶可能为缓解炎症性肠病疾病进程提供一种新的辅助治疗方法。
| [1] |
BATTISTINI C, BALLAN R, HERKENHOFF ME, et al. Vitamin D modulates intestinal microbiota in inflammatory bowel diseases[J]. Int J Mol Sci, 2020, 22(1): 362. DOI:10.3390/ijms22010362 |
| [2] |
HAILU Y, HANSEN EB, SEIFU E, et al. Functional and technological properties of camel milk proteins:a review[J]. J Dairy Res, 2016, 83(4): 422-429. DOI:10.1017/S0022029916000686 |
| [3] |
BADAWY AA, EL-MAGD MA, ALSADRAH SA. Therapeutic effect of camel milk and its exosomes on MCF7 cells in vitro and in vivo[J]. Integr Cancer Ther, 2018, 17(4): 1235-1246. DOI:10.1177/1534735418786000 |
| [4] |
ZHU J, WANG Y, YANG F, et al. IL-33 alleviates DSS-induced chronic colitis in C57BL/6 mice colon Lamina propria by suppressing Th17 cell response as well as Th1 cell response[J]. Int Immunopharmacol, 2015, 29(2): 846-853. DOI:10.1016/j.intimp.2015.08.032 |
| [5] |
KAMAREDDINE L, NAJJAR H, SOHAIL MU, et al. The microbiota and gut-related disorders:insights from animal models[J]. Cells, 2020, 9(11): 2401. DOI:10.3390/cells9112401 |
| [6] |
HELLER F, FUSS IJ, NIEUWENHUIS EE, et al. Oxazolone colitis, a Th2 colitis model resembling ulcerative colitis, is mediated by IL-13-producing NK-T cells[J]. Immunity, 2002, 17(5): 629-638. DOI:10.1016/s1074-7613(02)00453-3 |
| [7] |
AYOUB MA, PALAKKOTT AR, ASHRAF A, et al. The molecular basis of the anti-diabetic properties of camel milk[J]. Diabetes Res Clin Pract, 2018, 146: 305-312. DOI:10.1016/j.diabres.2018.11.006 |
| [8] |
IBRAHIM HM, MOHAMMED-GEBA K, TAWFIC AA, et al. Camel milk exosomes modulate cyclophosphamide-induced oxidative stress and immuno-toxicity in rats[J]. Food Funct, 2019, 10(11): 7523-7532. DOI:10.1039/c9fo01914f |
| [9] |
FLAMAR AL, KLOSE CSN, MOELLER JB, et al. Interleukin-33 induces the enzyme tryptophan hydroxylase 1 to promote inflammatory group 2 innate lymphoid cell-mediated immunity[J]. Immunity, 2020, 52(4): 606-619.e6. DOI:10.1016/j.immuni.2020.02.009 |
| [10] |
SZNURKOWSKA K, LUTY J, BRYL E, et al. Enhancement of circulating and intestinal T regulatory cells and their expression of helios and neuropilin-1 in children with inflammatory bowel disease[J]. J Inflamm Res, 2020, 13: 995-1005. DOI:10.2147/jir.s268484 |
 2021, Vol. 50
2021, Vol. 50