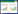文章信息
- 赵恒伍, 王文娟, 陈胜武
- ZHAO Hengwu, WANG Wenjuan, CHEN Shengwu
- 铁超载通过ASK1-p38通路介导的铁死亡途径抑制成骨细胞功能
- Iron overload downregulates osteoblast function via ASK1-p38 pathway-mediated ferroptosis
- 中国医科大学学报, 2021, 50(6): 530-534
- Journal of China Medical University, 2021, 50(6): 530-534
-
文章历史
- 收稿日期:2020-11-07
- 网络出版时间:2021-05-26 16:15
2. 锦州医科大学附属第一医院康复科, 辽宁 锦州 121001
2. Department of Rehabilitation, The First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121001, China
目前,全球人口老龄化日益加重,骨质疏松的发病率也随之升高。骨质疏松极易导致一系列不良后果和并发症,甚至出现致残、致死等严重后果[1-2]。铁作为机体必需的元素,在人体内发挥非常重要的生物学功能,包括参与DNA修复、维持细胞生长、细胞分裂、呼吸作用等生命代谢活动,但是铁过多也会对人体的细胞和组织产生危害。有临床研究[3]报道,骨质疏松症见于多种与铁超载相关疾病的患者中。实验研究[4-5]发现,铁超载可导致成骨细胞功能减弱,干扰干细胞向成骨细胞分化,导致体内骨代谢进一步失衡,从而导致骨质疏松。但是,这一病理过程以及铁的具体作用和相关机制仍有待于进一步研究。
凋亡信号调节激酶1(apoptosis signal-regulating kinase 1,ASK1)-p38信号通路是一个与铁离子密切相关的信号转导途径,铁离子的浓度直接影响该信号通路的表达。铁死亡是近几年发现的一种新的程序性死亡途径,是一种全新的细胞死亡模式,在其发生过程中,细胞内脂质氧化物大量累积,攻击生物大分子,使细胞出现铁死亡现象。目前已有研究报道,它与多种疾病有关,如癌症、肾脏疾病、脑损伤性疾病等。这种铁依赖性细胞死亡形式在生物化学和形态学方面均不同于其他细胞死亡方式[6],这种现象具有明显的铁离子依赖性,但其在成骨细胞中的作用和相关机制未见报道。本研究旨在探讨铁超载条件下成骨细胞功能的变化,并探讨ASK1-p38通路介导的铁死亡机制在这个过程中的作用。
1 材料与方法 1.1 材料人成骨细胞系hFOB1.19购于中国科学院细胞库,使用DMEM-F12培养基(美国Sigma-Aldrich公司)加入10%胎牛血清进行培养,培养基中加入1%青链霉素(美国Sigma-Aldrich公司)。细胞在33.5 ℃、5% CO2培养箱中进行培养,每2~3 d换1次液。枸橼酸铁铵(ferric ammonium citrate,FAC)购于美国Sigma-Aldrich公司;人成骨样细胞矿化诱导试剂盒购于中国Cyagen公司;成骨细胞茜素红矿化染色试剂盒购于中国碧云天公司。抗骨保护素(osteoprotegerin,OPG)、抗ASK1、抗p38抗体及其对应磷酸化抗体均购于美国Sigma-Aldrich公司。
1.2 方法 1.2.1 构建培养体系及不同浓度FAC的干预人hFOB1.19细胞培养于含10%胎牛血清的DMEM-F12培养基中,置于34℃、5%CO2的细胞培养箱中培养,0.25%胰酶常规消化传代[7]。为了探究高铁环境对成骨细胞的影响,分别设置空白对照组(0 μmol/L FAC)、100 μmol/L FAC组、200 μmol/L FAC组。FAC处理24 h后检测相关指标。
1.2.2 茜素红染色测定hFOB1.19细胞经矿化诱导培养。各组细胞经处理后,应用Cyagen矿化诱导试剂盒进行诱导矿化操作,矿化诱导液内含矿化专用培养基及血清、谷氨酰胺、抗坏血酸、β-甘油磷酸钠、地塞米松。具体配置方法和各组分浓度按说明书操作,每3 d换液1次,共诱导2~4周。细胞使用4%多聚甲醛固定30 min,根据矿化染色试剂盒(中国碧云天公司)说明书进行染色,然后在倒置光学显微镜下观察染色情况,并且计数10个视野的钙结节数量。
1.2.3 Western blotting检测将收集的细胞在4 ℃下加入含有蛋白酶和磷酸酶抑制的裂解缓冲液裂解30 min,然后4 ℃、12 000 g离心30 min,保留上清液,采用BCA法测定蛋白质浓度。总蛋白提取后,通过12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离总蛋白(50 μg蛋白质),60 V下将分离的蛋白转移到聚偏二氟乙烯膜上,用含有5%脱脂乳的封闭缓冲液封闭聚偏二氟乙烯膜2 h。4 ℃下以1:100~1:1 000稀释的一抗孵育过夜,随后将膜与二抗(抗小鼠、抗兔或抗羊)一起温育。IgG以1:6 000或1:10 000稀释并与辣根过氧化物酶耦联,室温下孵育2 h。用EC3成像系统(美国UVP公司)显现条带,应用ImageJ软件测量条带的光密度与内参蛋白β-actin的比值。
1.2.4 透射电镜检测各组细胞培养后,使用细胞刮刀小心刮下细胞,800 r/min离心,弃去上清,用2.5%戊二醛固定细胞团块,乙醇梯度脱水后进行渗透,包埋,切片。将切片用醋酸双氧铀和柠檬酸铅染色后置于透射电镜下观察。
1.3 统计学分析每个实验至少重复3次,数据用x±s表示。采用SPSS 22.0软件分析数据。2组间的比较采用t检验,多组间的比较采用方差分析。P < 0.05为差异有统计学意义。
2 结果 2.1 FAC降低成骨细胞的成骨功能为了探究FAC对成骨细胞成骨功能的影响,应用Western blotting检测成骨细胞中OPG的表达,并应用钙结节染色测定成骨细胞的矿化能力。结果显示,FAC抑制成骨细胞OPG的表达,FAC浓度越高,OPG表达越少。FAC抑制成骨细胞的矿化,FAC浓度越高,钙结节数量越少。结果表明,FAC抑制了成骨细胞的成骨功能。见图 1。

|
| A, FAC inhibits the expression of OPG in osteoblasts; B, FAC inhibits mineralization in osteoblasts. ** P < 0.01 vs the blank control group. 图 1 FAC抑制成骨细胞分化和成骨细胞成骨功能 Fig.1 FAC inhibits the differentiation and osteogenic function of osteoblasts |
2.2 FAC导致成骨细胞的铁死亡现象增强
为了探讨FAC对成骨细胞铁死亡现象的影响,检测FAC干预下成骨细胞的超微结构变化。结果显示,与空白对照组相比,200 μmol/L FAC干预后成骨细胞内线粒体形态发生明显改变,线粒体双层膜密度增加,线粒体内嵴减少或消失,密度降低,符合铁死亡形态学变化特征。结果表明,FAC可以增强成骨细胞的铁死亡现象。见图 2。
|
| A, blank control group; B, 200 μmol/L FAC group. 图 2 FAC干预增强成骨细胞内的铁死亡现象×2 500 Fig.2 FAC enhances ferroptosis in osteoblasts ×2 500 |
2.3 FAC通过激活ASK1/p38通路调控铁死亡发生
为了探究FAC影响成骨细胞铁死亡现象的具体分子机制,检测ASK1和p38通路蛋白的表达。结果显示,在100 μmol/L和200 μmol/L FAC干预下,ASK1和p38的表达均升高,且与成骨细胞铁死亡现象一致。结果表明,FAC可以通过调控ASK1-p38信号通路调控成骨细胞铁死亡。见图 3。
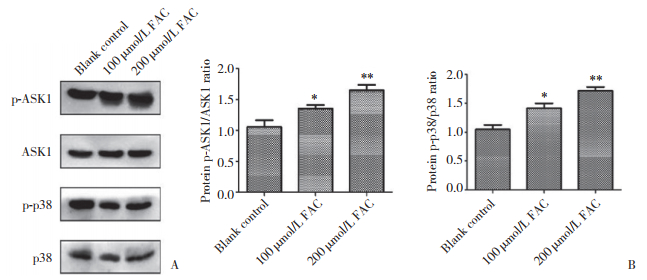
|
| A, expression of p-ASK1/ASK1 and p-p38/p38 proteins in untreated and FAC-treated osteoblasts; B, FAC promotes the expression of p-ASK1/ASK1 and p-p38/p38 proteins in osteoblasts. * P < 0.05 vs the blank control group; ** P < 0.01 vs the blank control group. 图 3 FAC调控ASK1和p38的表达 Fig.3 FAC regulates the expression of ASK1 and p38 |
3 讨论
骨质疏松严重影响人类的健康,本课题组的前期研究[7]发现,铁超载可以刺激成骨细胞的自噬与凋亡,其具体机制可能与二价金属离子转运体1有关。铁作为体内最常见的微量元素之一,对维持机体生命活动具有不可代替的作用。研究证实,机体内铁离子处于动态平衡中,不断被吸收、利用、储存、循环,被称为铁稳态。铁稳态的存在,对细胞的正常生理功能具有重要意义。研究发现,细胞内铁稳态主要由多种铁相关蛋白调控,包括细胞内铁蛋白、二价金属离子转运体、转铁蛋白受体和转铁蛋白等。既往有研究[8]报道,铁超载可导致小鼠骨质流失,并认为其机制与氧化应激密切相关。还有研究[9]发现,2型糖尿病性骨质疏松的骨组织中成骨细胞出现铁超载,引起细胞产生氧化应激反应,最终影响成骨细胞的成骨功能,说明2型糖尿病骨质疏松骨组织中存在铁稳态的失调。以上研究均表明,骨质疏松与铁离子的稳态密切相关。
2012年研究报道了一种新的程序性死亡途径,称之为铁死亡。与细胞凋亡不同,铁死亡是依赖铁离子和活性氧(reactive oxygen species,ROS)产生的程序性死亡途径,是一个全新的细胞死亡模式,这种铁依赖性细胞死亡形式在生物化学和形态学方面不同于凋亡、自噬、坏死、焦亡和其他细胞死亡方式。在其发生过程中,细胞内的谷胱甘肽耗竭,导致谷胱甘肽过氧化物酶4活性受到抑制,脂质氧化物进一步积累,同时过多的铁离子发生Fenton反应,产生大量ROS,攻击生物大分子,使细胞出现铁死亡现象。铁死亡可能是由特定的诱导物引起的,目前已经发现铁死亡诱导剂Erastin和RSL3均可以诱导铁死亡,其特征是细胞内铁和脂质ROS积累,并在形态学上以线粒体收缩为特征[6]。与这些研究类似,本研究发现FAC刺激同样可以诱导成骨细胞出现线粒体收缩等铁死亡特征性表现,同时表现出更低的矿化能力,但受影响的成骨细胞的线粒体形态变化是否严格与铁离子浓度梯度相关仍不清楚,需要进一步设置更多浓度梯度组进行详细探究。铁死亡中脂质过氧化的毒性可以被铁螯合剂(如去铁胺)或多种亲脂原子团(如维生素E、脂肪酶1)等中和。大量研究证实,氧化应激在骨质疏松症的发病机制中起显著作用。因此,探讨铁死亡现象在骨质疏松中的具体作用非常有意义,可以为骨质疏松的临床治疗提供新的思路。
哺乳动物中MAPK家族主要包括ERK、p38和JNK等节点。MAPK的激活主要由其上游的MAPK激酶激活,也称为MAP2K,而在MAP2K的上游还存在十几种MAPK激酶,被称为MAP3K。ASK1是近年来才被发现的一个MAPK途径的上游激酶。研究表明,ASK1可被广泛的细胞内/外应激激活,如寒冷刺激、内质网应激和紫外线辐射等。最新研究[10]发现,氧化应激也可以激活ASK1,其主要机制是通过抑制硫氧还蛋白的构象转变。有文献报道过氧化氢可以通过ASK1途径诱导细胞死亡,学术界已经公认铁蓄积会因Fenton反应释放大量的ROS,这表明ASK1作为p38的上游信号分子,与铁离子的变化密切相关。本研究发现,高铁刺激可以激活ASK1磷酸化,进而引起下游p38磷酸化,从而激活这一MAPK相关通路,调控铁死亡的发生。同时有研究[11]发现,铁死亡与脑组织、肾脏和心脏组织的病理性细胞死亡相关,铁死亡可能作为p53下游的内源性肿瘤抑制机制,也可能利用铁死亡的小分子激活剂选择性消除Ras-Raf-MEK-ERK通路突变的癌细胞。虽然这个过程仍存在争议,但是理解这种新的细胞死亡方式如何被调控是非常有意义的。
本研究存在一定的不足,缺少体内实验的验证,同时对更多铁离子浓度梯度以及铁死亡过程中更深入的机制还有待于进一步的探索,这将是下一步研究的方向。
综上所述,本研究结果表明,高铁刺激可以通过激活成骨细胞ASK1-p38信号通路,从而抑制了成骨细胞的功能,并与成骨细胞铁死亡有关,这些结论为治疗骨质疏松提供了思路。
| [1] |
ELENA C, CHIARA M, ANGELICA B, et al. Hyperglycemia and diabetes induced by glucocorticoids in nondiabetic and diabetic patients:revision of literature and personal considerations[J]. Curr Pharm Biotechnol, 2018, 19(15): 1210-1220. DOI:10.2174/1389201020666190102145305 |
| [2] |
ROSSI F, PERROTTA S, FALCONE E, et al. Idiopathic and secondary osteoporosis in childhood[J]. Minerva Pediatr, 2005, 57(5): 203-211. |
| [3] |
ZHANG W, XU J, QIU J, et al. Novel and rapid osteoporosis model established in zebrafish using high iron stress[J]. Biochem Biophys Res Commun, 2018, 496(2): 654-660. DOI:10.1016/j.bbrc.2017.12.172 |
| [4] |
YANG J, ZHANG J, DING C, et al. Regulation of osteoblast differentiation and iron content in MC3T3-E1 cells by static magnetic field with different intensities[J]. Biol Trace Elem Res, 2018, 184(1): 214-225. DOI:10.1007/s12011-017-1161-5 |
| [5] |
WANG X, CHEN B, SUN J, et al. Iron-induced oxidative stress stimulates osteoclast differentiation via NF-κB signaling pathway in mouse model[J]. Metabolism, 2018, 83: 167-176. DOI:10.1016/j.metabol.2018.01.005 |
| [6] |
DIXON SJ, LEMBERG KM, LAMPRECHT MR, et al. Ferroptosis:an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [7] |
LIU F, ZHANG WL, MENG HZ, et al. Regulation of DMT1 on autophagy and apoptosis in osteoblast[J]. Int J Med Sci, 2017, 14(3): 275-283. DOI:10.7150/ijms.17860 |
| [8] |
JING X, DU T, CHEN K, et al. Icariin protects against iron overload-induced bone loss via suppressing oxidative stress[J]. J Cell Physiol, 2019, 234(7): 10123-10137. DOI:10.1002/jcp.27678 |
| [9] |
MENG HZ, ZHANG WL, LIU F, et al. Advanced glycation end products affect osteoblast proliferation and function by modulating autophagy via the receptor of advanced glycation end products/Raf protein/mitogen-activated protein kinase/extracellular signal-regulated kinase kinase/extracellular signal-regulated kinase (RAGE/Raf/MEK/ERK) pathway[J]. J Biol Chem, 2015, 290(47): 28189-28199. DOI:10.1074/jbc.m115.669499 |
| [10] |
HATTORI K, ISHIKAWA H, SAKAUCHI C, et al. Cold stress-induced ferroptosis involves the ASK1-p38 pathway[J]. EMBO Rep, 2017, 18(11): 2067-2078. DOI:10.15252/embr.201744228 |
| [11] |
GUINEY SJ, ADLARD PA, BUSH AI, et al. Ferroptosis and cell death mechanisms in Parkinson's disease[J]. Neurochem Int, 2017, 104: 34-48. DOI:10.1016/j.neuint.2017.01.004 |
 2021, Vol. 50
2021, Vol. 50