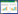文章信息
- 陈颖, 杨博文, 包博文, 李智, 车晓芳
- CHEN Ying, YANG Bowen, BAO Bowen, LI Zhi, CHE Xiaofang
- DYRK2高表达介导结直肠癌奥沙利铂耐药
- High DYRK2 expression mediates oxaliplatin resistance in colorectal cancer
- 中国医科大学学报, 2021, 50(5): 429-434
- Journal of China Medical University, 2021, 50(5): 429-434
-
文章历史
- 收稿日期:2020-09-28
- 网络出版时间:2021-05-17 9:12
2. 辽宁省抗肿瘤药物与生物治疗重点实验室, 沈阳 110001
2. Key Laboratory of Anticancer Drugs and Biotherapy of Liaoning Province, The First Hospital of China Medical University, Shenyang 110001, China
全球结直肠癌发病率一直呈上升趋势, 每年新诊断的肠癌超过120万例, 死亡病例高达60余万例[1]。但不幸的是, 肠癌患者的存活率仍然很低, 大约10%~15%的术后患者在5年内发生转移, 近一半的肠癌患者生存时间不足5年[2]。奥沙利铂是晚期肠癌一线化疗方案不可或缺的药物之一, 但仍有将近50%患者对奥沙利铂治疗无反应, 且目前为止仍缺乏化疗疗效的预测因子[3]。
奥沙利铂是铂类家族化合物的一种, 对肠癌细胞杀伤作用主要是与DNA碱基结合并与DNA相互作用, 触发凋亡途径, 造成DNA损伤[4]。截至目前, 奥沙利铂耐药机制主要包括细胞内药物的低效摄取、抗氧化谷胱甘肽系统的解毒激活、DNA修复的增强和抗凋亡途径的激活以及上皮-间充质转化等[5-6]。但对奥沙利铂药物敏感性没有特定的疗效预测因子, 找到奥沙利铂疗效相关的分子生物标志物至关重要。
1 材料与方法 1.1 数据来源从基因表达数据库(gene expression omnibus, GEO) 下载结直肠癌基因表达芯片数据集, 筛选条件为晚期肠癌患者, 含有奥沙利铂药物的疗效评价信息, 病例数 > 30例, 包含全基因组RNA表达谱数据。筛选出5个CEO数据集, 分别为GSE27702、GSE69657、GSE72968、GSE72969和GSE72970。在人类癌细胞系(national cancer institute, NCI60) 数据库中找到与奥沙利铂相关的基因, 按照相关性进行排序, P < 0.05纳入统计。合并了CEO中5例的公开测序数并除去批间差, 筛选出与奥沙利铂相关的基因。将2种方法筛选出来的奥沙利铂耐药相关分子取交集, 找出28个基因, 其中包含双特异性酪氨酸磷酸化调节激酶(dual specificity tyrosine phosphorylation regulated kinase 2, DYRK2), 见图 1。
|
| A, 28 genes were found in common in our screens of the GEO and NCI60 databases; B, mRNA expression of 28 genes in the GEO database. 图 1 GEO数据集与NCI60筛选出的基因交集及mRNA表达= Fig.1 Intersection of gene screening in GEO and NCI60 databases, and mRNA expression |
1.2 在线数据库分析
应用基因、蛋白质相互作用关系检索工具(search tool for the retrival of interacting genes/proteins, String) 找到与DYRK2相关蛋白, 功能富集分析数据库(the database for annotation, visualization and integrated discovery, DAVID) 和功能富集分析数据库(Metascape) 进行在线通路富集分析, 基因表达谱分析数据库(gene expression profilling interactive analysis, GEPIA) 分析DYRK2与Notch蛋白的相关性。
1.3 细胞系培养HCT116和Caco2肠癌细胞购自上海中国科学院典型培养物保藏委员会细胞库, 应用含有10%灭活胎牛血清、1%青链霉素的1640培养液培养。细胞置于37 ℃、5%CO2、饱和湿度的常氧培养箱内培养。待细胞长满培养基90%左右, 使用0.25%胰蛋白酶消化传代, 传代频率为3~4 d。所有实验均采用对数生长期细胞。每8周弃掉细胞并复苏冻存细胞。
1.4 MTT试验MTT法测定细胞活性, 将细胞悬液(3×103/180 μL) 加入到96孔培养板中, 在37 ℃和5%CO2条件下进行培养。待细胞贴壁后, 加入不同浓度的奥沙利铂(1 µmol/L、3 µmol/L、10 µmol/L、30 µmol/L、50 µmol/L), 在1640培养液中培养48 h, 每孔加入20 μL MTT溶液(5 mg/mL), 在37 ℃和5%CO2条件下培养4 h。吸弃每孔中的溶液, 并加入200 μL DMSO。采用酶标仪检测570 nm处的光密度(optical density, OD) 值。按照公式计算细胞增殖百分比: 相对细胞活性= (OD570测量-OD570空白) / (OD570对照-OD570空白) ×100%。使用GraphPad Prism 7.0计算半抑制浓度(50% inhibiting concentration, IC50) 值。
1.5 脂质体介导siRNA转染HCT116和Caco2以8×104/孔接种在6孔板内, 待24 h细胞贴壁。将15 µL siRNA-DYRK2-NC、15 µL siRNA-DYRK2-1、15 µL siRNA-DYRK2-2分别加入于235 µL无血清无抗生素(双无)的培养液静置5 min, 等待过程中将6 µL Lipofectamin2000轻轻加入于244 µL双无的1640培养液中。后续将含有siRNA的培养液混入后含有Lipofectamin2000培养液静置20 min。原培养板更换为1.5mL的双无培养液。最后将总体积500 µL的混合液加入培养孔中, 轻轻混匀。将细胞置入培养箱孵育6 h后, 更换含10%胎牛血清和1%青链霉素的培养液, 转染72 h后收取PCR样。
1.6 实时PCR加入TRIzol溶解RNA。按照PrimeScript® RT reagent Kit with gDNA Eraser (日本TaKaRa公司) 试剂盒说明书将800 ng总RNA反转录成cDNA。后续按照SYBR® Premix EX TaqTM 2 (日本TaKaRa公司) 试剂盒流程将800 ng cDNA配置成实时PCR反应液。RT-qPCR用Applied Biosystems® 7500 Real-Time PCR Systems (美国Thermo公司) 进行检测, 以18 S作为内参, 检测DYRK2 mRNA的表达。
1.7 统计学分析结果均进行3次独立实验, 计量资料采用x±s表示。采用SPSS 17.0统计软件进行统计学分析, 组间比较采用t检验, P < 0.05为差异有统计学意义。图形采用GraphPad 7.0进行绘制。
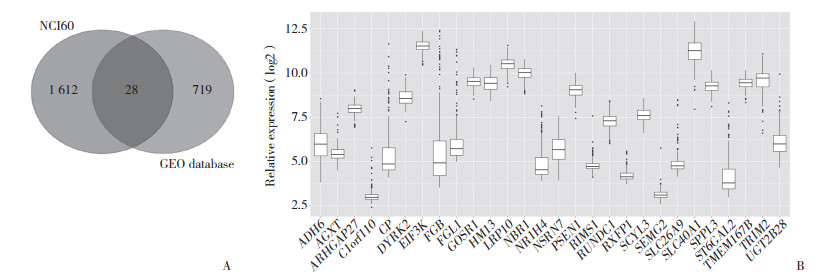
2 结果 2.1 药物敏感性检测CELL细胞系NCI60中包括乳腺癌、中枢神经系统、肠癌、白血病、恶性黑色素瘤、肺癌、卵巢癌、前列腺癌以及肾癌肿瘤的细胞系, DYRK2与奥沙利铂的药物敏感性为负相关。在单独肠癌细胞系中, DYRK2与奥沙利铂的药物敏感性也为负相关。即DYRK2的表达越高, 奥沙利铂越耐药。见图 2。
|
| A, DYRK2 expression in multiple solid tumors correlates negatively with sensitivity to oxaliplatin; B, DYRK2 expression in colorectal cancer correlated negatively with sensitivity to oxaliplatin. 图 2 DYRK2与奥沙利铂敏感性 Fig.2 DYRK2 and oxaliplatin sensitivity |
2.2 DYRK2在肠癌细胞系Caco2和HCT116中的敲减效率
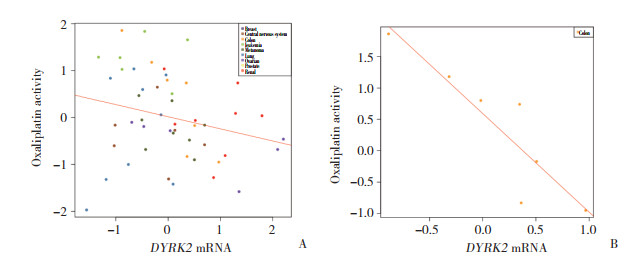
将Caco2和HCT116细胞系分为对照组和不同DYRK2敲减序列组, 48 h实时PCR验证各组细胞中DYRK2的mRNA表达。结果显示, 与对照组相比, Caco2细胞系中si-DYRK2-1 (0.299±0.037)和si-DYRK2-3 (0.190±0.016) 的mRNA表达减少(P < 0.000 1), HCT116细胞系中si-DYRK2-1 (0.232±0.004) 和si-DYRK2-3 (0.223 ±0.019) 的mRNA表达减少(P < 0.000 1)。见图 3。
|
| A, Caco2;B, HCT116. *P < 0.001 vs control group. 图 3 转染后Caco2和HCT116细胞中DYRK2的mRNA表达 Fig.3 DYRK2 mRNA expression in Caco2 and HCT116 cells after siRNA knockdown |
2.3 DYRK2敲减后Caco2和HCT116对奥沙利铂的敏感性
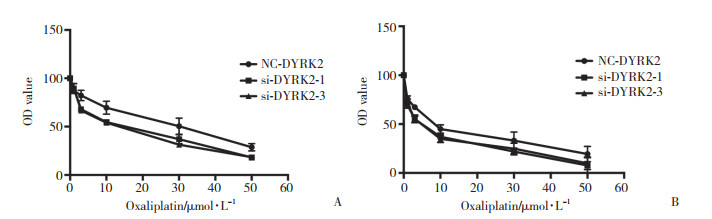
Caco2和HCT116中DYRK2敲减48 h后, 加入不同浓度奥沙利铂进行MTT试验, 48 h后显示敲减后细胞对奥沙利铂敏感性增加。说明DYRK2在肠癌奥沙利铂耐药中发挥作用。见图 4。
|
| A, Caco2;B, HCT116. 图 4 敲减DYRK2后Caco2和HCT116细胞在不同奥沙利铂浓度下的OD值 Fig.4 After DYRK2 knockdown, OD values of Caco2 and HCT116 cells exposed to different oxaliplatin concentrations |
2.4 String在线分析
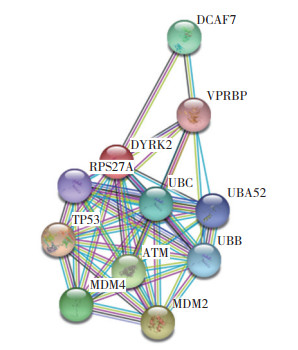
将DYTK2输入String数据库中, 设定中度相关, 找到与DYRK2相关的11个蛋白, 其中包括TP53等肿瘤相关蛋白, 见图 5。
|
| 图 5 String在线分析 Fig.5 String online analysis |
2.5 DAVID和Metascape在线通路富集分析
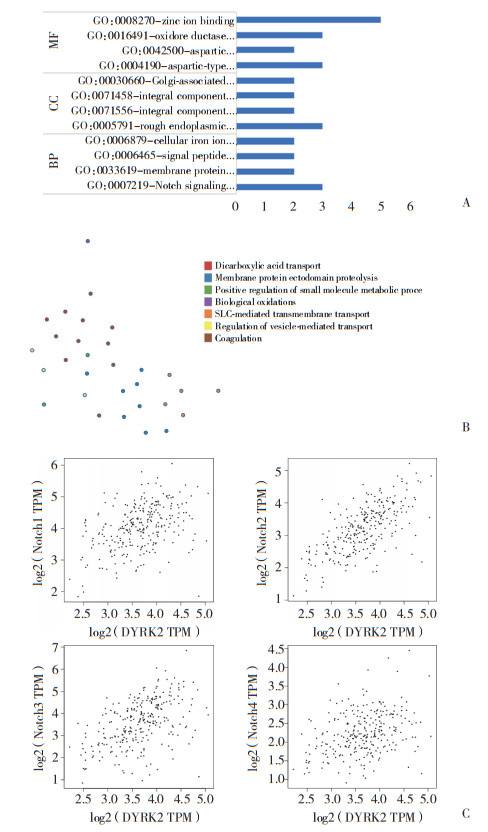
将得到的28个基因, 利用DAVID线数据库进行GO分析, Metascape在线数据库进行基因聚类分析, 设定P < 0.05。结果显示, GO分析中分子功能(molecular function, MF) 包括锌离子结合、氧化还原酶、天冬氨酸蛋白酶。细胞组分(cellular component, CC) 包括高尔基体相关、细胞整体组分相关、内质网相关。生物过程(biological process, BP) 包括细胞内铁离子、信号肽、膜蛋白、Notch信号通路。此外, 基因聚类分析到二羧酸转运子、膜蛋白胞外域蛋白水解等9个信号通路。GEPIA在线分析结果显示, DYRK2与Notch的4个亚型Notch1相关性为0.33, Notch2相关性为0.63, Notch3相关性为0.43, Notch4相关性为0.30。提示DYRK2可能通过Notch其中的后续通路发挥奥沙利铂的耐药作用。见图 6。
|
| A, results of GO analysis using the DAVID online database; B, results of KEGG analysis using the Metascape online database; C, correlation between DYRK2 and Notch according to the GEPIA online database. 图 6 在线数据库进行后续通路分析及相关性分析 Fig.6 Online databases queried for follow-up pathway and correlation analyses |
3 讨论
奥沙利铂为肠癌患者带来生存获益, 但奥沙利铂耐药也是导致化疗失效或者疗效减弱的重要原因之一。本研究筛选出5个GEO数据集, 并且将NCI60中奥沙利铂耐药相关基因取交集, 筛选出可能与奥沙利铂相关的预测因子DYRK2。DYRK2是一个双特异性酪氨酸(Y) 磷酸化调节激酶基因, 是进化保守的DYRKs家族的成员[7-9]。有研究[10]表明DYRK2参与许多生物学事件, 如细胞周期进程和DNA损伤。癌细胞中DYRK2基因的敲除缩短了G1期, 加速了细胞增殖[11]。此外, DYRK2与含有EDD、DDB1和VPRBP蛋白的E3连接酶复合体(EDVP复合体) 结合。小干扰RNA介导的DYRK2缺失破坏了EDD-DDB1-VPRBP复合物的形成, 这些观察表明蛋白激酶DYRK2是促进E3连接酶组装的支架[12]。DYRK2曾报道与肠癌肝转移相关[13], 肝癌中与奥沙利铂敏感性相关[14], 但在肠癌中与奥沙利铂关系不清。
将选取的Caco2、HCT116肠癌细胞进行了DYRK2敲减, 证实DYRK2表达减少后对奥沙利铂的敏感性增加, 说明DYRK2高表达与奥沙利铂耐药相关, 对在线数据分析结果进行了验证。首先应用String数据库分析了与DYRK2相关的11个蛋白, 其中包括著名的TP53蛋白, 研究[15]显示, KRAS/TP53突变显著增加了肠癌HCT116细胞对奥沙利铂的活性, T53的半衰期缩短能够抑制奥沙利铂诱导的大肠癌细胞凋亡[16]。前期有研究[17]显示DYRK2可以通过磷酸化Ser46调节Tp53诱导DNA损伤诱导凋亡, DYRK2是否在奥沙利铂耐药中与TP53有协同作用后续有待基础实验验证。通路富集中包括经典Notch通路, Notch1受体胞内区NICD1和非磷酸化的β-catenin是Notch1和Wnt信号转导的报告因子, 在既往研究[18]建立的HCT116耐药细胞系中表达上调。激活的Notch信号促进了肠癌干性相关基因的表达, 从而导致了奥沙利铂的耐药[19]。GEPIA在线数据中看到DYRK2与Notch的4个亚型高度相关, 后续可能通过Notch通路发挥作用。
综上所述, DYRK2高表达提示奥沙利铂耐药, 可能作为结直肠癌奥沙利铂疗效的预测因子, 后续需要进一步在临床患者中进行验证, 并且后续作用机制需要进一步深入研究, 如能找到阻断药物, 将使肠癌患者更大获益。
| [1] |
JEMAL A, BRAY F, CENTER MM, et al. Global cancer statistics[J]. CA: A Cancer J Clin, 2011, 61(2): 69-90. DOI:10.3322/caac.20107 |
| [2] |
RASMUSSEN MH, LYSKJAER I, JERSIE-CHRISTENSEN RR, et al. miR-625-3p regulates oxaliplatin resistance by targeting MAP2K6-p38 signalling in human colorectal adenocarcinoma cells[J]. Nat Commun, 2016, 7: 12436. DOI:10.1038/ncomms12436 |
| [3] |
RASMUSSEN MH, JENSEN NF, TARPGAARD LS, et al. High expression of microRNA-625-3p is associated with poor response to first-line oxaliplatin based treatment of metastatic colorectal cancer[J]. Mol Oncol, 2013, 7(3): 637-646. DOI:10.1016/j.molonc.2013.02.016 |
| [4] |
LI H, YANG BB. Friend or foe: the role of microRNA in chemotherapy resistance[J]. Acta Pharmacol Sin, 2013, 34(7): 870-879. DOI:10.1038/aps.2013.35 |
| [5] |
HÖLZEL M, BOVIER A, TÜTING T. Plasticity of tumour and immune cells: a source of heterogeneity and a cause for therapy resistance?[J]. Nat Rev Cancer, 2013, 13(5): 365-376. DOI:10.1038/nrc3498 |
| [6] |
MCMILLIN DW, NEGRI JM, MITSIADES CS. The role of tumour-stromal interactions in modifying drug response: challenges and opportunities[J]. Nat Rev Drug Discov, 2013, 12(3): 217-228. DOI:10.1038/nrd3870 |
| [7] |
BECKER W. Emerging role of DYRK family protein kinases as regulators of protein stability in cell cycle control[J]. Cell Cycle, 2012, 11(18): 3389-3394. DOI:10.4161/cc.21404 |
| [8] |
YOSHIDA K. Role for DYRK family kinases on regulation of apoptosis[J]. Biochem Pharmacol, 2008, 76(11): 1389-1394. DOI:10.1016/j.bcp.2008.05.021 |
| [9] |
ARANDA S, LAGUNA A, DE LA LUNA S. DYRK family of protein kinases: evolutionary relationships, biochemical properties, and functional roles[J]. Faseb J, 2011, 25(2): 449-462. DOI:10.1096/fj.10-165837 |
| [10] |
MADDIKA S, CHEN J. Protein kinase DYRK2 is a scaffold that facilitates assembly of an E3 ligase[J]. Nat Cell Biol, 2009, 11(4): 409-419. DOI:10.1038/ncb1848 |
| [11] |
NIHIRA NT, YOSHIDA K. Engagement of DYRK2 in proper control for cell division[J]. Cell Cycle, 2015, 14(6): 802-807. DOI:10.1080/15384101.2015.1007751 |
| [12] |
TAIRA N, MIMOTO R, KURATA M, et al. DYRK2 priming phosphorylation of c-Jun and c-Myc modulates cell cycle progression in human cancer cells[J]. J Clin Invest, 2012, 122(3): 859-872. DOI:10.1172/jci60818 |
| [13] |
ITO D, YOGOSAWA S, MIMOTO R, et al. Dual-specificity tyrosine-regulated kinase 2 is a suppressor and potential prognostic marker for liver metastasis of colorectal cancer[J]. Cancer Sci, 2017, 108(8): 1565-1573. DOI:10.1111/cas.13280 |
| [14] |
ZHANG X, XU P, NI W, et al. Downregulated DYRK2 expression is associated with poor prognosis and Oxaliplatin resistance in hepatocellular carcinoma[J]. Pathol Res Pract, 2016, 212(3): 162-170. DOI:10.1016/j.prp.2016.01.002 |
| [15] |
OZAWA-UMETA H, KISHIMOTO A, IMAIZUMI A, et al. Curcumin β-D-glucuronide exhibits anti-tumor effects on oxaliplatin-resistant colon cancer with less toxicity in vivo[J]. Cancer Sci, 2020, 111(5): 1785-1793. DOI:10.1111/cas.14383 |
| [16] |
CHOI TG, NGUYEN MN, KIM J, et al. Cyclophilin B induces chemoresistance by degrading wild-type p53 via interaction with MDM2 in colorectal cancer[J]. J Pathol, 2018, 246(1): 115-126. DOI:10.1002/path.5107 |
| [17] |
TAIRA N, NIHIRA K, YAMAGUCHI T, et al. DYRK2 is targeted to the nucleus and controls p53 via Ser46 phosphorylation in the apoptotic response to DNA damage[J]. Mol Cell, 2007, 25(5): 725-738. DOI:10.1016/j.molcel.2007.02.007 |
| [18] |
KUKCINAVICIUTE E, JONUSIENE V, SASNAUSKIENE A, et al. Significance of Notch and Wnt signaling for chemoresistance of colorectal cancer cells HCT116[J]. J Cell Biochem, 2018, 119(7): 5913-5920. DOI:10.1002/jcb.26783 |
| [19] |
WANG Q, CHEN X, JIANG YH, et al. Elevating H3K27me3 level sensitizes colorectal cancer to oxaliplatin[J]. J Mol Cell Biol, 2020, 12(2): 125-137. DOI:10.1093/jmcb/mjz032 |
 2021, Vol. 50
2021, Vol. 50