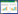文章信息
- 高丹, 王科峰, 卢丽萍
- GAO Dan, WANG Kefeng, LU Liping
- 粪便钙卫蛋白联合血清学抗体检测诊断炎症性肠病的临床应用价值
- The diagnostic utility of fecal calprotectin used in combination with an antibody against chronic inflammatory bowel disease
- 中国医科大学学报, 2021, 50(5): 425-428
- Journal of China Medical University, 2021, 50(5): 425-428
-
文章历史
- 收稿日期:2020-08-31
- 网络出版时间:2021-05-17 9:11
2. 中国医科大学附属盛京医院 泌尿外科, 沈阳 110004
2. Department of Urology Surgery, Shengjing Hospital of China Medical University, Shenyang 110004, China
炎症性肠病(inflammatory bowel disease, IBD) 是一类主要累及消化道的慢性非特异性肠道炎症性疾病, 主要包括溃疡性结肠炎(ulcerative colitis, UC) 和克罗恩病(Crohn disease, CD)。IBD的病因及发病机制尚不完全明确, 其诊断主要依据临床表现、实验室检查、影像学检查、内镜和组织病理学检查[1-2]。近年来, IBD的实验室检查取得了较大的进展, 可以通过某些生物标志物辅助IBD的诊断与鉴别诊断、疾病活动度的评估、治疗应答以及预测复发[3-4]。这些生物标志物主要有粪便钙卫蛋白(fecal calprotectin, FC) 及慢性IBD抗体, 包括抗胰腺腺泡抗体(anti-pancreatic antibody, PAB)、抗酿酒酵母抗体(anti-saccharomyces cerevisiae antibody, ASCA)、抗小肠杯状细胞抗体(anti-intestinal goblet cell antibody, GAB)、核周型抗中性粒细胞胞浆抗体(perinuclear anti-neutrophil cytoplasmic antibodies, pANCA) 等。本研究拟对FC和慢性IBD抗体在肠道疾病中的检测结果进行总结, 并对其在IBD诊断中的应用价值进行分析。
1 材料与方法 1.1 临床资料选择2019年3月至2020年3月中国医科大学附属盛京医院消化内科收治的肠道疾病患者106例, 年龄14~84岁, 男62例, 女44例, 以病理及肠镜检查结果为金标准分为UC组(n=64)和CD组(n=42)。另选择同期健康体检者(n=30)作为对照组(均无遗传性家族病史、自身免疫性疾病及腹痛、腹泻等临床症状)。UC组和CD组患者均符合IBD诊断与治疗的共识意见[1], 并排除严重心、肝、肾疾病等。
1.2 方法 1.2.1 粪便标本采集在肠镜检查口服清肠药前3 d内留取清晨第1次排便的标本[5-6]。严格按照钙卫蛋白检测试剂盒(胶体金法) (珠海市医友生物科技有限公司) 说明书进行粪便标本采样, 用试剂盒标本处理管中的采样棒采取约15 mg的固体粪便标本至1.5 mL稀释液中;若为液体标本, 则用微量移液器移取15 µL粪便标本至1.5 mL稀释液中。尽量保证不同标本粪便取样量一致。检测标本时严格按照说明书操作, 保证每份标本滴加的样本液和结果判读的时间均一致。由2名检验主管技师同时进行结果判读, 以保证结果的一致性。
1.2.2 血液样本采集清晨采集患者空腹静脉血3~4 mL, 置于真空促凝管中, 离心5 min (3 500 r/min)。采用慢性IBD抗体检测试剂盒(间接免疫荧光法) (德国欧蒙医学实验诊断股份公司)体外定性检测人血清中IgA和IgG型PAB、ASCA、GAB和pANCA。严格按照说明书操作, 由2名检验主管技师同时进行结果判读, 以保证结果的一致性。
1.3 统计学分析采用SPSS 19.0统计学软件进行数据分析, 计数资料用率(%) 表示, 组间比较采用χ2检验;采用受试者工作特征(receiver operating characteristic, ROC)曲线, 计算曲线下面积(area under curve, AUC)。P < 0.05为差异有统计学意义。
2 结果 2.1 各组患者中IgA和IgG型PAB、ASCA、GAB、pANCA及FC的阳性比例分布UC组FC阳性率与对照组比较, 差异有统计学意义(P < 0.05);CD组FC、PAB-IgG、ASCA-IgG、GAB-IgG阳性率与对照组比较, 差异有统计学意义(P < 0.05)。见表 1。
| Group | n | FC | PAB | ASCA | GAB | pANCA | |||||||
| IgG | IgA | IgG | IgA | IgG | IgA | IgG | IgA | ||||||
| UC | 64 | 51(79.7)1) | 1(1.6) | 0(0) | 1(1.6) | 1(1.6) | 7(10.9) | 0(0) | 7(10.9) | 6(9.4) | |||
| CD | 42 | 34(81.0)1) | 6(14.3)1) | 2(4.8) | 6(14.3)1) | 5(11.9) | 11(26.2)1) | 0(0) | 3(7.1) | 0(0) | |||
| Control | 30 | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | 0(0) | |||
| 1) P < 0.05 vs control group. UC, ulcerative colitis;CD, Crohn disease;FC, fecal calprotectin;PAB, anti-pancreatic antibody;ASCA, anti-saccharomyces cerevisiae antibody;GAB, anti-intestinal goblet cell antibody;pANCA, perinuclear anti-neutrophil cytoplasmic antibodies. | |||||||||||||
2.2 各组中FC、慢性IBD抗体阳性检测结果
4种慢性IBD抗体中1项为阳性则判定为慢性IBD抗体检测阳性。本研究结果显示, UC、CD组FC、慢性IBD抗体及联合检测阳性率与对照组比较, 差异有统计学意义(P < 0.05);各组FC、慢性IBD抗体联合检测阳性率高于2项指标单独检测。其中, UC组FC、慢性IBD抗体联合检测阳性率与慢性IBD抗体单独检测比较, 差异有统计学意义(P < 0.05)。见表 2。
| Group | n | FC | CIBD antibody | FC+CIBD antibody |
| UC | 64 | 51(79.7) 1) | 20(31.3) 1) | 57(89.1) 1), 2) |
| CD | 42 | 34(81.0) 1) | 24(57.1) 1) | 39(92.9) 1) |
| Control | 30 | 0(0) | 0(0) | 0(0) |
| 1) P < 0.05 vs control group. UC, ulcerative colitis;CD, Crohn disease;FC, fecal calprotectin;CIBD, chronic inflammatory bowel disease. 2) P < 0.05 vs CIBD antibody. | ||||
2.3 FC、慢性IBD抗体诊断IBD准确性比较
以肠镜及病理诊断为金标准, 其他肠道疾病组为对照, 绘制FC、慢性IBD抗体诊断IBD的ROC曲线。结果显示, FC、慢性IBD抗体、FC联合慢性IBD抗体的AUC分别为0.859、0.583、0.828;95%CI分别为0.790~0.929, 0.478~0.688, 0.738~0.917。提示FC诊断IBD准确性更高。见图 1。

|
| 图 1 FC、慢性IBD抗体诊断炎症性肠病ROC曲线 Fig.1 ROC curve of FC and antibody against chronic inflammatory bowel disease in the diagnosis of inflammatory bowel disease |
2.4 FC、慢性IBD抗体IBD诊断效能分析
联合检测FC与慢性IBD抗体, 其中1项阳性即判定为阳性。结果显示, FC联合慢性IBD抗体检测的灵敏度和阴性预测值高于2项指标单独检测;FC单独检测特异性和阳性预测值高于慢性IBD抗体单独检测及FC联合慢性IBD抗体检测。见表 3。
| Item | Specificity | Sensitivity | Positive predict value | Negative predict value |
| FC | 91.7 | 80.2 | 96.6 | 61.1 |
| CIBD antibody | 75.0 | 41.5 | 83.0 | 30.3 |
| FC+ CIBD antibody | 75.0 | 90.6 | 91.4 | 73.0 |
| FC, fecal calprotectin;CIBD, chronic inflammatory bowel disease. | ||||
3 讨论
目前, 诊断IBD主要依据临床表现、内镜检查、组织病理学检查、实验室和放射学检查等, 且还需排除其他原因引起的肠道炎症疾病。但内镜属于有创检查, 患者的心理负担较重, 接受性较差, 而且当患者的临床表现、内镜和病理学特征不典型时会更加难以诊断[7]。因此, 临床上需要非侵入性、准确客观的方法对IBD患者进行诊断。近年来, IBD的实验室检查取得了很大进展, 且实验室检查具有客观、方便、侵入性低等优点, 在IBD的诊断方面有很高的价值。
FC主要存在于中性粒细胞, 也存在于单核细胞、巨噬细胞、鳞状上皮细胞等。在肠道发生炎症时, 由于肠黏膜渗透性增加, 使中性粒细胞渗透并释放钙卫蛋白, 在粪便中可检测到钙卫蛋白, 因此, FC与肠道炎症相关[8]。同时, FC与IBD的筛选、监测和预测疾病复发有关[9]。本研究显示, 在IBD中, FC阳性率大于慢性IBD抗体, FC可用于鉴别IBD与非IBD [10]。pANCA是核周型抗中性粒细胞胞浆抗体, 可见于20%~80%的UC患者和5%~25%的CD患者[11-14]。ASCA则是抗酿酒酵母抗体, 是最早被发现的IBD自生抗体, 可见于22%~71%的CD患者和0%~14%UC患者[12-14], 在疾病的缓解期, ASCA仍可以作为CD炎症表现的生物学标志物[15]。PACA是抗胰腺腺泡抗体, 它在CD中的阳性率明显高于UC, 特异度高达96%~98%, 说明可作为诊断CD的特异性血清学指标[13-14]。本研究中, pANCA (IgG+IgA) 阳性见于20%的UC患者和7%的CD患者;ASCA (IgG+IgA) 阳性见于26%的CD患者和3%的UC患者, 与其他研究结论一致。本研究结果提示慢性IBD抗体中, PACA、ASCA与CD相关, 可用于鉴别UC;pANCA在UC中的表达高于CD, 为UC特异性抗体, 与文献[16]报道一致。
FC与慢性IBD抗体联合检测对于IBD与非IBD胃肠道疾病的鉴别具有重要意义[16]。本研究中, 各组患者FC与慢性IBD抗体联合检测阳性率高于2项指标单独检测, 提高了检测的灵敏度。根据诊断IBD的ROC曲线, FC、慢性IBD抗体、FC+慢性IBD抗体的AUC分别为0.859、0.583、0.828, 表明FC和FC+慢性IBD抗体检测对IBD诊断均有一定价值, 但FC单独检测对IBD诊断准确性更高。
在IBD诊断效能方面, 单独检测FC对IBD诊断特异性可达91.7%, 适合用来鉴别IBD与非IBD, 与慢性IBD抗体联合检测可以提高检测的敏感性, 因此, FC联合慢性IBD抗体检测在IBD的诊断中具有重要的临床应用价值。
| [1] |
吴开春, 梁洁, 冉志华, 等. 炎症性肠病诊断与治疗的共识意见(2018年·北京)[J]. 中国实用内科杂志, 2018, 38(9): 796-813. DOI:10.19538/j.nk2018090106 |
| [2] |
GECSE KB, VERMEIRE S. Differential diagnosis of inflammatory bowel disease: imitations and complications[J]. Lancet Gastroenterol Hepatol, 2018, 3(9): 644-653. DOI:10.1016/s2468-1253(18)30159-6 |
| [3] |
ZHOU GX, SONG Y, YANG WJ, et al. ASCA, ANCA, ALCA and many more: are they useful in the diagnosis of inflammatory bowel disease?[J]. Dig Dis, 2016, 34(1-2): 90-97. DOI:10.1159/000442934 |
| [4] |
DAI C, JIANG M, SUN MJ. Fecal markers in the management of inflammatory bowel disease[J]. Postgrad Med, 2018, 130(7): 597-606. DOI:10.1080/00325481.2018.1503919 |
| [5] |
曾俊祥, 吕婕, 罗婷, 等. 粪便钙卫蛋白检测及其实验影响因素[J]. 临床检验杂志, 2019, 37(10): 756-759. DOI:10.13602/j.cnki.jcls.2019.10.09 |
| [6] |
AYLING RM, KOK K. Fecal calprotectin[J]. Adv Clin Chem, 2018, 87: 161-190. DOI:10.1016/bs.acc.2018.07.005 |
| [7] |
ROGLER G, BIEDERMANN L. Clinical utility of biomarkers in IBD[J]. Curr Gastroenterol Rep, 2015, 17(7): 26. DOI:10.1007/s11894-015-0449-x |
| [8] |
MANCEAU H, CHICHA-CATTOIR V, PUY H, et al. Fecal calprotectin in inflammatory bowel diseases: update and perspectives[J]. Clin Chem Lab Med, 2017, 55(4): 474-483. DOI:10.1515/cclm-2016-0522 |
| [9] |
RICCIUTO A, GRIFFITHS AM. Clinical value of fecal calprotectin[J]. Crit Rev Clin Lab Sci, 2019, 56(5): 307-320. DOI:10.1080/10408363.2019.1619159 |
| [10] |
MARI A, BAKER FA, MAHAMID M, et al. Clinical utility of fecal calprotectin: potential applications beyond inflammatory bowel disease for the primary care physician[J]. Ann Gastroenterol, 2019, 32(5): 425-430. DOI:10.20524/aog.2019.0394 |
| [11] |
HERSZÉNYI L, TULASSAY Z. The role of autoantibodies in inflammatory bowel disease[J]. Dig Dis, 2012, 30(2): 201-207. DOI:10.1159/000336702 |
| [12] |
LOCHMAN I, KRÁL V, LOCHMANOVÁ A, et al. ANCA in the diagnosis of neutrophil-mediated inflammation[J]. Autoimmun Rev, 2011, 10(6): 295-298. DOI:10.1016/j.autrev.2010.11.003 |
| [13] |
顾嫣, 王天蓉, 沈骏, 等. 核周型抗中性粒细胞胞质抗体和抗酿酒酵母抗体在炎症性肠病中的临床意义[J]. 胃肠病学, 2009, 14(11): 674-677. DOI:10.3969/j.issn.1008-7125.2009.11.011 |
| [14] |
刘作静, 丁士刚. 炎症性肠病患者相关血清学标志物实验室检测的临床意义[J]. 中华检验医学杂志, 2018, 41(10): 778-780. DOI:10.3760/cma.j.issn.1009-9158.2018.10.015 |
| [15] |
DUARTE-SILVA M, AFONSO PC, DE SOUZA PR, et al. Reappraisal of antibodies against saccharomyces cerevisiae (ASCA) as persistent biomarkers in quiescent Crohn's disease[J]. Autoimmunity, 2019, 52(1): 37-47. DOI:10.1080/08916934.2019.1588889 |
| [16] |
刘国瑞, 马巧蓉, 李玲慧, 等. 粪便钙卫蛋白及血清自身抗体联合检测对炎症性肠病的诊断价值[J]. 临床检验杂志, 2017, 35(1): 24-27. DOI:10.13602/j.cnki.jcls.2017.01.06 |
 2021, Vol. 50
2021, Vol. 50