文章信息
- 王蛟, 杨清
- 宫颈髓系肉瘤1例报道及文献复习
- A case of cervical myeloid sarcoma and literature review
- 中国医科大学学报, 2021, 50(4): 374-377
- Journal of China Medical University, 2021, 50(4): 374-377
-
文章历史
- 收稿日期:2020-06-30
- 网络出版时间:2021-04-07 15:03
血液系统恶性肿瘤可以表现为髓外软组织肿块,髓系肉瘤(myeloid sarcoma,MS) 是其罕见的临床表现之一,是指在骨髓有或无病变的情况下不成熟的髓细胞在髓外形成肿瘤。粒细胞肉瘤(granulocytic sarcoma,GS) 为其最常见的病理类型。发生于宫颈的MS临床罕见,现报道1例我院确诊的宫颈MS,并对近10年国内外相关文献复习分析,以期提高对该病的认识,为临床诊治提供参考。
1 材料与方法 1.1 病例资料患者49岁,孕2产1,以“阴道不规则流血2个月”为主诉就诊。查体未见明显异常。妇科检查: 外阴已婚经产型,阴道内少量白色分泌物。宫颈肥大,质硬,直径约8 cm,阴道穹窿消失,接触性出血(+)。子宫增大,活动可,无压痛,双附件区未及异常。三合诊: 双侧主骶韧带无增厚。当地医院彩超示宫颈见大小7.7 cm ×6.6 cm低回声肿物,血流丰富,阴道镜活检经我院病理会诊示宫颈间质弥漫浸润小细胞,免疫组化: CK (-),P63 (-),CD20 (-),CD3 (-),CD43 (+),髓过氧化物酶(myeloperoxidase,MPO) (-),诊断为宫颈MS。进一步于北京协和医院会诊,结果为(宫颈) GS。我院腹部CT示宫颈占位,大小约8.8 cm×7.4 cm (图 1A),胸部CT及血常规未见异常。建议患者完善骨穿明确有无骨髓病变,患者拒绝。因肿瘤病理类型特殊且较大,决定予化疗后再行手术治疗,除外化疗禁忌后,行宫颈局部今又生联合博来霉素注射,静脉应用DA方案(柔红霉素第1~3天,阿糖胞苷第1~7天) 化疗2个周期,复查CT示病灶较前略缩小(图 1B)。后行经腹广泛性子宫切除术+双附件切除术+盆腔淋巴结清扫术,术后病理回报: (宫颈) MS;萎缩性子宫内膜;阴道断端、子宫旁及子宫动脉未见癌;各组淋巴结反应性增生,免疫组化: CK (-),CD20 (-),CD3 (-),TdT (局灶+),MPO (+),CD34 (-),CD68 (+),Ki-67 (+ > 50%)。术后予DA方案化疗3个周期,过程顺利。术后5个月及8个月返院复查,全腹及胸部CT未见复发转移,肿瘤标志物及血常规正常,仍拒绝骨穿。术后10个月患者偶然间摸到左乳肿块,行乳腺超声示左乳腺相当于2~3点钟之间腺体回声不均,范围约4.0 cm×1.6 cm,内见1.7 cm×1.5 cm低回声区;右乳腺相当于10点钟距乳头4.8 cm腺体回声不均,范围约2.2 cm×1.4 cm。遂行乳腺肿物切除术,病理为(双侧乳腺) MS。患者于当地医院行骨穿,结果未见异常。术后11个月再次至我院复诊,发现阴道及外阴处肿瘤,遂于天津血液病医院行阿糖胞苷+依托泊苷方案化疗5 d,化疗后肿物增大,遂行外阴及阴道肿物切除术,病理为(阴道、双侧小阴唇) MS。因自觉化疗无效,拒绝进一步治疗,确诊后22个月病逝。
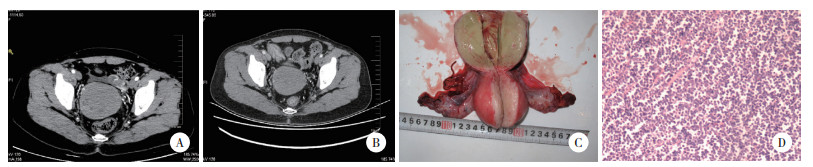
|
| A,腹部CT;B,腹部CT;C,大体标本;D,镜检(HE,×100). 图 1 本例患者的CT、病理组织学大体及光学显微镜下图像 |
1.2 研究方法
回顾性分析上述患者的临床病理资料,同时查找近10年国内外文献报道的宫颈GS患者的临床病理资料、治疗方案及预后情况,结合本例进行讨论。
2 结果 2.1 本例患者影像学及病理组织表现治疗前腹部CT示宫颈8.8 cm×7.4 cm占位,化疗2个周期后复查CT示病灶较前略缩小,大小约为7.6 cm×5.8 cm。后行经腹广泛性子宫切除术+双附件切除术+盆腔淋巴结清扫术,大体标本可见宫颈部实性细腻、浸润全层的绿色病灶,光镜下见瘤细胞核中等大小,核形不规则,核分裂易见。见图 1。
2.2 近10年文献报道的宫颈GS患者资料结合本例并复习文献,共找到资料齐全病例27例。发病年龄为23~66岁,平均(40.2±10.4) 岁。妇科查体以宫颈肿块为主要表现,共21例描述了病灶大小,病灶最大径1.2~11 cm,平均5.7 cm,≥4 cm者17例(81.0%)。23例(85.2%) 表现为阴道出血,4例无临床症状。21例为原发性GS (77.8%)。共24例行全身化疗,其中10例同时行手术治疗(广泛性子宫切除术或全子宫切除术),5例同时行放疗。随访时间为1~137个月,中位时间为8个月,至随访结束,共17例患者生存,10例死亡。见表 1。27例患者的主要免疫组化标志物的阳性率分别为MPO (25/25,100.0%),CD68 (7/10,70.0%),溶菌酶(8/9,88.9%),CD43 (15/15,100.0%),CD117 (11/15,73.3%),CD34 (9/16,56.3%),CD15 (3/9,33.3%),CD99 (5/7,71.4%),CD20 (0/17,0.0%),CD3 (0/18,0.0%)。
| 病例 | 年龄(岁) | 肿瘤大小(cm) | 症状 | 既往及诊断时有无AML | 初始治疗 | 转归及后续治疗 | 随访时间(月) | 结局 |
| 1[1] | 66 | 1.2 | 阴道流血 | 无 | 手术+IA方案化疗+放疗 | - | 6 | 生存 |
| 2[2] | 43 | 6.0 | 阴道流血 | 无 | TP方案化疗+放疗+DA方案化疗 | - | 6 | 生存 |
| 3[3] | 42 | 6.0 | 月经淋漓不尽 | 无 | DA方案化疗 | - | 3 | 生存 |
| 4[4] | 25 | 8.4 | 阴道流血 | 无 | IA方案化疗 | - | 3 | 生存 |
| 5[5] | 27 | 8.5 | 接触性出血 | 无 | 手术后放弃治疗 | - | 15 | 生存 |
| 6[6] | 43 | - | 阴道流血 | 无 | HA方案化疗 | - | 20 | 生存 |
| 7[7] | 43 | 6.0 | 接触性出血 | 无 | DA方案化疗+鞘内注射 | - | 7 | 生存 |
| 8[8] | 39 | 11.0 | 阴道流血 | 无 | 手术+化疗 | - | 2 | 生存 |
| 9[9] | 42 | 4.0 | 阴道流血 | 无 | 手术+DA方案化疗 | 化疗期间转化为AML | 12 | 死亡 |
| 10[9] | 51 | 4.5 | 无 | 无 | E-CHOP方案化疗+CHEP方案化疗+手术+DA方案化疗 | 55个月牙龈转移,放化疗+骨髓移植 | 91 | 生存 |
| 11[10] | 23 | 6.9 | 阴道流血 | 5年前患AML-M2 | MA方案化疗 | - | 1 | 生存 |
| 12[11] | 46 | 5.0 | 阴道流血 | 无 | 手术+DA方案化疗 | - | 8 | 生存 |
| 13[12] | 28 | - | 阴道流血 | 无 | 化疗 | 5个月发展成AML-M2a,化疗 | 20 | 死亡 |
| 14[13] | 49 | - | 阴道流血 | 无 | 放弃治疗 | - | 5 | 死亡 |
| 15[13] | 43 | - | 阴道流血 | 无 | 放疗+化疗 | - | 7 | 死亡 |
| 16[14] | 57 | 2.5 | 接触性出血 | 无 | 放弃治疗 | - | 6 | 生存 |
| 17[15] | 28 | 4.5 | 阴道流血 | 无 | IA方案化疗 | - | 18 | 死亡 |
| 18[16] | 36 | 3.3 | 阴道流血 | 无 | 化疗 | - | 16 | 生存 |
| 19[17] | 40 | 5.0 | 无 | 11年前患AML | 手术+化疗+放疗 | - | 21 | 生存 |
| 20[18] | 36 | 2.0 | 经量增多 | 有 | 化疗 | 化疗第31天发现多处淋巴结浸润,化疗 | 1.5 | 死亡 |
| 21[19] | 23 | - | 阴道流血 | 3年前患AML | 化疗 | - | 2 | 生存 |
| 22[20] | 48 | 6.0 | 无 | 有,AML-M2 | 化疗 | - | 6 | 生存 |
| 23[21] | 30 | 8.0 | 阴道流血 | 无 | 化疗+放疗 | - | 72 | 生存 |
| 24[22] | 46 | 6.0 | 无 | 无 | 手术+化疗 | 多部位复发,无AML, 化疗 | 21 | 死亡 |
| 25[22] | 39 | 6.9 | 阴道流血 | 无 | 手术+化疗 | 5个月进展为AML,化疗 | 26 | 死亡 |
| 26[23] | 43 | - | 接触性出血 | 无 | IA方案化疗+手术 | 11年阴道残端复发,化疗 | 137 | 死亡 |
| 27* | 49 | 8.8 | 阴道流血 | 无 | DA方案化疗+手术 | 1年乳腺、外阴及阴道复发,手术+化疗 | 22 | 死亡 |
| AML,急性髓系白血病;IA方案,去甲氧柔红霉素+阿糖胞苷;DA方案,柔红霉素+阿糖胞苷;TP方案,紫杉醇+顺铂;HA方案,高三尖杉酯碱+阿糖胞苷;E-CHOP方案,环磷酰胺+长春新碱+表阿霉素+依托泊苷;CHEP方案,环磷酰胺+阿霉素+依托泊苷;MA方案,米托蒽醌+阿糖胞苷;*,本文病例. | ||||||||
3 讨论
MS曾被称为“绿色瘤”“GS”等,2001年WHO淋巴造血系统肿瘤分类中将其命名为MS,并于2008年将其归类为急性髓系白血病(acute myelocytic leukemia,AML) 的一个亚型。MS约占AML患者的2.5%~9.11%[24],其常见发生部位为皮肤、骨及淋巴结,内脏软组织[25]。继发或与血液病同时发生的MS称为白血病性MS。仅表现为局部孤立性肿块、无血液病证据,且在确诊后30 d内未发展为AML的MS为原发或孤立性髓系肉瘤(isolated myeloid sarcoma,IMS),此类患者往往在MS发生数周、数月甚至数年后,出现AML。本研究中27例患者平均发病年龄40.2岁,85.2%表现为阴道出血,仅6例为白血病性GS。妇科查体可见增粗的宫颈,表面光滑或菜花样,大部分呈灰白色,少数典型病例成绿色,系因肿瘤细胞内含有较多MPO,暴露于空气中易被氧化所致。
诊断需结合病史、查体、影像及组织学检查等。对于已明确血液病史的患者,如发生髓外肿块,容易想到MS,但IMS的诊断常较困难。本文报道的1例属于IMS。GS由原始粒细胞、中性粒细胞和粒系前体细胞组成。镜下表现有时与淋巴瘤类似。免疫组化对MS的诊断及鉴别诊断具有重要意义,常见的免疫组化标志物有: CD68/KP1、MPO、CD117、CD99、CD68/PG-M1、溶菌酶、CD34、TdT、CD56和CD30等[26]。其中,MPO被认为是MS的特异性标志,但与肿瘤分化程度有关,分化低可阴性。同时,作为T和B细胞的标志,若CD20和CD3阴性,可进一步与淋巴瘤鉴别。CT、MR对MS的诊断均有一定价值,PET-CT对于MS的早期发现及肿瘤负荷评估具有重要价值[25]。此外,部分患者存在细胞遗传学异常及基因突变[27-28]。
目前MS的治疗方法主要包括全身化疗、局部治疗、造血干细胞移植、分子靶向及免疫治疗[29],尚无统一规范。LEE等[30]指出早期采用多模式方法进行正确、快速诊断并开始强化联合治疗可能是降低IMS随后发展为AML风险的最佳策略。虽然对IMS的治疗没有一致意见,但几乎总是采用AML诱导方案治疗,即蒽环类联合阿糖胞苷为基础的化疗。本文共24例行全身化疗,部分患者同时联合手术或放疗等其他治疗。此外,文献报道异基因造血干细胞移植是MS获得长期生存的重要手段之一,回顾性研究[28]显示出良好的治疗结果,甚至鼓励首次诱导缓解后行同种异体骨髓移植。宫颈MS预后差,至随访结束,仅63.0%的患者生存,死亡患者中80%于发病2年内死亡。本文报道病例经化疗及手术等获得了22个月的生存期,但遗憾的是,并未行细胞遗传学分析及骨髓移植治疗。
综上,宫颈MS是罕见的发生于女性生殖系统的血液系统恶性肿瘤,虽然其为局部病灶,但被视为全身疾病的局部表现,其治疗不同于宫颈鳞癌的手术或放疗,而是以全身化疗为主。由于临床少见,对其治疗、预后的认识尚浅,仍有待进一步研究。
| [1] |
姜青明, 卢萍, 周文文, 等. 6例髓系肉瘤的临床病理分析[J]. 临床肿瘤学杂志, 2015, 20(4): 351-356. |
| [2] |
李咏, 何爱琴, 陆云燕, 等. 宫颈粒细胞肉瘤1例报告[J]. 中国实用妇科与产科杂志, 2010, 26(8): 643-644. |
| [3] |
顾天英, 石麒麟. 宫颈粒细胞肉瘤临床病理分析[J]. 浙江实用医学, 2011, 16(4): 282-283, 316. DOI:10.3969/j.issn.1007-3299.2011.04.022 |
| [4] |
吴铃, 何杰. 宫颈粒细胞肉瘤临床病理学分析[J]. 医学信息, 2014, 27(12): 23. |
| [5] |
刘秋雨, 史玉洁, 贺慧, 等. 宫颈粒细胞肉瘤临床病理研究[J]. 肿瘤基础与临床, 2013, 26(6): 471-475. DOI:10.3969/j.issn.1673-5412.2.13.06.004 |
| [6] |
郑高锋, 郑伟燕, 孙洁, 等. 宫颈原发粒细胞肉瘤一例[C]. 2009年浙江省血液病学学术年会论文集. 浙江省医学会血液病学分会: 浙江省科学技术协会, 2009: 225-226.
|
| [7] |
王颖, 周怡, 罗琳, 等. 宫颈原发性粒细胞肉瘤: 病例报告并文献复习[J]. 武汉大学学报(医学版), 2014, 35(4): 628-631. |
| [8] |
彭剑峰, 王虹壬, 王娟婷, 等. 宫颈原发性粒细胞肉瘤的MRI诊断及文献复习[J]. 国际医学放射学杂志, 2019, 42(4): 470-473. DOI:10.19300/j.2019.L6641 |
| [9] |
佐晶, 程敏, 李卓, 等. 宫颈原发造血系统肿瘤临床病理分析及文献复习[J]. 癌症进展, 2016, 14(5): 444-448. DOI:10.11877/j.issn.1672-1535.2016.14.05.12 |
| [10] |
张晓妮, 蔡艳青. 急性粒细胞白血病部分分化型并发宫颈粒细胞肉瘤1例报告[J]. 中国实用乡村医生杂志, 2013, 20(8): 59-60. DOI:10.3969/j.issn.1672-7185.2013.08.028 |
| [11] |
李丹, 杨向红, 常筱颖. 女性生殖道髓系肉瘤临床及病理分析[J]. 中国医科大学学报, 2010, 39(11): 965-966. |
| [12] |
江亚军, 王红霞, 庄万传, 等. 髓系肉瘤的临床和病理特征[J]. 中国实验血液学杂志, 2017, 25(3): 926-931. DOI:10.7534/j.issn.1009-2137.2017.03.052 |
| [13] |
江文辉, 陈燕坪, 许春伟, 等. 髓系肉瘤临床病理分析[J]. 临床与病理杂志, 2017, 37(10): 2118-2124. DOI:10.3978/j.issn.2095-6959.2017.10.017 |
| [14] |
冯海利, 侯亮, 何利兵, 等. 原发性宫颈粒细胞肉瘤临床病理观察[J]. 诊断病理学杂志, 2017, 24(4): 267-269. DOI:10.3969/j.issn.1007-8096.2017.04.008 |
| [15] |
于晓红, 叶璐. 子宫颈粒细胞肉瘤1例[J]. 临床与实验病理学杂志, 2013, 29(1): 116-118. DOI:10.3969/j.issn.1001-7399.2013.01.039 |
| [16] |
GILL H, LOONG F, MAK V, et al. Myeloid sarcoma of the uterine cervix presenting as missed abortion[J]. Arch Gynecol Obstet, 2012, 286(5): 1339-1341. DOI:10.1007/s00404-012-2454-8 |
| [17] |
ABU SAADEH F, COLLINS V, AL-SAADI M, et al. An unusual relapse in acute myeloid leukaemia[J]. BMJ Case Rep, 2015, 2015: bcr2014207395. DOI: 10.1136/bcr-2014-207395.
|
| [18] |
MISHRA K, MURALIDARAN C, JANDIAL A, et al. Uterine mass and menorrhagia: a rare presentation of acute myeloid leukemia with arduous clinical course[J]. Balkan Med J, 2018, 35(3): 282-284. DOI:10.4274/balkanmedj.2017.0941 |
| [19] |
UCAR M, GURYILDIRIM M. Granulocytic sarcoma of the uterus: a rare presentation of extramedullary relapse of AML and importance of MRI[J]. Case Rep Radiol, 2014, 2014: 1-4. DOI:10.1155/2014/501342 |
| [20] |
WEINGERTNER AS, WILT M, ATALLAH I, et al. Myeloid sarcoma of the uterine cervix as presentation of acute myeloid leukaemia after treatment with low-dose radioiodine for thyroid cancer: a case report and review of the literature[J]. Case Rep Oncol, 2009, 2(1): 1-6. DOI:10.1159/000191215 |
| [21] |
KIM SCH, NATARAJAN-AME S, LIOURE B, et al. Successful treatment of a granulocytic sarcoma of the uterine cervix in complete remission at six-year follow-up[J]. J Oncol, 2010, 2010: 1-3. DOI:10.1155/2010/812424 |
| [22] |
GUI W, LI J, ZHANG Z, et al. Primary hematological malignancy of the uterine cervix: a case report[J]. Oncol Lett, 2019, 18(3): 3337-3341. DOI:10.3892/ol.2019.10652 |
| [23] |
CHIANG YC, CHEN CH. Cervical granulocytic sarcoma: report of one case and review of the literature[J]. Eur J Gynaecol Oncol, 2010, 31(6): 697-700. |
| [24] |
MAGDY M, ABDEL KARIM N, ELDESSOUKI I, et al. Myeloid sarcoma[J]. Oncol Res Treat, 2019, 42(4): 224-229. DOI:10.1159/000497210 |
| [25] |
MEYER HJ, PÖNISCH W, SCHMIDT SA, et al. Clinical and imaging features of myeloid sarcoma: a German multicenter study[J]. BMC Cancer, 2019, 19(1): 1150. DOI:10.1186/s12885-019-6357-y |
| [26] |
AVNI B, KOREN-MICHOWITZ M. Myeloid sarcoma: current approach and therapeutic options[J]. Ther Adv Hematol, 2011, 2(5): 309-316. DOI:10.1177/2040620711410774 |
| [27] |
KAWAMOTO K, MIYOSHI H, YOSHIDA N, et al. Clinicopathological, cytogenetic, and prognostic analysis of 131 myeloid sarcoma patients[J]. Am J Surg Pathol, 2016, 40(11): 1473-1483. DOI:10.1097/pas.0000000000000727 |
| [28] |
KAUR V, SWAMI A, ALAPAT D, et al. Clinical characteristics, molecular profile and outcomes of myeloid sarcoma: a single institution experience over 13 years[J]. Hematology, 2018, 23(1): 17-24. DOI:10.1080/10245332.2017.1333275 |
| [29] |
ALMOND LM, CHARALAMPAKIS M, FORD SJ, et al. Myeloid sarcoma: presentation, diagnosis, and treatment[J]. Clin Lymphoma Myeloma Leuk, 2017, 17(5): 263-267. DOI:10.1016/j.clml.2017.02.027 |
| [30] |
LEE JY, CHUNG H, CHO H, et al. Clinical characteristics and treatment outcomes of isolated myeloid sarcoma without bone marrow involvement: a single-institution experience[J]. Blood Res, 2017, 52(3): 184-192. DOI:10.5045/br.2017.52.3.184 |
 2021, Vol. 50
2021, Vol. 50




