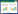文章信息
- 张文娟, 谭昭, 蔡如佳, 关宁, 高秀秋, 王琳源
- ZHANG Wenjuan, TAN Zhao, CAI Rujia, GUAN Ning, GAO Xiuqiu, WANG Linyuan
- 调节性T细胞在慢性牙周炎小鼠模型中的作用
- Role of regulatory T cells in mice with chronic periodontitis
- 中国医科大学学报, 2021, 50(2): 135-140
- Journal of China Medical University, 2021, 50(2): 135-140
-
文章历史
- 收稿日期:2020-04-27
- 网络出版时间:2021-01-13 16:13
2. 锦州医科大学附属第一医院脑与脊髓损伤重点实验室, 辽宁 锦州 121000
2. The Key Laboratory of Brain and Spinal Cord Injury Research, The First Affiliated Hospital of Jinzhou Medical University, Jinzhou 121000, China
牙周炎是由牙周菌斑微生物引发的牙周支持组织破坏的慢性感染性疾病。虽然菌斑生物膜是牙周炎发生的始动因子,但宿主对牙周病原菌的免疫应答是牙周组织破坏程度的决定性因素[1]。调节性T细胞(regulatory T cell,Treg)是CD4+ T细胞的独特亚群,具有免疫抑制活性,通过抑制自身免疫和调节免疫应答防止炎症损伤。研究[2]发现,牙周炎中Treg细胞数量增加,其相关因子白细胞介素-10(interleukin 10,IL-10)、转化生长因子-β(transforming growth factor-β,TGF-β)表达升高,提示Treg细胞参与牙周炎的发病过程。然而,国内关于Treg细胞在慢性牙周炎中具体作用的研究较少。本研究通过抑制小鼠Treg细胞功能,探讨Treg细胞在慢性牙周炎小鼠中的作用。
1 材料与方法 1.1 实验菌株和动物牙龈卟啉单胞菌(Porphyromonas gingivalis,P. gingivalis)W83由中国医科大学口腔医学院潘亚萍教授惠赠。SPF级C57BL/6小鼠16只,7周龄,雌性,购于锦州医科大学实验动物中心。本研究通过锦州医科大学动物伦理委员会审核批准。
1.2 主要仪器与试剂脑心浸萃液态培养基(中国Solarbio公司);氯化血红素、羧甲基纤维素(美国Sigma公司);体内抗小鼠糖皮质激素诱导的肿瘤坏死因子受体(glucocorticoid-induced tumor necrosis factor receptor,GITR)单克隆抗体、同型对照抗体IgG(美国BioXcell公司);TRizol、实时PCR试剂盒(中国Vazyme公司);IL-10、TGF-β1、叉头翼螺旋转录分子(forkhead box P3,Foxp3)引物合成(中国鼎国昌盛公司);实时PCR仪、高速低温冷冻离心机(美国Thermo公司);实体显微镜(日本Olympus公司);FITC标记的CD4、PE标记的Foxp3抗小鼠的单克隆抗体(美国BIOLEGEND公司);流式细胞仪(美国BD公司);厌氧培养箱(日本SANYO公司)。
1.3 方法 1.3.1 实验菌株培养P. gingivalis W83接种于BHI血琼脂培养基(含5%羊血、1%氯化血红素、0.1%维生素K1)培养5~7 d,刮取菌落,重悬至BHI液体培养基内,培养24 h后,收集培养的P. gingivalis W83。调整菌密度为1×109/mL,重悬于含2%羧甲基纤维素钠的磷酸盐缓冲液中。
1.3.2 实验分组和处理将16只小鼠随机分为4组,Sham组、P. gingivalis组、IgG组、anti-GITR组,每组4只。P. gingivalis组、IgG组、anti-GITR组用移液器将100 µL菌液涂布于小鼠口腔,连续涂7 d,建立牙周炎动物模型,Sham组以相同体积含2%羧甲基纤维素钠的磷酸盐缓冲液涂抹于小鼠口腔。IgG组小鼠腹腔注射IgG同型抗体(每只小鼠100 µg)作为对照。anti-GITR组小鼠腹腔注射纯化的抗小鼠GITR单克隆抗体(每只小鼠100 µg)。注射时间间隔3~4 d,共4次。所有小鼠于P. gingivalis W83感染后第45天处死取材。
1.3.3 牙龈指数和牙齿松动度评定用牙周探诊探查牙龈情况,从牙龈炎症、水肿、出血等方面进行牙龈指数评定;按松动方向进行牙齿松动度评定[3]。
1.3.4 牙槽骨吸收评价取右上颌骨,去除软组织,3%过氧化氢浸泡6 h,沸水煮5 min,去净剩余软组织,0.1%亚甲蓝染色,在体视显微镜下测量上颌第一磨牙至第三磨牙从釉牙骨质界(cemento-enamel junction,CEJ)到牙槽嵴顶(alveolar bone crest,ABC)的距离,每颗牙测量颊侧和腭侧的近中、远中共4个位点,取3颗牙12个位点的均值。
1.3.5 HE染色观察牙周组织病理损伤情况取左侧上颌骨的磨牙段,磷酸盐缓冲液清洗后用4%多聚甲醛固定48 h,放入10%中性EDTA中脱钙,梯度脱水、透明、包埋,制成近远中向石蜡切片(5 µm),HE染色。光学显微镜下观察牙周组织情况。
1.3.6 牙周组织中Treg细胞检测参照KOBAYASHI等[4]的方法制备牙周组织单个核细胞悬液,将细胞悬液以5×105/mL的密度分别加入流式管并根据组别进行编号,设置空白对照管。加入FITC标记的CD4抗体。4 ℃避光染色30 min。固定、破膜后加入PE标记的Foxp3抗体,4 ℃避光孵育30 min。加入含1%胎牛血清的磷酸盐缓冲液洗涤2次后重悬,上机检测。采用FlowJo10.4软件分析CD4+Foxp3+(Treg)细胞。
1.3.7 实时PCR检测根据TRIzol试剂盒说明书操作,提取总RNA。用紫外分光光度计测RNA浓度和吸光度(optical density,OD)值,取OD260 nm/OD280 nm比值在1.8~2.0为实验样本。按逆转录试剂盒说明书将总RNA逆转录为cDNA进行扩增,实时PCR反应的总体系为20 μL。IL-10引物序列:上游5’-CCTCGTTTGTACCTCTCTCCG-3’,下游5’-AGGACACCATAGCAAAGGGC-3’;TGF-β1引物序列:上游5’-AGCTGCGCTTGCAGAGATTA-3’,下游5’-AGCCCTGTATTCCGTCTCCT-3’;Foxp3引物序列:上游5’-CCCATCCCCAGGAGTCTTG-3’,下游5’-ACCATGACTAGGGGCACTGTA-3’;β-actin引物序列:上游5’-GGCTGTATTCCCCTCCATCG-3’,下游5’-CCAGTTGGTAACAATGCCATGT-3’。反应条件:第一阶段预变性95 ℃ 30 s;第二阶段循环反应95 ℃ 5 s,60 ℃ 30 s,40个循环;第三阶段溶解曲线95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。每个样本做3个平行孔,采用公式2-ΔΔCt计算目的基因的相对表达量。
1.4 统计学分析采用SPSS 22.0软件对数据进行统计学分析,符合正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,两两比较采用q检验,P < 0.05为差异有统计学意义。
2 结果 2.1 各组小鼠牙龈指数和牙齿松动度Sham组小鼠牙龈颜色粉红,无探针出血,无组织水肿;牙齿不松动。P. gingivalis组和IgG组小鼠牙龈略红肿,个别探诊出血;牙齿颊腭侧松动,少数伴近远中松动。P. gingivalis组和IgG组与Sham组相比,牙龈指数、牙齿松动度的差异均有统计学意义(P < 0.05)。anti-GITR组小鼠牙龈红肿,探诊出血;牙齿中重度度松动。anti-GITR组牙龈指数、牙齿松动度明显大于P. gingivalis组和IgG组(P < 0.05)。P. gingivalis组与IgG组比较,牙龈指数、牙齿松动度的差异无统计学意义(P > 0.05)。见表 1。
| Group | n | Gingival index | Tooth mobility |
| Sham | 4 | 0.33±0.27 | 0.00±0.00 |
| P. gingivalis | 4 | 1.42±0.171) | 1.58±0.171) |
| IgG | 4 | 1.33±0.271) | 1.50±0.191) |
| anti-GITR | 4 | 2.12±0.192),3) | 2.42±0.172),3) |
| 1) P < 0.05 vs Sham group;2) P < 0.05 vs P. gingivalis group;3) P < 0.05 vs IgG group. | |||
2.2 牙槽骨吸收评价
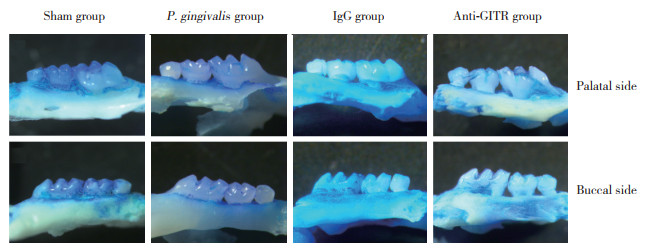
与Sham组相比,P. gingivalis组、IgG组和anti-GITR组小鼠ABC高度降低,CEJ-ABC距离增大,差异有统计学意义(P < 0.01)。且anti-GITR组CEJ-ABC距离大于P. gingivalis组和IgG组,差异有统计学意义(P < 0.05)。见图 1、2。
|
| 图 1 牙槽骨形态 ×32 Fig.1 Alveolar bone morphology ×32 |
|
| *, P < 0.05;**, P < 0.01. 图 2 牙槽骨吸收分析 Fig.2 Analysis of alveolar bone resorption |
2.3 牙周组织病理检查
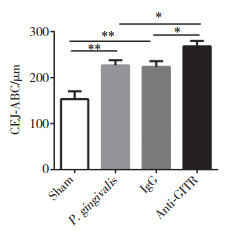
Sham组小鼠结合上皮完整,附着于CEJ处,牙周膜胶原纤维排列整齐。P. gingivalis组、IgG组小鼠结合上皮向根方增殖破坏,牙周膜胶原纤维排列紊乱,溶解,变性,固有层大量炎症细胞浸润,牙槽骨嵴顶吸收,破骨细胞和骨吸收陷窝形成。anti-GITR组结合上皮与牙面分离,下方的胶原纤维断裂、丧失,大部分被炎症细胞取代,ABC处骨吸收明显,牙槽骨出现活跃的破骨性骨吸收陷窝。见图 3。
|
| A, Sham group; B, P. gingivalis group; C, IgG group; D, anti-GITR group. 图 3 HE染色观察牙周组织形态 ×100 Fig.3 Periodontal histomorphology observed by HE staining ×100 |
2.4 流式细胞仪分析Treg细胞
P. gingivalis组和IgG组牙龈组织中CD4+ Foxp3+(Treg)细胞比例和细胞数量均高于Sham组,差异均有统计学意义(P < 0.05);anti-GITR组CD4+ Foxp3+(Treg)细胞比例和细胞数量低于P. gingivalis组和IgG组,差异均有统计学意义(P < 0.05)。P. gingivalis组和IgG组CD4+ Foxp3+(Treg)细胞比例和细胞数量的差异均无统计学意义(P > 0.05)。见图 4。
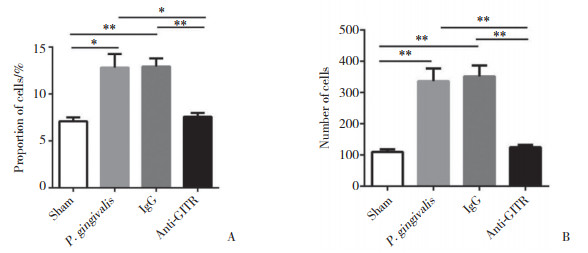
|
| A, proportion of CD4+ Foxp3+ (Treg) cells among CD4+ T cells; B, numbers of CD4+ Foxp3+ (Treg) cells. *, P < 0.05;**, P < 0.01. 图 4 流式细胞仪分析牙龈组织中Treg细胞 Fig.4 Flow cytometry analysis of Treg cells in gingival tissue |
2.5 实时PCR检测
与Sham相比,P. gingivalis组和IgG组小鼠牙龈组织IL-10、TGF-β1、Foxp3 mRNA表达水平明显增高,差异有统计学意义(P < 0.05)。anti-GITR组牙龈组织中IL-10、TGF-β1、Foxp3 mRNA表达水平明显低于P. gingivalis组和IgG组,差异有统计学意义(P < 0.05)。P. gingivalis组和IgG组比较,IL-10、TGF-β1、Foxp3 mRNA表达的差异无统计学意义(P > 0.05)。见图 5。

|
| *, P < 0.05;**, P < 0.01. 图 5 实时PCR检测IL-10、TGF-β1、Foxp3 mRNA的表达 Fig.5 Expression of IL-10, TGF-β1, and Foxp3 mRNA detected by real-time PCR |
3 讨论
慢性牙周炎是口腔临床常见疾病,是导致成人牙齿缺失的主要原因。P. gingivalis是慢性牙周炎病变区域的主要优势菌。随着对牙周炎发病机制的深入研究,发现牙周炎的组织病损主要是由宿主对感染的免疫应答(先天性免疫应答和获得性免疫应答)引起的。CD4+ T细胞是牙周炎免疫应答的重要细胞类型,包括辅助性T细胞(T-helper cell,Th)1、Th2、Th17以及Treg等[5]。
Treg细胞作为一类CD4+ T亚群,表面高表达白细胞介素-2受体α链(CD25)、GITR、细胞毒T淋巴细胞相关抗原4等分子,特征性的表达转录因子Foxp3[6],通过分泌TGF-β、IL-10等抑炎性细胞因子和细胞间直接接触的方式参与免疫反应,发挥免疫抑制作用,维持免疫稳态[7]。BOZEC等[8]对人和小鼠进行体外研究,发现Treg细胞通过分泌TGF-β、IL-4、IL-10以及细胞表面分子细胞毒T淋巴细胞相关抗原4,与破骨细胞中CD80/86受体相互作用,抑制单核细胞/巨噬细胞向破骨细胞的分化。研究[9]发现,在慢性牙周炎的病损破坏期Treg细胞数量减少,在病损修复期病变牙龈组织中Treg细胞数量增多,表明Treg细胞参与慢性牙周炎的发病过程。与上述报道一致,本研究发现,慢性牙周炎小鼠的病变牙周组织中Treg细胞比例和数量增多,相关因子IL-10、TGF-β1、Foxp3表达上调,表明Treg细胞介导的免疫应答参与慢性牙周炎的炎症调控。虽然在慢性牙周炎中Treg细胞相关因子表达上调,但仍出现牙周膜胶原纤维的溶解破坏,固有层炎症细胞浸润,牙槽骨嵴顶吸收,其原因可能是Treg细胞分泌的相关抑炎性细胞因子的效能不足以抵抗炎症导致的组织破坏,导致牙周炎的炎症进展。
GITR是肿瘤坏死家族受体超家族的成员,T淋巴细胞的共刺激分子,高表达于Treg细胞表面[10],抗原递呈细胞和内皮细胞表面的GITRL与GITR结合后,GITR活化并通过招募TRAF蛋白到其胞浆尾部来介导细胞内信号转导。在IL-2和抗CD3抗体存在的条件下,加入GITRL-Fc融合蛋白促进Treg细胞的增殖[11]。SHIMIZU等[12]的体外研究发现,anti-GITR能够以剂量依赖方式抑制Treg细胞的功能。将anti-GITR和兔补体处理的BALB/c nu/+脾细胞悬液过继回输到BALB/c nu/nu小鼠体内后,会导致小鼠自身免疫性疾病的发生。PATEL等[13]发现,体内给予GITR抗体后,实验性关节炎小鼠的关节区炎症细胞浸润增加,骨破坏加重。以上研究表明,GITR在Treg细胞增殖和功能发挥中发挥重要作用。本研究发现,应用GITR抗体抑制Treg细胞功能后,P. gingivalis感染小鼠的病变牙周组织中Treg细胞比例和细胞数量减少,相关因子IL-10、TGF-β1、Foxp3表达降低,骨吸收加剧,炎性浸润增加,表明Treg细胞在慢性牙周炎的发病过程中,参与抑制炎症反应并促进牙周组织的修复。
综上所述,Treg细胞介导的免疫应答在慢性牙周炎中参与维持牙周组织稳态。在微环境中,Treg细胞效能不足可能导致了炎症的进展。了解Treg细胞在牙周炎中的作用,有助于从免疫调控的角度探寻治疗慢性牙周炎的途径。值得注意的是,牙周炎的发病过程是动态可变的,Treg细胞作为免疫调节细胞,在牙周微环境中通过与多种细胞的相互作用影响病变的进程,其具体病理作用机制还有待于进一步的研究。
| [1] |
PAN W, WANG Q, CHEN Q. The cytokine network involved in the host immune response to periodontitis[J]. Int J Oral Sci, 2019, 11(3): 30. DOI:10.1038/s41368-019-0064-z |
| [2] |
GAO L, ZHAO Y, WANG P, et al. Detection of Th17/Treg cells and related factors in gingival tissues and peripheral blood of rats with experimental periodontitis[J]. Iran J Basic Med Sci, 2017, 20(3): 294-300. DOI:10.22038/ijbms.2017.8359 |
| [3] |
KIM S, CHOI SI, KIM GH, et al. Anti-inflammatory effect of Ecklonia cava extract on Porphyromonas gingivalis lipopolysaccharide-stimulated macrophages and a periodontitis rat model[J]. Nutrients, 2019, 11(5): 1143. DOI:10.3390/nu11051143 |
| [4] |
KOBAYASHI R, KONO T, BOLERJACK BA, et al. Induction of IL-10-producing CD4+ T-cells in chronic periodontitis[J]. J Dent Res, 2011, 90(5): 653-658. DOI:10.1177/0022034510397838 |
| [5] |
王敏, 葛颂. 牙周炎CD4+ T细胞应答的研究进展[J]. 临床口腔医学杂志, 2019, 35(9): 572-574. DOI:10.3969/j.issn.1003-1634.2019.09.019 |
| [6] |
ALVAREZ C, ROJAS C, ROJAS L, et al. Regulatory T lymphocytes in periodontitis:a translational view[J]. Mediators Inflamm, 2018, 2018: 7806912. DOI:10.1155/2018/7806912 |
| [7] |
HE L, ZHOU S, QI Q, et al. The regulation of regulation:interleukin-10 increases CD4+ CD25+ regulatory T cells but impairs their immunosuppressive activity in murine models with schistosomiasis japonica or asthma[J]. Immunology, 2018, 153(1): 84-96. DOI:10.1111/imm.12813 |
| [8] |
BOZEC A, ZAISS MM. T regulatory cells in bone remodeling[J]. Curr Osteoporos Rep, 2017, 15(3): 121-125. DOI:10.1007/s11914-017-0356-1 |
| [9] |
GARLET GP, CARDOSO CR, MARIANO FS, et al. Regulatory T cells attenuate experimental periodontitis progression in mice[J]. J Clin Periodontol, 2010, 37(7): 591-600. DOI:10.1111/j.1600-051x.2010.01586.x |
| [10] |
MAHNE AE, MAUZE S, JOYCE-SHAIKH B, et al. Dual roles for regulatory T-cell depletion and costimulatory signaling in agonistic GITR targeting for tumor immunotherapy[J]. Cancer Res, 2017, 77(5): 1108-1118. DOI:10.1158/0008-5472.CAN-16-0797 |
| [11] |
RONCHETTI S, RICCI E, PETRILLO MG, et al. Glucocorticoid-induced tumour necrosis factor receptor-related protein:a key marker of functional regulatory T cells[J]. J Immunol Res, 2015, 2015: 1-17. DOI:10.1155/2015/171520 |
| [12] |
SHIMIZU J, YAMAZAKI S, TAKAHASHI T, et al. Stimulation of CD25+ CD4+ regulatory T cells through GITR breaks immunological self-tolerance[J]. Nat Immunol, 2002, 3(2): 135-142. DOI:10.1038/ni759 |
| [13] |
PATEL M, XU D, KEWIN P, et al. Glucocorticoid-induced TNFR family-related protein (GITR) activation exacerbates murine asthma and collagen-induced arthritis[J]. Eur J Immunol, 2005, 35(12): 3581-3590. DOI:10.1002/eji.200535421 |
 2021, Vol. 50
2021, Vol. 50