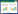文章信息
- 张岚, 刘法昱, 吴楠
- ZHANG Lan, LIU Fayu, WU Nan
- PRDM15表达水平与头颈鳞状细胞癌预后的关系
- Relationship between the expression of zinc finger protein transcription inhibitor and prognosis of head and neck squamous cell carcinoma
- 中国医科大学学报, 2021, 50(2): 108-111
- Journal of China Medical University, 2021, 50(2): 108-111
-
文章历史
- 收稿日期:2020-04-13
- 网络出版时间:2021-01-13 15:56
2. 中国医科大学口腔医学院·附属口腔医院, 辽宁省口腔疾病重点实验室口腔颌面外科, 沈阳 110002
2. Department of Oral and Maxillofacial Surgery, School and Hospital of Stomatology, China Medical University, Liaoning Provincial Key Laboratory of Oral Diseases, Shenyang 110002, China
PRDM家族蛋白广泛存在于啮齿动物、灵长类、鸟类和两栖动物体内。其中一部分能够影响表观遗传,其蛋白锌指结构可以识别DNA、RNA和蛋白;另一部分PRDM家族成员可以影响原始生殖细胞特化、癌症发生、造血、神经系统发育等[1-2]。
据文献[3]报道,PRDM在灵长类中包含17个成员,在啮齿动物、鸟类、两栖动物中有16个,而在真菌与植物中未被检测到。同时,这些成员各不相同[4]。最近的研究[5-7]发现,沉默PRDM14基因可以抑制乳腺癌的发生和转移;PRDM13可以通过某种机制发挥抑癌作用;PRDM16会影响癌症的发生。PRDM15通过转录调控WNT和MAPK-ERK信号维护小鼠胚胎干细胞初始状态。然而,PRDM15在肿瘤中的作用机制尚不明确,因此,本研究拟探讨PRDM15在头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)中的表达及其对HNSCC患者临床预后的影响,旨在为深入研究其在HNSCC发生发展、侵袭转移中的作用和寻找精确、高效的生物标志物提供理论基础。
1 材料与方法 1.1 材料100例标本均来自2014年至2015年于中国医科大学附属口腔医院进行手术并经病理确诊为HNSCC的患者。其中,男58例,女42例;年龄范围32~70岁。病灶和正常组织均保存完整,癌旁组织为距癌灶3 cm外且无癌细胞浸润的组织。将HNSCC组织设为C组,癌旁组织设为N组。
1.2 免疫组化染色根据染色强度和所观察到阳性细胞数量按照百分比计算分数。判别阳性细胞的标志为切片中细胞核染色深浅,从淡黄至棕褐色且以大多数细胞呈现的颜色为准计分。无颜色、淡黄色、棕黄色、棕褐色分别计为0分、1分、2分和3分。某类细胞的5个视野内阳性细胞的平均数量即为阳性细胞百分比。0~5%、> 5%~25%、> 25%~50%、> 50%~75%、> 75%分别计为0分、1分、2分、3分和4分,每张切片随机取5个400倍视野,每个视野均进行染色强度与阳性细胞百分比的乘积。评分为0分、1~4分、5~8分、9~12分依次计为阴性(-)、弱阳性(+)、中度阳性(++)和强阳性(+++)。
1.3 Western blotting检测用冷PBS清洗新鲜组织标本3次,去除血细胞。放入500 μL冷RIPA裂解液,用剪刀将组织剪碎,置于冰上研磨并静置20 min后,4 ℃,12 000 g离心20 min。吸上清,去除沉淀。取上清,利用考马斯亮蓝测定法测定蛋白质含量,取30 μg总蛋白在10%SDS聚丙烯酰胺凝胶上进行分离。将硝酸纤维素膜在转移溶液中平衡10 min并用TTBS洗涤3次,每次持续5 min,转膜,在含有5%脱脂牛奶中常温封闭2 h,并在4 ℃下用anti-PRDM15或者anti-GAPDH孵育过夜,TBST清洗膜,室温下二抗孵育1 h。ECL底物发光检测蛋白表达。用image J软件对蛋白表达条带光密度值进行测量分析。
1.4 统计学分析采用SPSS 19.0软件进行统计分析。组间差异比较应用Two-tailed Student’s t检验。组间比较采用配对t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 HNSCC组织中PRDM15蛋白的表达水平采用Western blotting检测20例HNSCC患者癌旁和癌组织中PRDM15蛋白的表达水平,结果显示,有9例癌组织中PRDM15蛋白表达高于癌旁组织,采用image J分析PRDM15和GAPDH蛋白条带的灰度值,校正后进行统计分析,差异有统计学意义(P < 0.01)。见图 1。
|
| N, adjacent tissue; C, cancerous tissue. 图 1 PRDM15蛋白在HNSCC组织中的表达 Fig.1 PRDM15 protein expression in HNSCC |
2.2 HNSCC癌中PRDM15的表达与定位
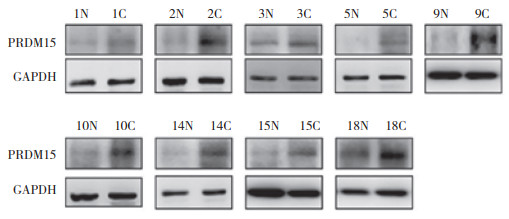
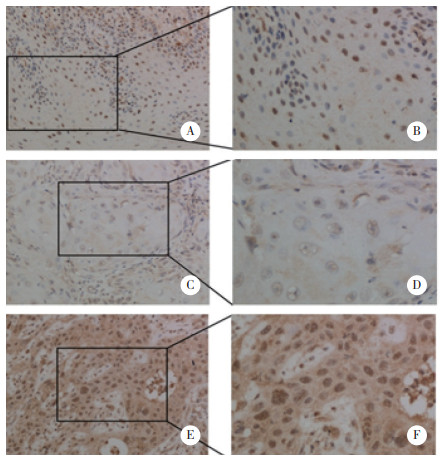
应用免疫组化对100例HNSCC患者的癌旁及癌组织中PRDM15的表达及定位进行检测。PRDM15在HNSCC患者的癌旁组织中表达为阴性,在癌组织中高表达,主要表达于细胞核,在细胞质中有少量表达,见图 2。graphpad统计分析结果表明,PRDM15在癌组织中的表达水平明显高于癌旁组织,差异有统计学意义(P < 0.05),见图 3。
|
| A and B, tissues adjacent to squamous cell carcinoma; C and D, HNSCC tissues with low PRDM15 expression; E and F, HNSCC tissues with high PRDM15 expression. A, C, E, ×100;B, D, F, × 200. 图 2 免疫组化检测HNSCC组织中PRDM15的表达和定位 Fig.2 Immunohistochemical analysis of the expression and localization of PRDM15 in HNSCC |
|
| *P < 0.05. 图 3 HNSCC组织中PRDM15的表达情况 Fig.3 PRDM15 expression in HNSCC tissues |
2.3 PRDM15在HNSCC中的表达水平与预后的关系
根据免疫组化半定量分析方法,将47例PRDM15弱阳性病例归为低表达组,将53例PRDM15中度阳性和强阳性病例归为PRDM15高表达组。生存曲线分析显示,PRDM15高表达的HNSCC患者生存时间与PRDM15低表达的患者相比明显缩短(P = 0.017),提示PRDM15可能是患者预后生存的重要生物学标志物。见图 4。
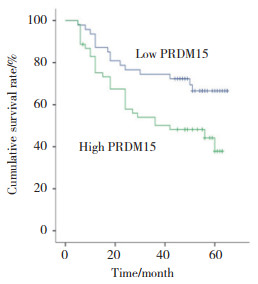
|
| 图 4 生存曲线分析 Fig.4 Survival curve analysis |
3 讨论
HNSCC在头颈部恶性肿瘤中最为常见,每年全世界病例在50万~60万以上,由此导致的死亡人数超过37万[8]。HNSCC肿瘤细胞侵袭能力较强,临床上常见复发与转移。虽然相关的诊断及治疗方法不断进步,但35%~55%的HNSCC患者在确诊后2年内会出现局部复发及远处转移,其5年生存率为34%~68%[9-11]。
有文献[12-14]报道,PRDM家族是调控表观遗传的蛋白,其家族成员的功能不尽相同,其中PRDM13、PRDM14、PRDM16与肿瘤的发生发展相关。PRDM15作为MAPK-ERK和WNT通路的转录调控因子,调节其信号上游因子的转录,从而保护胚胎干细胞的多能性[7]。Western blotting检测结果显示,PRDM15在癌组织中表达水平明显高于癌旁组织,差异有统计学意义。说明PRDM15可能与HNSCC的恶性增殖或肿瘤的形成有关,参与调节肿瘤生物学行为及恶性转化。生存曲线分析结果显示,与PRDM15低表达的HNSCC患者相比,PRDM15表达增高的HNSCC患者生存时间明显缩短。
本研究首次发现PRDM15在HNSCC中表达明显增高,高表达PRDM15的HNSCC患者生存时间明显短于低表达患者。为后续对PRDM15在HNSCC发生、发展及其在肿瘤增殖和侵袭转移中作用机制的深入研究提供了理论依据,并为实现HNSCC的精准诊疗提供了新的治疗靶点。
综上,PRDM15可能是HNSCC患者组织细胞中的关键致病性癌基因,其表达水平与肿瘤的状态息息相关,有可能成为HNSCC患者的一个新的预后和治疗的生物标志物。
| [1] |
FOG CK, GALLI GG, LUND AH. PRDM proteins:important players in differentiation and disease[J]. Bioessays, 2012, 34(1): 50-60. DOI:10.1002/bies.201100107 |
| [2] |
QIAN C, ZHOU MM. SET domain protein lysine methyltransferases:structure, specificity and catalysis[J]. Cell Mol Life Sci, 2006, 63(23): 2755-2763. DOI:10.1007/s00018-006-6274-5 |
| [3] |
FUMASONI I, MEANI N, RAMBALDI D, et al. Family expansion and gene rearrangements contributed to the functional specialization of PRDM genes in vertebrates[J]. BMC Evol Biol, 2007, 7: 187. DOI:10.1186/1471-2148-7-187 |
| [4] |
DI ZAZZO E, DE ROSA C, ABBONDANZA C, et al. PRDM proteins:molecular mechanisms in signal transduction and transcriptional regulation[J]. Biology, 2013, 2(1): 107-141. DOI:10.3390/biology2010107 |
| [5] |
TRACEY LJ, JUSTICE MJ. Off to a bad start:cancer initiation by pluripotency regulator PRDM14[J]. Trends Genet, 2019, 35(7): 489-500. DOI:10.1016/j.tig.2019.04.004 |
| [6] |
TANIGUCHI H, IMAI K. Silencing PRDM14 via oligonucleotide therapeutics suppresses tumorigenicity and metastasis of breast cancer[J]. Methods Mol Biol Clifton N J, 2019, 1974: 233-243. DOI:10.1007/978-1-4939-9220-1_18 |
| [7] |
MZOUGHI S, ZHANG JX, HEQUET D, et al. PRDM15 safeguards naive pluripotency by transcriptionally regulating WNT and MAPK-ERK signaling[J]. Nat Genet, 2017, 49(9): 1354-1363. DOI:10.1038/ng.3922 |
| [8] |
FITZMAURICE C, GLOBAL BURDEN OF DISEASE CANCER COLLABORATION. Global, regional, and national cancer incidence, mortality, years of life lost, years lived with disability, and disability-adjusted life-years for 29 cancer groups, 2006 to 2016:a systematic analysis for the Global Burden of Disease study[J]. J Clin Oncol, 2018, 36(15_suppl): 1568. DOI:10.1200/jco.2018.36.15_suppl.1568 |
| [9] |
MILLER KD, SIEGEL RL, LIN CC, et al. Cancer treatment and survivorship statistics, 2016[J]. CA:A Cancer J Clin, 2016, 66(4): 271-289. DOI:10.3322/caac.21349 |
| [10] |
PETERSON LA, BELLILE EL, WOLF GT, et al. Cigarette use, comorbidities, and prognosis in a prospective head and neck squamous cell carcinoma population[J]. Head Neck, 2016, 38(12): 1810-1820. DOI:10.1002/hed.24515 |
| [11] |
郭艳, 尚超, 任美思, 等. miR-15b对口腔鳞癌细胞Cal27增殖与凋亡能力影响研究[J]. 中国实用口腔科杂志, 2015, 8(8): 458-460. DOI:10.7504/kq.2015.08.003 |
| [12] |
ZHANG LN, CAO HM, HE T, et al. Overexpression of PRDM13 inhibits glioma cells via Rho and GTP enzyme activation protein[J]. Int J Mol Med, 2018, 42(2): 966-974. DOI:10.3892/ijmm.2018.3679 |
| [13] |
TANIGUCHI H, IMAI K. PRDM14, a zinc finger protein, regulates cancer stemness[J]. Zinc Finger Proteins, 2018, 1867: 3-13. DOI:10.1007/978-1-4939-8799-3_1 |
| [14] |
CORRIGAN DJ, LUCHSINGER LL, JUSTINO DE ALMEIDA M, et al. PRDM16 isoforms differentially regulate normal and leukemic hematopoiesis and inflammatory gene signature[J]. J Clin Investig, 2018, 128(8): 3250-3264. DOI:10.1172/JCI99862 |
 2021, Vol. 50
2021, Vol. 50