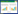文章信息
- 常晓岑, 温晶, 索琳娜, 白博文, 郭丹, 赵玉岩
- CHANG Xiaocen, WEN Jing, SUO Linna, BAI Bowen, GUO Dan, ZHAO Yuyan
- 增食欲素A调节大鼠肾上腺嗜铬细胞瘤PC12细胞自噬的研究
- Effect of orexin-A on autophagy in rat adrenol pheochromocytoma PC12 cells
- 中国医科大学学报, 2021, 50(12): 1097-1101
- Journal of China Medical University, 2021, 50(12): 1097-1101
-
文章历史
- 收稿日期:2021-04-01
- 网络出版时间:2021-12-07 13:03
2. 中国医科大学附属第一医院内分泌与代谢病科, 内分泌研究所, 辽宁省内分泌疾病重点实验室, 沈阳 110001
2. Department of Endocrinology and Metabolism, research institute of Endocrinology, Liaoning Provincial Key Laboratory of Endocrine Diseases, The First Hospital of China Medical University, Shenyang 110001, China
增食欲素是下丘脑的神经肽,包括增食欲素A(orexin-A)和增食欲素B(orexin-B)2种,在调节睡眠、觉醒、神经内分泌平衡、摄食、应激反应等行为中起十分重要的作用[1-4]。增食欲素有2种膜结合G蛋白耦联受体,即增食欲素受体1(orexin receptor-1,OX1R)和增食欲素受体2(orexin receptor-2,OX2R)。orexin-A是OX1R的高亲和力受体激动剂,相比之下,orexin-A对OX2R亲和力较低[5-7]。研究[8]表明,orexin-A比orexin-B的生物学作用更广泛且重要。既往研究与本课题组前期研究[9-11]均发现增食欲素对多种内分泌腺细胞增殖、凋亡、细胞活力有影响,但对自噬的作用鲜有研究。因此,本研究拟分析orexin-A对大鼠肾上腺嗜铬细胞瘤PC12细胞自噬的作用,即对LC3Ⅰ、LC3Ⅱ以及Beclin-1蛋白表达水平的影响,以及orexin-A调节PC12细胞自噬后对去甲肾上腺素(norepinephrine,NE)分泌水平的影响。
1 材料与方法 1.1 材料大鼠肾上腺嗜铬细胞瘤PC12细胞购自中国科学院上海生命科学研究院细胞资源中心。
DMEM培养基和10%胎牛血清购自德国默克Sigma-Aldrich公司;胰蛋白酶购自赛默飞世尔科技(中国)有限公司,ELISA试剂盒购自武汉云克隆公司;戊二醛固定液购自北京百奥莱博科技有限公司;兔抗LC3多克隆抗体购自中国ABclonal公司;兔抗Beclin-1抗体购自英国Abcam公司;OX1R抑制剂SB334867购自美国Cell signalling公司;自噬抑制剂3-MA试剂盒购自美国Sigma公司;BCA蛋白定量试剂盒、Western blotting一抗和二抗稀释液均购于自碧云天生物技术研究所;GAPDH抗体、辣根过氧化物酶标记的二抗等均购自艾博抗(上海)贸易有限公司;其余试剂均为国产分析纯。
低温高速离心机(3K-15)购自德国Sigma公司;化学发光仪(4200SF)购自中国天能仪器公司;酶标仪购自奥地利安托斯仪器公司;低速离心机购自科大创新股份有限公司中佳分公司;电热恒温干燥箱购自北京市光明医疗仪器厂。
1.2 方法 1.2.1 细胞培养与分组将PC12细胞接种在DMEM高糖培养基+10%胎牛血清+1%双抗(100 U/mL青霉素、100 U/mL链霉素)培养基中,于37 ℃、100%湿度、5%CO2的恒温培养箱中培养,每1~2 d换液1次。待细胞处于对数生长期时,取出培养皿,将细胞接种于24孔板中(2 mL/孔)。既往研究[12]发现,10-6 mol/L orexin-A刺激肾上腺髓质分泌肾上腺素及NE显著,因此,本研究采用10-6 mol/L orexin-A进行实验。细胞培养24 h后,分为3组进行实验,即orexin-A组(加入10-6 mol/L orexin-A),orexin-A+OX1Ri组(SB334867预处理1 h后加入10-6 mol/L orexin-A)和空白对照组,每组设3个复孔,每组处理时间为24 h。
1.2.2 透射电镜观察弃掉空白对照组和orexin-A组培养基,用PBS洗涤3次后,将PC12细胞移入新的离心管中,3 000 r/min离心10 min,弃上清,加入1 mL 2.5%戊二醛固定24 h,透射电镜下观察并拍照。
1.2.3 Western blotting收集各组处于对数生长期的PC12细胞,加入裂解液冰上充分裂解,BCA法测定蛋白浓度。调整蛋白浓度后,进行SDS-PAGE凝胶电泳分离,洗膜3次后转膜,5%脱脂奶粉封闭2 h。加入一抗,4 ℃孵育过夜。洗膜3次后加入二抗,室温孵育2 h,洗膜3次,ECL显色。应用Image J软件分析结果。
1.2.4 ELISA检测上清液中NE含量将细胞培养液从培养瓶移入离心管中,离心后弃沉淀,取上清液。按照ELISA试剂盒说明书检测上清液中NE含量。每个样品测定3次,用酶标仪检测OD值,计算每个样品的平均OD值。
1.3 统计学分析采用SPSS 21.0软件进行统计学分析。计量资料以x±s表示,采用单因素方差分析比较。P < 0.05为差异有统计学意义。
2 结果 2.1 Orexin-A上调PC12细胞OX1R蛋白表达如图 1所示,orexin-A显著上调了PC12细胞中OX1R蛋白的表达水平(P < 0.05),而同时加入orexin-A和OX1R抑制剂的PC12细胞中OX1R蛋白的表达水平明显下降,且与空白对照组比较无统计学差异(P > 0.05)。
|
| ** P < 0.05, compared with control group; ## P < 0.05, compared with orexin-A group 图 1 Orexin-A对PC12细胞OX1R蛋白表达的影响 Fig.1 The effect of orexin-A on OX1R protein expression in PC12 cells |
2.2 orexin-A对PC12细胞自噬的影响
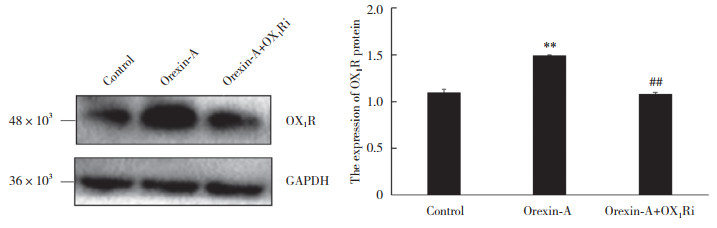
如图 2所示,透射电镜下可见,空白对照组正常PC12细胞的细胞质结构致密,各细胞器清晰,形态良好,少见自噬的发生。而orexin-A组PC12细胞则较空白对照组自噬体增多。表明orexin-A促进了PC12细胞自噬。
|
| A, control group; B, orexin-A group. White arrow indicates autophagosome 图 2 透射电镜观察orexin-A对PC12细胞自噬的影响 Fig.2 The effect of orexin-A on autophagy in PC12 cells observed by transmission electron microscope |
2.3 orexin-A通过OX1R促进PC12细胞自噬
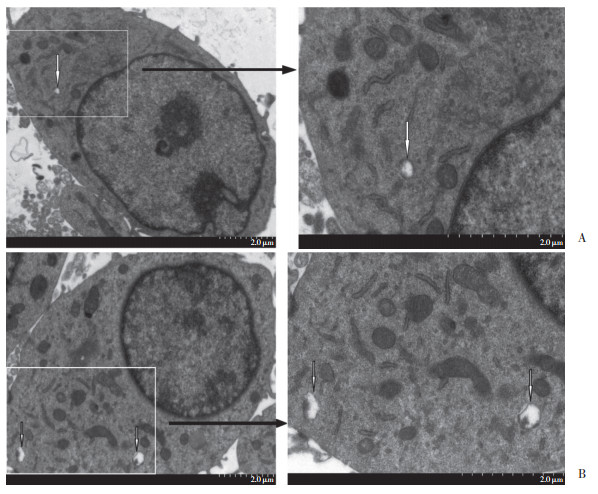
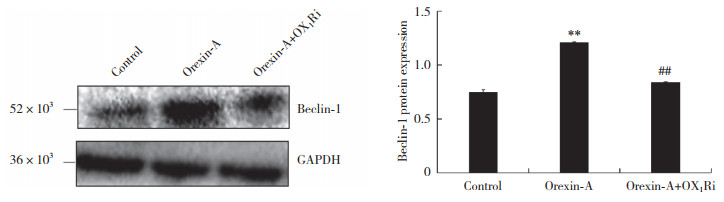
如图 3、4所示,orexin-A组LC3Ⅱ/LC3Ⅰ和Beclin-1蛋白表达水平均显著高于空白对照组,而orexin-A+OX1Ri组LC3Ⅱ/LC3Ⅰ和Beclin-1蛋白表达水平则显著低于orexin-A组,差异均有统计学意义(均P < 0.05)。orexin-A组LC3Ⅱ/LC3Ⅰ比值显著高于空白对照组和orexin-A+OX1Ri组。
|
| ** P < 0.05, compared with control group; ## P < 0.05, compared with orexin-A group 图 3 Orexin-A对PC12细胞LC3Ⅱ、LC3Ⅰ蛋白表达的影响 Fig.3 The effect of orexin-A on LC3Ⅱ and LC3Ⅰ protein expression in PC12 cells |
|
| ** P < 0.05, compared with control group; ## P < 0.05, compared with orexin-A group 图 4 Orexin-A对PC12细胞Beclin-1蛋白表达的影响 Fig.4 Orexin-A effect of orexin-A on Beclin-1 protein expression in PC12 cells |
2.4 orexin-A对PC12中NE分泌的调节
结果显示,orexin-A组NE浓度[(1.99±0.14)pg/mL]显著高于空白对照组[(1.77±0.10)pg/mL],差异有统计学意义(P < 0.05);而orexin-A+OX1Ri组的NE浓度[(1.88±0.13)pg/mL]显著低于orexin-A组,差异有统计学意义(P < 0.05)。提示orexin-A可能是通过OX1R上调PC12细胞NE分泌水平。
3 讨论orexin-A和orexin-B是来自同一前体前orexin原的神经肽。二者高度表达于涉及摄食行为的侧下丘脑区域,也存在于肾上腺、胃肠道、胰腺等外周组织及血液中。增食欲素的2个功能性受体(OX1R、OX2R)广泛且有差异地分布于脑组织中,也见于肾脏、肾上腺、甲状腺、睾丸、卵巢、空肠、肺等外周组织中。研究[5-6, 13-14]表明,orexin-A与OX1R的结合力是orexin-B与OX1R结合力的5~100倍,而orexin-A和orexin-B对于OX2R则具有相似的亲和力。相对于orexin-B,orexin-A稳定性好、生物学作用更强且广泛,而orexin-A又是OX1R的高亲和力受体激动剂,因此,本研究主要探讨orexin-A与OX1R的作用。结果显示,orexin-A组PC12细胞中OX1R的蛋白表达水平显著高于空白对照组,而加入受体抑制剂后,PC12细胞OX1R的蛋白表达水平显著下降(P < 0.05),提示orexin-A上调了PC12细胞OX1R蛋白的表达。
增食欲素系统具有调节摄食与能量平衡,促进觉醒,以及调节呼吸、情绪、心率、血压等作用[15]。近年来的研究主要关注于增食欲素对细胞增殖、凋亡、活力、激素分泌的作用,但对细胞自噬的影响鲜有研究。细胞自噬被称为Ⅱ型程序性细胞死亡,是依赖溶酶体降解细胞质内细胞器和大分子物质的代谢途径[16]。自噬在细胞新陈代谢、结构重建、生长发育中起着重要作用。本研究发现,透射电镜下可见orexin-A组PC12细胞的自噬体较空白对照组PC12细胞增多,提示orexin-A可能促进了细胞自噬。LC3是自噬标志物,有LC3Ⅰ和LC3Ⅱ 2种表现形式,自噬形成时,胞浆型LC3(即LC3Ⅰ)会酶解掉一小段多肽,转变为活化形式的LC3(自噬体膜型),即LC3Ⅱ。研究[17-18]表明,LC3Ⅱ/LC3Ⅰ比值与自噬体形成的数量成正比,因此,可用LC3Ⅱ/LC3Ⅰ比值估计自噬水平,比值增高往往代表自噬体形成。Beclin-1是酵母ATG6的同源体,也是自噬相关的特异性基因,调控自噬前体和自噬体的形成[19]。因此,也可用其表达水平判断自噬水平,Beclin-1升高是自噬形成的重要指标[20]。本研究结果显示,orexin-A组PC12细胞的LC3Ⅱ/LC3Ⅰ和Beclin-1的蛋白表达水平均显著高于空白对照组和orexin-A+OX1Ri组(P < 0.05)。提示orexin-A可能通过OX1R来激活自噬相关蛋白LC3和Beclin-1,从而促进PC12细胞自噬,但其具体机制有待进一步研究。
本研究还发现,orexin-A组PC12细胞的NE含量显著高于空白对照组,而加入OX1Ri组PC12细胞的NE含量明显下降,说明orexin-A通过OX1R影响细胞自噬、调节PC12细胞的NE分泌水平,提示PC12细胞的NE分泌调节机制可能与细胞自噬有关。
综上所述,本研究发现orexin-A可能通过OX1R促进PC12细胞自噬,并上调PC12细胞的NE分泌水平,且orexin-A对PC12细胞NE分泌水平的调节机制可能与细胞自噬有关。尽管具体的分子机制还需进一步探索,但本研究发现了orexin-A对肾上腺细胞自噬的促进作用,补充了orexin-A的生物学功能,对于进一步认识orexin-A具有重要意义。orexin-A及其受体OX1R可能成为调节肾上腺功能紊乱的治疗靶点之一。
| [1] |
BOOF ML, DINGEMANSE J, LEDERER K, et al. Effect of the new dual orexin receptor antagonist daridorexant on nighttime respiratory function and sleep in patients with mild and moderate obstructive sleep apnea[J]. Sleep, 2021, 44(6): zsaa275. DOI:10.1093/sleep/zsaa275 |
| [2] |
HAN D, HAN F, SHI Y, et al. Mechanisms of memory impairment induced by orexin-A via orexin 1 and orexin 2 receptors in post-traumatic stress disorder rats[J]. Neuroscience, 2020, 432: 126-136. DOI:10.1016/j.neuroscience.2020.02.026 |
| [3] |
SHU S, DAI A, WANG J, et al. A novel series of 4-methyl substituted pyrazole derivatives as potent glucagon receptor antagonists: design, synthesis and evaluation of biological activities[J]. Bioorg Med Chem, 2018, 26(8): 1896-1908. DOI:10.1016/j.bmc.2018.02.036 |
| [4] |
SIEMINSKI M, SZYPENBEJL J, PARTINEN E. Orexins, sleep, and blood pressure[J]. Curr Hypertens Rep, 2018, 20(9): 79. DOI:10.1007/s11906-018-0879-6 |
| [5] |
SAKURAI T, AMEMIYA A, ISHII M, et al. Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior[J]. Cell, 1998, 92(4): 573-585. DOI:10.1016/s0092-8674(00)80949-6 |
| [6] |
AMMOUN S, HOLMQVIST T, SHARIATMADARI R, et al. Distinct recognition of OX1 and OX2 receptors by orexin peptides[J]. J Pharmacol Exp Ther, 2003, 305(2): 507-514. DOI:10.1124/jpet.102.048025 |
| [7] |
YIN J, BABAOGLU K, BRAUTIGAM CA, et al. Structure and ligand-binding mechanism of the human OX1 and OX2 orexin receptors[J]. Nat Struct Mol Biol, 2016, 23(4): 293-299. DOI:10.1038/nsmb.3183 |
| [8] |
SATO T, YAJIMA T, FUJITA M, et al. Orexin A and B in the rat superior salivatory nucleus[J]. Auton Neurosci, 2020, 228: 102712. DOI:10.1016/j.autneu.2020.102712 |
| [9] |
CHANG X, ZHAO Y, JU S, et al. Orexin-A regulates cell apoptosis in human H295R adrenocortical cells via orexin receptor type 1 through the AKT signaling pathway[J]. Mol Med Rep, 2015, 12(5): 7582-7588. DOI:10.3892/mmr.2015.4381 |
| [10] |
MALENDOWICZ W, SZYSZKA M, ZIOLKOWSKA A, et al. Elevated expression of orexin receptor 2(HCRTR2) in benign prostatic hyperplasia is accompanied by lowered serum orexin A concentrations[J]. Int J Mol Med, 2011, 27(3): 377-383. DOI:10.3892/ijmm.2010.590 |
| [11] |
SUO L, CHANG X, ZHAO Y. The orexin-A-regulated Akt/mTOR pathway promotes cell proliferation through inhibiting apoptosis in pancreatic cancer cells[J]. Front Endocrinol (Lausanne), 2018, 9: 647. DOI:10.3389/fendo.2018.00647 |
| [12] |
NANMOKU T, ISOBE K, SAKURAI T, et al. Effects of orexin on cultured porcine adrenal medullary and cortex cells[J]. Regul Pept, 2002, 104(1-3): 125-130. DOI:10.1016/s0167-0115(01)00356-1 |
| [13] |
SHU Q, ZHANG J, MA W, et al. Orexin-A promotes Glu uptake by OX1R/PKCα/ERK1/2/GLT-1 pathway in astrocytes and protects co-cultured astrocytes and neurons against apoptosis in Anoxia/hypoglycemic injury in vitro[J]. Mol Cell Biochem, 2017, 425(1-2): 103-112. DOI:10.1007/s11010-016-2866-z |
| [14] |
CUTLER DJ, MORRIS R, SHERIDHAR V, et al. Differential distribution of orexin-A and orexin-B immunoreactivity in the rat brain and spinal cord[J]. Peptides, 1999, 20(12): 1455-1470. DOI:10.1016/s0196-9781(99)00157-6 |
| [15] |
张靓, 赵玉岩, 常晓岑, 等. 增食欲素系统及其功能的研究进展[J]. 中国糖尿病杂志, 2017, 25(9): 847-850. DOI:10.3969/j.issn.1006-6187.2017.09.017 |
| [16] |
JUNG S, JEONG H, YU SW. Autophagy as a decisive process for cell death[J]. Exp Mol Med, 2020, 52(6): 921-930. DOI:10.1038/s12276-020-0455-4 |
| [17] |
RUBIO-GONZÁLEZ A, POTES Y, ILLÁN-RODRÍGUEZ D, et al. Effect of animal mixing as a stressor on biomarkers of autophagy and oxidative stress during pig muscle maturation[J]. Animal, 2015, 9(7): 1188-1194. DOI:10.1017/s1751731115000518 |
| [18] |
ZAHRA W, RAI SN, BIRLA H, et al. Neuroprotection of rotenone-induced Parkinsonism by ursolic acid in PD mouse model[J]. CNS Neurol Disord Drug Targets, 2020, 19(7): 527-540. DOI:10.2174/1871527319666200812224457 |
| [19] |
KAUR S, CHANGOTRA H. The beclin 1 interactome: modification and roles in the pathology of autophagy-related disorders[J]. Biochimie, 2020, 175: 34-49. DOI:10.1016/j.biochi.2020.04.025 |
| [20] |
VIJAYAKUMAR K, CHO GW. Autophagy: an evolutionarily conserved process in the maintenance of stem cells and aging[J]. Cell Biochem Funct, 2019, 37(6): 452-458. DOI:10.1002/cbf.3427 |
 2021, Vol. 50
2021, Vol. 50