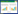文章信息
- 安雯, 潘四维, 段石杰, 刘鹏飞, 徐惠绵
- AN Wen, PAN Siwei, DUAN Shijie, LIU Pengfei, XU Huimian
- 基于GEO基质评分和免疫评分分析HLA-DRA在胃癌组织中的表达及其临床意义
- Analysis of the clinical significance of HLA-DRA in gastric cancer tissues based on GEO stromal and immune scores
- 中国医科大学学报, 2021, 50(12): 1063-1068
- Journal of China Medical University, 2021, 50(12): 1063-1068
-
文章历史
- 收稿日期:2021-03-08
- 网络出版时间:2021-12-07 12:18
胃癌是世界范围内发病率和死亡率最高的恶性肿瘤之一,其发病率和死亡率分别位居第五位和第三位[1]。早期胃癌患者5年生存率可达90%以上,但由于胃癌起病隐匿、症状不典型,多数患者发现时已处于进展期[2]。了解胃癌的异质性,对精准评估预后及个性化临床诊疗至关重要。肿瘤微环境(tumor microenvironment,TME)包括肿瘤细胞、基质细胞、免疫细胞以及细胞外基质等成分。基质细胞能够促进和维持肿瘤的发生和发展[3],不同免疫细胞的浸润水平也与肿瘤预后密切相关[4]。因此,评估胃癌组织中基质细胞含量与免疫细胞浸润程度,分析影响基质和免疫浸润的差异基因(differentially expressed genes,DEGs),对于研究TME在胃癌发生和发展中潜在分子机制、预测预后具有重要意义。
本研究联合7个高通量基因表达(gene expression omnibus,GEO)数据库芯片的转录组测序数据,通过使用表达数据估计肿瘤中的基质细胞含量和免疫细胞浸润程度(estimation of stromal and immune cells in malignant tumor tissues using expression data,ESTIMATE)算法估计胃癌中基质细胞含量和免疫细胞浸润程度[5]并计算基质评分(stromal score,SS)和免疫评分(immune score,IS),分析评分与胃癌预后及临床病理的相关性,筛选和验证预后相关DEGs,探索胃癌治疗新靶点。
1 材料与方法 1.1 数据来源和SS、IS评估使用GEO数据库GSE15459、GSE34942、GSE35809、GSE54129、GSE57303、GSE62254、GSE64951共7个胃癌芯片,校正消除组间差异,构建870例胃癌联合分析数据集。利用ESTIMATE算法计算SS及IS[5],对基质细胞和免疫细胞相关基因的表达数据进行基因富集分析。由于芯片临床信息记录标准存在差异,选取样本量最大的GSE62254临床信息进行SS、IS与预后及临床病理的相关性分析。
1.2 SS、IS相关关键DEGs筛选和功能分析以|log2FC| > 1、P < 0.05为过滤条件,SS、IS中位数为界,筛选DEGs并取交集。对共同DEGs进行基因本体论(gene ontology,GO)功能富集分析以及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路分析。基于GSE62254芯片临床信息,通过单因素、多因素Cox回归分析确定与总体生存期(overall survival,OS)相关且具有独立预后价值的DEGs,并对其中新型胃癌预后分子HLA-DRA进行免疫组化验证。
1.3 免疫组化收集2009年3月至2012年6月在中国医科大学附属第一医院肿瘤外科行胃癌根治术的原发性胃癌患者标本105例,进行HLA-DRA免疫组化染色,作为独立验证数据集。105例患者中,男81例,女24例;平均年龄(60.1±11.2)岁;随访时间0~89个月,中位随访时间34(14~66)个月。患者术前未接受任何抗肿瘤治疗。本研究获得中国医科大学伦理委员会批准,所有患者均签署知情同意书。
组织切片经过二甲苯脱蜡,梯度乙醇水化,3%过氧化氢孵育20 min,柠檬酸盐缓冲液(pH 6.0)加热2 min抗原修复,10%山羊血清孵育30 min。使用HLA-DRA抗体(1∶500,多克隆兔抗,美国Proteintech公司)4 ℃孵育过夜。次日生物素标记IgG聚合物室温20 min,链霉菌抗生物素蛋白-过氧化物酶室温30 min,镜下DAB染色1 min,苏木素染色2 min,盐酸乙醇返蓝,漂洗,脱水封片。
1.4 统计学分析采用R 3.5.1软件和SPSS 25.0软件进行数据分析。临床相关性分析采用独立样本t检验和单因素方差分析,生存分析采用Kaplan-Meier法并进行log-rank检验,采用Cox风险回归模型预测独立预后因素。P < 0.05为差异有统计学意义。
2 结果 2.1 SS、IS评估及预后、临床病理相关性分析通过ESTIMATE算法计算胃癌联合分析数据集中样本的SS、IS,分别以SS、IS中位数为界,将GSE62254芯片中300例胃癌组织样本分为高分组和低分组。生存分析显示,高SS患者比低SS患者预后差(P = 0.015,图 1A),IS与预后无显著相关性(P = 0.899,图 1B)。
|
| A, stromal score; B, immune score; C-J, correlation analysis of clinical features. 图 1 SS和IS的Kaplan-Meier生存分析和临床相关性分析 Fig.1 Kaplan-Meier survival analysis and correlation analysis of clinical features of the stromal and immune scores |
临床病理相关性分析(图 1C~1J)中,SS和IS与肿瘤TNM分期、T分期、M分期、Lauren分型、EB病毒(Epstein-Barr virus,EBV)感染显著相关(P < 0.05),SS与以腹膜种植为第一复发位点、Borrmann分型显著相关(P < 0.05),而IS并不相关。此外,二者与N分期均无相关性(P > 0.05)。以上结果说明,免疫浸润程度和基质细胞含量一定程度上影响着胃癌侵袭、迁移等方面的病程发展。
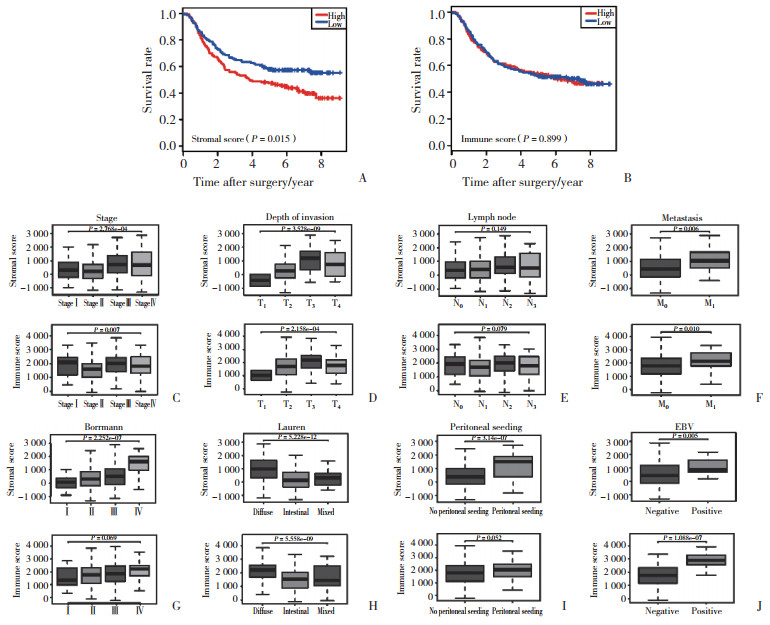
2.2 筛选SS、IS关键DEGs及功能分析、多因素Cox回归分析SS、IS相关DEGs分别为448个、204个,共同DEGs 59个。GO分析(图 2A)显示,共同DEGs参与细胞对γ干扰素的反应、单核细胞迁移等免疫相关功能。KEGG(图 2B)显示,共同DEGs在核因子κB信号通路、趋化因子信号通路等显著富集。
|
| A, GO functional enrichment analysis; B, KEGG pathway enrichment analysis. 图 2 DEGs的GO功能富集分析和KEGG通路分析 Fig.2 GO functional enrichment analysis and KEGG pathway enrichment analysis of DEGs |
对共同DEGs进行单因素分析(表 1),结果表明,ARHGEF6、C3、CCL19、CCL2、GIMAP7、HLA-DRA、RASSF2与胃癌患者预后显著相关(P < 0.05),多因素Cox回归分析显示,C3和HLA-DRA是独立预后因素(P = 0.005,P < 0.001)。由于HLA-DRA与胃癌预后的相关研究尚少,本研究选择HLA-DRA作为主要研究对象。
| Gene | Univariate analysis | Multivariate analysis | |||
| HR(95% CI) | P | HR(95% CI) | P | ||
| ARHGEF6 | 1.502(1.089-2.074) | 0.013 | 1.040(0.610-1.776) | 0.885 | |
| C3 | 1.778(1.284-2.462) | 0.001 | 1.652(1.166-2.340) | 0.005 | |
| CCL19 | 1.438(1.043-1.983) | 0.027 | 1.231(0.813-1.863) | 0.326 | |
| CCL2 | 1.394(1.012-1.922) | 0.042 | 1.112(0.768-1.610) | 0.574 | |
| GIMAP7 | 1.384(1.005-1.908) | 0.046 | 1.070(0.646-1.773) | 0.792 | |
| HLA-DRA | 0.694(0.503-0.985) | 0.026 | 0.529(0.374-0.747) | < 0.001 | |
| RASSF2 | 1.641(1.188-2.269) | 0.003 | 1.397(0.900-2.168) | 0.137 | |
2.3 免疫组化分析
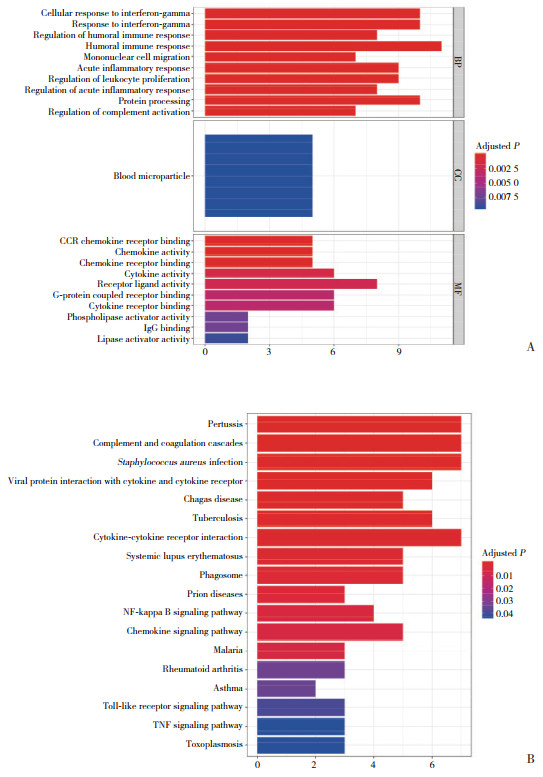
105例胃癌患者的免疫组化分析结果(图 3)显示,HLA-DRA高表达的胃癌患者OS显著延长(P = 0.008),HLA-DRA低表达与复发(P = 0.008)显著相关(表 2)。单因素和多因素Cox回归分析(表 3)提示,HLA-DRA(HR=0.562,95% CI:0.341~0.922,P = 0.023)是胃癌独立预后预测因素。
|
| A, high expression of HLA-DRA is associated with prolonged OS in patients with gastric cancer; B, HLA-DRA immunohistochemical staining in gastric cancer tissues (×100). 图 3 HLA-DRA高表达的胃癌患者OS显著延长 Fig.3 OS of gastric cancer patients with high expression of HLA-DRA is significantly prolonged |
| Clinical characteristic | Low expression of HLA-DRA | High expression of HLA-DRA | P |
| Sex | 0.039 | ||
| Female | 7(6.7) | 17(16.1) | |
| Male | 43(41.0) | 38(36.2) | |
| Age | 0.164 | ||
| < 65 years | 27(25.7) | 37(35.2) | |
| ≥65 years | 23(21.9) | 18(17.2) | |
| Depth of invasion | 0.327 | ||
| pT1 | 1(1.0) | 3(2.8) | |
| pT2 | 4(3.8) | 4(3.8) | |
| pT3 | 4(3.8) | 10(9.6) | |
| pT4 | 41(39.0) | 38(36.2) | |
| Lymph nodes metastasis | 0.79 | ||
| pN0 | 12(11.4) | 12(11.4) | |
| pN1-pN3 | 38(36.1) | 43(40.1) | |
| Metastasis | 0.381 | ||
| Absent | 45(42.9) | 52(49.4) | |
| Present | 5(4.8) | 3(2.9) | |
| Differentiation | 0.628 | ||
| Well/moderate | 24(22.9) | 29(27.5) | |
| Poor | 26(24.8) | 26(24.8) | |
| Recurrence | 0.008 | ||
| Absent | 12(11.5) | 27(25.7) | |
| Present | 38(36.1) | 28(26.7) |
| Parameter | Univariate analysis | Multivariate analysis | |||
| HR(95%CI) | P | HR(95%CI) | P | ||
| Gender(female/male) | 0.837(0.483-1.447) | 0.524 | - | - | |
| Age(< 65 years/≥65 years) | 0.966(0.593-1.572) | 0.889 | - | - | |
| Differentiation | 1.177(0.733-1.888) | 0.499 | - | - | |
| Adjuvant chemotherapy | 0.711(0.442-1.144) | 0.160 | - | - | |
| Depth of invasion | 2.696(1.575-4.615) | < 0.001 | 1.930(1.137-3.272) | 0.015 | |
| Lymph nodes metastasis | 5.244(2.259-12.167) | < 0.001 | 3.770(1.575-9.023) | 0.003 | |
| Metastasis(absent/present) | 4.508(2.065-9.837) | < 0.001 | 2.502(1.131-5.533) | 0.024 | |
| HLA-DRA(low/high) | 0.530(0.329-0.855) | 0.009 | 0.562(0.341-0.922) | 0.023 | |
3 讨论
TME由细胞成分和非细胞成分共同构成,其中非肿瘤细胞主要包括基质细胞以及各种免疫细胞细胞等。他们在肿瘤组织中被重塑,从而支持肿瘤的生物学行为[6],如癌症相关的成纤维细胞是TME中主要的基质细胞,它可以促进肿瘤细胞的上皮-间质转化,使肿瘤细胞更具侵袭性[7]。肿瘤相关巨噬细胞可以通过分泌大量细胞因子和生长因子来支持肿瘤的生长、血管生成和侵袭转移[8]。本研究结果也表明,胃癌患者基质细胞含量增加与免疫细胞的浸润会促进肿瘤的增殖、侵袭和转移,与TNM分期、T分期、M分期呈正相关。此外,进一步的生存分析也显示,高SS患者预后更差。但值得注意的是,IS与患者预后并不相关,考虑可能是由不同肿瘤阶段免疫细胞浸润类型的差异导致的。TME中不同的免疫细胞亚群在肿瘤免疫中发挥截然不同的作用,如CD4+CD25+ FOXP3+调节性T细胞通过多种机制破坏免疫监视,抑制抗肿瘤免疫[9],而CD8+T细胞是发挥抗肿瘤免疫的主要效应细胞,高水平的CD8+T细胞浸润往往肿瘤预后较好[10]。因此,不区分肿瘤阶段、不区分免疫细胞亚群的研究都可能影响IS的生存分析结果。
此外,本研究发现SS和IS相关的C3和HLA-DRA是胃癌的独立预后因素。其中,HLA-DR是一种主要组织相容性复合体(major histocompatibility complex,MHC)Ⅱ类抗原呈递分子,主要在抗原呈递细胞中表达,向CD4+T细胞呈递抗原[11]。在肿瘤免疫中,CD8+T细胞主要识别MHCⅠ类分子呈递的肿瘤抗原,但CD4+T细胞是CD8+T细胞的活化、记忆T细胞产生的关键。研究[12-13]发现,在B淋巴细胞瘤、骨肉瘤中HLA-DRA与恶性肿瘤的预后呈负相关;也有研究[14]报道,HLA-DRA是乳腺原位癌进展为浸润性导管癌的危险因素,其高水平与乳腺癌复发有关。而在一项膀胱癌研究[15]中,在非肌层浸润性和肌层浸润性膀胱癌中HLA-DRA高表达对患者预后的影响截然相反。关于HLA-DRA与胃癌预后的关系几乎没有研究报道,仅有研究[16]发现HLA-DRB1与胃癌发生的风险显著相关。本研究结果显示,HLA-DRA高表达的胃癌患者具有显著的生存优势,低表达患者存在更差的生物学行为。
综上所述,HLA-DRA是胃癌患者的潜在预后因子,其高表达与胃癌患者生存期延长显著相关。但胃癌的肿瘤免疫是一个非常复杂的系统,HLA-DRA在胃癌中的分子机制还有待进一步研究。
| [1] |
SUNG H, FERLAY J, SIEGEL RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
ISOBE Y, NASHIMOTO A, AKAZAWA K, et al. Gastric cancer treatment in Japan: 2008 annual report of the J胃癌A nationwide registry[J]. Gastric Cancer, 2011, 14(4): 301-316. DOI:10.1007/s10120-011-0085-6 |
| [3] |
WU T, DAI Y. Tumor microenvironment and therapeutic response[J]. Cancer Lett, 2017, 387: 61-68. DOI:10.1016/j.canlet.2016.01.043 |
| [4] |
JAROSZ-BIEJ M, SMOLARCZYK R, CICHOŃ T, et al. Tumor microenvironment as a "game changer" in cancer radiotherapy[J]. Int J Mol Sci, 2019, 20(13): E3212. DOI:10.3390/ijms20133212 |
| [5] |
YOSHIHARA K, SHAHMORADGOLI M, MARTÍNEZ E, et al. Inferring tumour purity and stromal and immune cell admixture from expression data[J]. Nat Commun, 2013, 4: 2612. DOI:10.1038/ncomms3612 |
| [6] |
QUAIL DF, JOYCE JA. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013, 19(11): 1423-1437. DOI:10.1038/nm.3394 |
| [7] |
BU L, BABA H, YOSHIDA N, et al. Biological heterogeneity and versatility of cancer-associated fibroblasts in the tumor microenvironment[J]. Oncogene, 2019, 38(25): 4887-4901. DOI:10.1038/s41388-019-0765-y |
| [8] |
Qian BZ, Pollard JW. Macrophage diversity enhances tumor progression and metastasis[J]. Cell, 2010, 141(1): 39-51. DOI:10.1016/j.cell.2010.03.014 |
| [9] |
FLAVELL RA, SANJABI S, WRZESINSKI SH, et al. The polarization of immune cells in the tumour environment by TGFbeta[J]. Nat Rev Immunol, 2010, 10(8): 554-567. DOI:10.1038/nri2808 |
| [10] |
REN D, HUA Y, YU B, et al. Predictive biomarkers and mechanisms underlying resistance to PD1/PD-L1 blockade cancer immunothe- rapy[J]. Mol Cancer, 2020, 19(1): 19. DOI:10.1186/s12943-020-1144-6 |
| [11] |
DUNNE MR, PHELAN JJ, MICHIELSEN AJ, et al. Characterising the prognostic potential of HLA-DR during colorectal cancer deve- lopment[J]. Cancer Immunol Immunother, 2020, 69(8): 1577-1588. DOI:10.1007/s00262-020-02571-2 |
| [12] |
BROWN PJ, WONG KK, FELCE SL, et al. FOXP1 suppresses immune response signatures and MHC classⅡexpression in activated B-cell-like diffuse large B-cell lymphomas[J]. Leukemia, 2016, 30(3): 605-616. DOI:10.1038/leu.2015.299 |
| [13] |
GUAN X, GUAN Z, SONG C. Expression profile analysis identifies key genes as prognostic markers for metastasis of osteosarcoma[J]. Cancer Cell Int, 2020, 20: 104. DOI:10.1186/s12935-020-01179-x |
| [14] |
PÉREZ-PENA J, TIBOR FEKETE J, PÁEZ R, et al. A transcriptomic immunologic signature predicts favorable outcome in neoadjuvant chemotherapy treated triple negative breast tumors[J]. Front Immunol, 2019, 10: 2802. DOI:10.3389/fimmu.2019.02802 |
| [15] |
PIAO XM, KANG HW, JEONG P, et al. A prognostic immune predictor, HLA-DRA, plays diverse roles in non-muscle invasive and muscle invasive bladder cancer[J]. Urol Oncol, 2021, 39(4): 237.e21-237.e29. DOI:10.1016/j.urolonc.2020.11.017 |
| [16] |
MAGNUSSON PKE, ENROTH H, ERIKSSON I, et al. Gastric cancer and human leukocyte antigen: distinct DQ and DR alleles are associated with development of gastric cancer and infection by Helicobacter pylori[J]. Cancer Res, 2001, 61(6): 2684-2689. |
 2021, Vol. 50
2021, Vol. 50