文章信息
- 连小月, 张志诚, 李晨嫣
- LIAN Xiaoyue, ZHANG Zhicheng, LI Chenyan
- Notch信号通路调控巨噬细胞极化加重自身免疫性甲状腺炎
- The Notch signaling pathway regulates macrophage polarization and exacerbates autoimmune thyroiditis
- 中国医科大学学报, 2021, 50(10): 899-903
- Journal of China Medical University, 2021, 50(10): 899-903
-
文章历史
- 收稿日期:2020-12-09
- 网络出版时间:2021-09-29 19:33
成熟巨噬细胞能在各种因素诱导下,出现表型和功能的分化,呈现明显的异质性,即极化现象[1]。可分为两大类:经典活化型巨噬细胞M1型和选择性活化巨噬细胞M2型[2-3]。如果M1型的巨噬细胞过表达,将会损害组织和细胞的修复,可能诱发自身免疫性疾病的发生发展[4-5]。Notch信号通路是调控巨噬细胞极化的主要通路之一[6-7],由表达于相邻细胞上的Notch受体和配体,以及表达于细胞内的转录因子、下游分子和其他调节分子组成。Notch信号通路激活促进M1型巨噬细胞极化[8-10]。
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)的发生机制是困扰众多研究者的难题。GEERS等[11]发现Graves’病患者的甲状腺组织中Notch1、Notch4以及DLL4在甲状腺细胞中高表达,但目前尚无Notch信号通路与AIT的相关研究。本研究利用碘诱导NOD.H-2h4小鼠AIT模型,探讨Notch信号通路和巨噬细胞极化方向的改变对AIT的影响,进而为治疗AIT提供新的方案。
1 材料与方法 1.1 材料伊红、苏木素和中性树脂均采购自北京试剂公司,二甲苯购自中国化工研究所,RNA反转录试剂盒、SYBR® Premix Ex TaqTM Ⅱ试剂盒均采购日本TaKaRa公司,抗甲状腺球蛋白抗体(thyroglobulin antibodies,TgAb)的ELISA试剂盒购自R & D公司,流式标记抗体F4/80,CD11c,CD206,红细胞裂解液均购自赛默飞公司,小鼠M-CSF刺激因子购自金斯瑞公司,胎牛血清、1640培养基均购自美国Gibco公司。
1.2 实验动物NOD.H-2h4小鼠购自Jackson Laboratory(美国),其喂养和干预的方案均根据中国医科大学对于实验动物伦理的指南严格执行,并获得中国医科大学实验动物伦理委员会批准。
1.3 方法 1.3.1 动物分组及处理随机将4周龄的NOD.H-2h4雌性小鼠(体质量20 g)分为无菌水喂养对照组(Control组)和高碘水(0.05%碘化钠)喂养的AIT模型组(SAT组)。每组动物于4、8、16周不同时间点麻醉处死。
1.3.2 实验方法 1.3.2.1 石蜡切片HE染色及AIT的评估取小鼠的甲状腺进行HE染色,依据甲状腺淋巴细胞浸润面积对炎症程度评分。
1.3.2.2 ELISA检测小鼠血清中TgAb滴度眼球取血,分离小鼠血清(4 ℃,30 min 8 000 g),采取ELISA试剂盒检测TgAb。实验步骤按照说明书进行操作。
1.3.2.3 流式细胞术检测小鼠腹腔细胞中M1/M2亚群各组小鼠处死后,剪开小鼠腹腔皮肤,将3 mL 5%胎牛血清的1640培养基注射入腹腔,对小鼠腹腔轻轻按压,持续2 min,将腹腔中的液体收集至10 mL离心管中,离心弃上清液,加入5 mL红细胞裂解液10 min,离心分管。分别避光加入FITC标记的F4/80、PE标记的CD11c和APC标记的CD206。
1.3.2.4 诱导小鼠骨髓巨噬细胞取各个时点小鼠的股骨和胫骨,用大头针在小鼠长骨两端打孔,无菌注射器注入10 mL PBS冲洗骨髓内细胞,移入离心管,重复此步骤3~4次。将收集来的骨髓灌洗液离心弃上清。用3 mL红细胞裂解液,离心,弃上清。调整细胞至合适浓度,接种于6孔板中,加入40 ng/mL的集落刺激因子。37 ℃,5% CO2细胞培养箱中过夜。于第8天收集细胞,应用流式细胞仪检测。
1.3.2.5 实时定量PCR分析应用TRIzol试剂(美国Invitrogen公司)按照说明书提取不同时间点小鼠骨髓巨噬细胞总RNA,并鉴定纯度及测定浓度,按照逆转录试剂盒(PrimeScriptTM RT reagent kit RR037A)的说明书,将总RNA的原始浓度稀释为500 ng/µL,并将提取的总RNA逆转录合成cDNA。依据NCBI中GenBank提供的基因序列信息,应用Primer 5及NCBI中BLAST功能,分别设计出目的基因的上下游引物,由华大股份有限公司合成并纯化,其序列见表 1。
| Gene | Forward primer(5’-3’) | Reverse primer(5’-3’) |
| Notch1 | CGTGGATTCATCTGTAGGTGC | CATAGGCAGGTGGGACTACG |
| Notch3 | CATAGGCAGGTGGGACTACG | CTCGTATTGGCAGTGTGTGC |
| Jagged1 | CTCGTATTGGCAGTGTGTGC | GGAAGGCAATCACAGTAGTAGC |
| Delta1 | GGTTGCTCTGTGTTCTGCCG | GTTGGTCATCACACCCTGGC |
1.4 统计学分析
采用SPSS 22.0软件进行统计分析。符合正态分布数据采用x±s描述,采用t检验和one-way ANOVAs进行比较。非正态分布数据采用M(P25~P75)中位数及四分位数间距描述,采用秩和检验和χ2检验进行比较。P < 0.05为差异有统计学意义。
2 结果 2.1 血清TgAb滴度的变化SAT组小鼠TgAb分光度(optical density,OD)值在高碘干预8周和16周后均高于同龄Control组,有统计学差异(P < 0.05和P < 0.01)。而高碘喂养4周的SAT组小鼠TgAb OD值与Control组比较,无统计学差异。见表 2。
| Group | 4 weeks | 8 weeks | 16 weeks |
| SAT | 0.51±0.17 | 0.63±0.241) | 0.67±0.122) |
| Control | 0.41±0.05 | 0.46±0.09 | 0.49±0.08 |
| 1)P < 0.05;2)P < 0.01,compared with control group. | |||
2.2 甲状腺炎症状态评估
碘诱导4周时,SAT组以及Control组小鼠几乎均不发生甲状腺炎。从第8周开始SAT组出现不同程度的淋巴细胞浸润,较对照组明显加重,炎症比例升高,50%以上滤泡破坏严重,纤维化程度较广,正常甲状腺滤泡细胞几乎不存在,而Control组75%小鼠未见明显的滤泡增大,淋巴细胞浸润。高碘喂养16周后,SAT组小鼠甲状腺小叶内可见滤泡大小不一,滤泡间隙淋巴细胞浸润,上皮增生,而Control组小鼠仅有少数出现淋巴细胞浸润,且炎症程度较低。见表 3,图 1。
| Scores of thyroiditis | 4 weeks | 8 weeks | 16 weeks | ||||
| SAT | Control | SAT | Control | SAT | Control | ||
| 0 | 75 | 100 | 0 | 75 | 0 | 62.5 | |
| 1+ | 25 | 0 | 25 | 25 | 12.5 | 25 | |
| 2+ | 0 | 0 | 50 | 0 | 25 | 12.5 | |
| 3+ | 0 | 0 | 25 | 0 | 37.5 | 0 | |
| 4+ | 0 | 0 | 0 | 0 | 25 | 0 | |
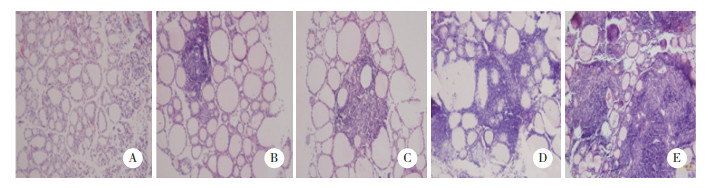
|
| A, 0 score; B, 1 score; C, 2 score; D, 3 score; E, 4 score. 图 1 光镜下NOD.H-2h4小鼠甲状腺炎性评分×400 Fig.1 Thyroid inflammatory score of NOD.H-2h4 mice under a light microscope ×400 |
2.3 NOD.H-2h4小鼠腹腔中M1和M2的表达
采用流式细胞术检测小鼠腹腔中巨噬细胞群的分布状况。根据流式细胞分析的结果,在F4/80+巨噬细胞中,高碘喂养8周和16周后的NOD.H-2h4小鼠SAT组与同龄Control组相比,腹腔M1型巨噬细胞(F4/80+CD11c+)比例明显升高,M2型巨噬细胞(F4/80+CD206+)比例明显下降,有统计学差异(P < 0.05)。而高碘喂养4周的NOD.H-2h4小鼠SAT组与同龄对照组相比,M1型和M2型巨噬细胞的比例并无明显的上升或下降趋势,无统计学差异(P > 0.05)。见图 2。
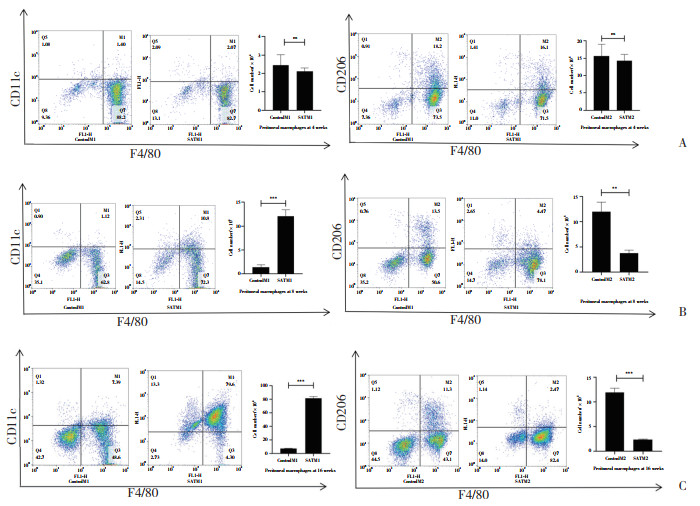
|
| A, 4 weeks; B, 8 weeks; C, 16 weeks. ** P < 0.01;*** P < 0.001. 图 2 流式细胞术分析NOD.H-2h4小鼠腹腔巨噬细胞极化群 Fig.2 Flow cytometry analysis of the polarized peritoneal macrophage populations in NOD.H-2h4 mice |
2.4 NOD.H-2h4小鼠骨髓巨噬细胞Notch信号通路Notch1、Notch3、Jagged1、Delta1 mRNA的表达
在高碘喂养8周和16周的SAT组小鼠骨髓巨噬细胞中,Notch1、Notch3、Jagged1以及Delta1 mRNA的表达显著高于同龄Control组,有统计学差异(P < 0.05)。但在高碘喂养4周的SAT组和同龄Control组小鼠骨髓巨噬细胞中,上述mRNA未见统计学差异(P > 0.05)。见表 4。
| Group | Notch1 | Notch3 | Jagged1 | Delta1 |
| 4 weeks | ||||
| Control | 1.000±0.128 0 | 1.000±0.243 6 | 1.000±0.127 9 | 0.417±0.130 7 |
| SAT | 1.062±0.234 3 | 0.841±0.202 8 | 0.886±0.109 6 | 1.000±0.743 5 |
| P | 0.709 1 | 0.354 8 | 0.223 7 | 0.251 7 |
| 8 weeks | ||||
| Control | 1.000±0.182 0 | 1.061±0.154 0 | 0.667±0.108 8 | 0.772±0.202 4 |
| SAT | 2.000±0.581 0 | 5.028±0.402 1 | 1.624±0.141 1 | 3.354±0.838 3 |
| P | 0.045 6 | < 0.000 1 | 0.000 7 | 0.006 6 |
| 16 weeks | ||||
| Control | 1.000±0.063 4 | 1.000±0.238 9 | 0.980±0.051 0 | 1.000±0.261 2 |
| SAT | 13.890±1.267 0 | 1.890±0.277 3 | 3.591±0.455 5 | 2.964±0.667 7 |
| P | < 0.000 1 | 0.002 8 | 0.000 6 | 0.009 0 |
3 讨论
研究[12-13]表明,M1型巨噬细胞极化增加是自身免疫性疾病发病的关键因素。在类风湿关节炎患者和多发性硬化动物模型中,都发现M1型巨噬细胞表达增加,从而加剧炎症反应。相反,通过减少M1型巨噬细胞极化,促进M2型巨噬细胞表达,则可以有效地减轻炎症反应,从而缓解症状[14]。
本研究结果显示,与正常饮水组相比,高碘饮水8周和16周后,NOD.H-2h4小鼠甲状腺切片HE染色均出现淋巴细胞浸润。相比于正常饮水的小鼠,在碘诱导的AIT小鼠中,腹腔巨噬细胞出现M1型巨噬细胞的极化明显增加,而M2型巨噬细胞的极化明显减少。随着甲状腺淋巴细胞的浸润程度加重,M1型巨噬细胞的极化增加,M2型巨噬细胞的表达则降低,差异有统计学意义。高碘饮水4周时,NOD.H-2h4小鼠甲状腺HE切片染色均未出现淋巴细胞浸润,实验组和对照组的NOD.H-2h4小鼠均未发生AIT症,腹腔M1/M2型巨噬细胞比例处于平衡,未出现上述的改变,差异无统计学意义。
在AIT中,巨噬细胞极化的发生过程至关重要。大量研究[15]表明Notch信号通路与炎症相关的巨噬细胞M1型极化密切相关,抑制巨噬细胞上Notch信号通路可以抑制其向M1型极化。在类风湿关节炎动物模型中,巨噬细胞高表达Notch1以及其下游靶分子Hes,给予Notch抑制剂后,炎症浸润程度降低,炎性细胞因子表达减少[16]。本研究也证实了在AIT小鼠中存在Notch信号通路相关分子的表达明显增加,差异均有统计学意义。
综上所述,AIT小鼠M1/M2巨噬细胞的动态平衡被破坏,极化明显偏向M1型巨噬细胞,且随着炎症浸润程度的加重而更加明显。究其作用机制可能是通过激活Notch信号通路,增加M1型巨噬细胞极化,加重AIT。总而言之,本研究为AIT研究提供新的思路,有利于进一步阐明AIT的发病机制。
| [1] |
HUME DA. The many alternative faces of macrophage activation[J]. Front Immunol, 2015, 6: 370. DOI:10.3389/fimmu.2015.00370 |
| [2] |
HIGASHI-KUWATA N, JINNIN M, MAKINO T, et al. Characterization of monocyte/macrophage subsets in the skin and peripheral blood derived from patients with systemic sclerosis[J]. Arthritis Res Ther, 2010, 12(4): R128. DOI:10.1186/ar3066 |
| [3] |
SARAH C, HU EN, LLOYD G. Macrophages in renal injury and repair[J]. Annu Rev Physiol, 2017, 79: 449-469. DOI:10.1146/annurev-physiol-022516-034219 |
| [4] |
HUANG YL, TIAN C, LI QM, et al. TET1 knockdown inhibits porphyromonas gingivalis LPS/IFN-γ-induced M1 macrophage polarization through the NF-κB pathway in THP-1 cells[J]. Int J Mol Sci, 2019, 20(8): 2023. DOI:10.3390/ijms20082023 |
| [5] |
LEE MK, MOORE XL, FU Y, et al. High-density lipoprotein inhibits human M1 macrophage polarization through redistribution of caveolin-1[J]. Br J Pharmacol, 2016, 173(4): 741-751. DOI:10.1111/bph.13319 |
| [6] |
SARADNA A, DO DC, KUMAR S, et al. Macrophage polarization and allergic asthma[J]. Transl Res, 2018, 191: 1-14. DOI:10.1016/j.trsl.2017.09.002 |
| [7] |
ESRA'AK, SALEH A. Notch-1 signaling modulates macrophage polarization and immune defense against mycobacterium avium paratuberculosis infection in inflammatory diseases[J]. Microorganisms, 2020, 8(7): 1006.10. DOI:3390/microorganisms8071006 |
| [8] |
GURUHARSHA KG, KANKEL MW, ARTAVANIS-TSAKONAS S. The Notch signalling system: recent insights into the complexity of a conserved pathway[J]. Nat Rev Genet, 2012, 13(9): 654-666. DOI:10.1038/nrg3272 |
| [9] |
Yin DP, Wang WM, Han W, et al. Targeting Notch-activated M1 macrophages attenuate lung tissue damage in a rat model of ventilator induced lung injury[J]. Int J Mol Med, 2019, 44(4): 1388-1398. DOI:10.3892/ijmm.2019.4315 |
| [10] |
FALLAHI P, FERRARI SM, RUFFILLI I, et al. The association of other autoimmune diseases in patients with autoimmune thyroiditis: review of the literature and report of a large series of patients[J]. Autoimmun Rev, 2016, 15(12): 1125-1128. DOI:10.1016/j.autrev.2016.09.009 |
| [11] |
GEERS C, COLIN IM, GÉRARD AC. Delta-like 4/Notch pathway is differentially regulated in benign and malignant thyroid tissues[J]. Thyroid, 2011, 21(12): 1323-1330. DOI:10.1089/thy.2010.0444 |
| [12] |
SLATTERY ML, LUNDGREEN A, KADLUBAR SA, et al. JAK/STAT/SOCS-signaling pathway and colon and rectal cancer[J]. Mol Carcinog, 2013, 52(2): 155-166. DOI:10.1002/mc.21841 |
| [13] |
SUN W, ZHANG H, WANG H, et al. Targeting notch-activated M1 macrophages attenuates joint tissue damage in a mouse model of inflammatory arthritis[J]. J Bone Miner Res, 2017, 32(7): 1469-1480. DOI:10.1002/jbmr.3117 |
| [14] |
HAN R, XIAO J, ZHAN H, et al. Dimethyl fumarate attenuates experimental autoimmune neuritis through the nuclear factor erythroid-derived 2-related factor 2/hemoxygenase-1 pathway by altering the balance of M1/M2 macrophages[J]. J Neuroinflammation, 2016, 13(1): 97. DOI:10.1186/s12974-016-0559-x |
| [15] |
ZHANG W, XU W, XIONG S. Blockade of Notch1 signaling alleviates murine lupus via blunting macrophage activation and M2b polarization[J]. J Immunol, 2010, 184(11): 6465-6478. DOI:10.4049/jimmunol.0904016 |
| [16] |
XU L, LI L, ZHANG CY, et al. Natural diterpenoid oridonin ameliorates experimental autoimmune neuritis by promoting anti-inflammatory macrophages through blocking notch pathway[J]. Front Neurosci, 2019, 13: 272. DOI:10.3389/fnins.2019.00272 |
 2021, Vol. 50
2021, Vol. 50




