文章信息
- 刘逸夫, 李建新, 卢一寒, 李静, 单忠艳, 滕卫平
- LIU Yifu, LI Jianxin, LU Yihan, LI Jing, SHAN Zhongyan, TENG Weiping
- α-烯醇化酶中纤溶酶原结合位点抗原表位特异自身抗体与自身免疫性甲状腺炎孕妇流产的关系
- Specific autoantibodies directed against the plasminogen-binding site of α-enolase mediates spontaneous abortion in pregnant women with autoimmune thyroiditis
- 中国医科大学学报, 2021, 50(10): 873-878
- Journal of China Medical University, 2021, 50(10): 873-878
-
文章历史
- 收稿日期:2021-01-05
- 网络出版时间:2021-09-30 11:02
2. 大连市第三人民医院内分泌与代谢病科, 大连 116033
2. Department of Endocrinology and Metabolism, Dalian No. 3 People's Hospital, Dalian 116033, China
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)是最常见的内分泌疾病之一。甲状腺过氧化物酶抗体(thyroid peroxidase antibody,TPOAb)和甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)是最具有代表性的甲状腺自身抗体[1-2],妊娠妇女甲状腺自身抗体阳性率可高达2%~17%[2]。在甲状腺功能正常的AIT孕妇中,流产是最常见的不良妊娠结局,尤其是反复自然流产[3]。迄今,AIT孕妇流产风险增加的原因尚不清楚[4]。
α-烯醇化酶(α-enolase,ENO1)存在于大多数真核生物体内,广泛分布于胎盘等不同组织中[5]。ENO1自身抗体(α-enolase antibody,ENO1Ab)在系统性红斑狼疮等多种疾病及复发性流产中具有致病作用[6]。最新研究[7]表明,ENO1Ab可作为胎盘滋养层抗体参与母体不明原因复发性流产的发生,并可作为该病的一种新的自身免疫标志物。在不同疾病中,ENO1致病相关抗原表位肽不同。本研究拟探讨ENO1分子中纤溶酶原结合部位的一种抗原表位肽(P9)特异自身抗体在AIT孕妇中的表达情况及其是否与甲状腺功能正常的AIT孕妇流产的发生有关。
1 材料与方法 1.1 研究对象本组研究对象来源于中国医科大学附属第一医院内分泌研究所主导的“妊娠早期及拟妊娠妇女碘铁营养缺乏和亚临床甲状腺激素缺乏:筛查与干预”项目(简称SHEP项目)Ⅰ期。该项目由辽宁省沈阳市和大连市的23家医院参与。从SHEP项目筛选在本地区居住5年以上,无遗传疾病个人史和家族史,无严重慢性疾病史的妊娠 < 8周孕妇,不排除服用碘剂或铁剂(或含碘、铁复合维生素)者,最终共筛选出9 415名孕妇。本研究为回顾性巢式病例对照分析,入组孕妇同时测定血清一种ENO1抗原表位肽(具有纤溶酶原结合功能)的特异自身抗体表达。本研究已获得中国医科大学伦理委员会批准(AF-SOP-07-1.0-01),所有研究对象均签署知情同意书。
1.1.1 纳入标准(1)年龄21~43岁;(2)尿碘浓度(urinary iodine concentration,UIC)100~300 μg/L,即碘充足状态[8];(3)血清铁蛋白(serum ferritin,SF)≥
20 μg/L,即非铁缺乏者[9];(4)甲状腺功能正常,血清游离甲状腺素(free thyroxine,FT4)12.3~20.9 pmol/L [10]、血清促甲状腺素(thyroid stimulating hormone,TSH)0.10~4.34 mU/L[10];(5)未服用任何影响甲状腺功能的药物。
1.1.2 排除标准(1)患有AIT以外的其他甲状腺疾病及自身免疫病病史者;(2)患有高血压、糖尿病、子痫以及其他与流产相关的疾病病史者;(3)本次妊娠存在前置胎盘、胎盘早剥及早产者;(4)有影响流产的用药史者和有人工流产史者。
1.1.3 分组(1)本次纳入的孕妇均为甲状腺功能正常者,根据其是否患有AIT,进行分组。AIT组,血TPOAb≥34 IU/mL和(或)TgAb≥115 IU/mL[11];非AIT组,血TPOAb < 34 IU/mL和TgAb < 115 IU/mL。(2)根据既往和本次妊娠随访监测直至出现妊娠结局中是否发生过自然流产,再进行分组。流产组,本次随访研究中发生了自然流产和(或)既往发生过自然流产;非流产组,本次随访中和既往均未发生过自然流产。
按纳入及排除标准共纳入2 109名孕妇,按上述分组方式获得AIT流产组、非AIT流产组、AIT非流产组以及非AIT非流产组。同时,进一步以AIT流产组样本数为准并按孕妇所在城市、受教育背景、家庭收入进行1︰3匹配,确定AIT非流产组人数;以非AIT流产组为准,同样按照上述匹配方式确定非AIT非流产组人数。本研究最终共纳入661名孕妇,其中,AIT流产组58例,AIT非流产组152例,非AIT流产组107例,非AIT非流产组344例。见图 1。
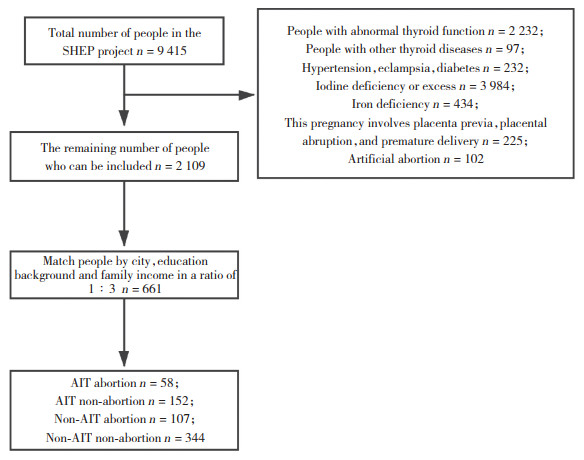
|
| 图 1 研究人群筛选标准方案图 Fig.1 Schematic diagram of study population screening criteria |
1.2 方法 1.2.1 甲状腺功能、甲状腺自身抗体、SF、UIC和尿肌酐测定:
血FT4、TSH、TPOAb、TgAb、SF和尿肌酐均采用电化学发光法(瑞士Roche公司)进行测定。根据指南[11]推荐,本研究利用SHEP项目入组孕妇,参考美国临床生化科学院推荐、在前期研究[10]中已建立的妊娠期特异参考范围,也是本研究血FT4和TSH所采用参考范围。同时,根据指南[11],TPOAb和TgAb阳性的确定采用试剂盒所提供的普通成人参考范围。UIC的测定采用基于Sandell-Kolthoff反应的过硫酸铵消化砷铈催化分光光度法[10],计算UIC与尿肌酐比值(UIC/Cr)以及体质量指数(body mass index,BMI)=体质量(kg)/身高2(m2)。
1.2.2 ENO1蛋白分子中参与纤溶酶原结合部位的一个抗原表位肽的预测及合成:利用IEDB网站和ABCpred网站对ENO1蛋白进行抗原表位预测。IEDB网站预测人源ENO1蛋白中第252~270氨基酸序列为一个线型表位,亦是ENO1作为纤溶酶原结合蛋白的一个抗原表位;ABCpred网站也预测出人ENO1蛋白中第252~267氨基酸序列为一个线性表位,分值均为0.9。选取氨基酸序列253~267依次为N端-rsgkydld fkspddp-C端(因处于预测的全部ENO1蛋白线性抗原表位肽段中的第9段,简称P9)。将预测出的P9抗原表位肽委托生工生物工程(上海)股份有限公司合成,并利用反相高效液相色谱法对合成肽段进行纯化,利用质谱分析确定氨基酸序列。
1.2.3 ENO1分子中P9抗原表位特异自身抗体血清水平的测定:利用酶联免疫吸附实验(ELISA),按照本研究组已建立的ENO1Ab检测方法进行测定[12]。利用浓度为1 mg/mL的P9肽段进行包被,4 ℃过夜;用1%BSA-PBS室温封闭2 h,加入待测血清(1︰1 000稀释),37 ℃孵育2 h;加入1︰5 000稀释HRP结合羊抗人IgG二抗,37 ℃孵育1 h;加入TMB显色,以OD450 nm反映血清P9特异性总IgG表达水平。
1.3 统计学分析采用SPSS 22.0软件进行统计学分析,利用该软件和1︰3倾向性评分匹配方法确定最终入组对象。对符合正态分布的连续变量,以x±s表示,2组间比较采用独立样本t检验;对不符合正态分布的连续变量,以M(P25~P75)表示,采用Mann-Whitney U秩和检验进行组间比较。分类变量事件发生率以百分数表示,并采用χ2检验比较。logistic回归分析P9特异性自身抗体是否为自然流产的独立危险因素。绘制受试者工作特征(receiver operating characteristic,ROC)曲线并计算曲线下面积(area under curve,AUC),以判断该抗体对流产的预测意义,并计算Youden指数以确定最佳切点值。P < 0.05为差异有统计学意义。
2 结果 2.1 对流产相关一般因素的比较分析比较流产组与非流产组妊娠年龄、体质量、BMI、心率、血压、有饮酒史或吸烟史者比率、血TSH、FT4、TPOAb、TgAb和SF水平、UIC/尿Cr以及L-T4干预率,结果显示,AIT流产组中L-T4干预率明显低于AIT非流产组(P = 0.003),而其他流产相关因素在2组间均无统计学差异。非AIT流产组的妊娠年龄、有饮酒史者的比率、血TSH和SF水平均明显高于非AIT非流产组(P值分别为0.016,0.026,0.006,0.043),其他相关上述指标在2组间均无统计学差异。见表 1。
| Related factors | Non-AIT | AIT | |||
| Non-abortion(n =344) | Abortion(n =107) | Non-abortion(n =152) | Abortion(n = 58) | ||
| Age(year) | 28.54±3.19 | 29.81±3.851) | 29.14±3.76 | 30.51±3.38 | |
| Weight(kg) | 58.25±12.09 | 58.30±8.78 | 57.61±8.71 | 58.91±9.29 | |
| BMI(kg/m2) | 21.67±4.04 | 21.92±3.16 | 21.39±3.99 | 21.87±2.90 | |
| Heart rate(beat/min) | 81.32±9.48 | 78.98±10.20 | 81.80±8.62 | 81.44±9.02 | |
| SBP(mmHg) | 114.01±11.21 | 114.03±10.28 | 117.68±11.62 | 114.71±10.92 | |
| DBP(mmHg) | 71.70±8.43 | 71.73±8.45 | 73.11±8.57 | 70.91±8.82 | |
| Smoking [ n(%)] | 7(2.03) | 4(3.74) | 3(1.97) | 1(1.72) | |
| Drinking [ n(%)] | 10(3.10) | 9(8.90)1) | 4(2.9) | 1(1.90) | |
| TSH(mIU/L) | 1.71(1.10-2.39) | 1.99(1.49-2.57)2) | 2.11(1.38-2.70) | 2.42(1.61-3.14) | |
| FT4(pmol/L) | 16.57(15.31-17.69) | 16.35(15.19-17.45) | 16.02(15.06-17.47) | 16.25(15.14-17.30) | |
| TPOAb(IU/L) | 7.62(5.00-11.61) | 6.84(5.00-9.86) | 63.62(9.77-233.50) | 42.85(11.03-186.90) | |
| TgAb(IU/mL) | 15.75(12.05-23.80) | 15.90(12.13-21.81) | 208.50(125.40-353.00) | 194.40(119.40-340.90) | |
| SF(μg/L) | 70.38(49.34-102.9) | 81.38(57.02-118.70)1) | 69.62(49.08-93.71) | 75.15(51.26-94.01) | |
| UIC/Cr | 0.97(0.77-1.32) | 1.09(0.84-1.42) | 0.93(0.70-1.17) | 1.03(0.79-1.42) | |
| P9Ab | 1.02(0.68-1.39) | 1.36(0.96-1.72)2) | 0.89(0.67-1.18) | 1.40(0.98-2.00)3) | |
| Taking L-T4[ n(%)] | - | - | 42(30.00) | 8(16.00)3) | |
| 1)P < 0.05,2)P < 0.01,vs non-AIT non-abortion;3)P < 0.01 vs AIT non-abortion. | |||||
2.2 血清P9特异性自身抗体表达分析
ELISA结果显示,AIT流产组孕早期血清P9特异性总IgG表达水平较AIT非流产组明显升高(P < 0.001);非AIT流产组亦明显高于非AIT非流产组(P < 0.001);AIT流产组较非AIT流产组有升高趋势,但差异无统计学意义(P > 0.05)。见图 2。
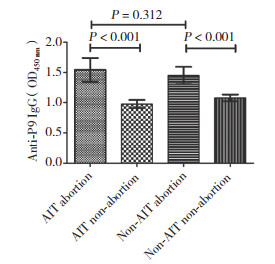
|
| 图 2 血清中抗ENO1蛋白分子中P9抗原表位肽特异自身抗体的表达水平分析 Fig.2 Analysis of the expression level of P9 epitope peptide-specific autoantibodies in serum anti-ENO1 protein molecules |
2.3 logistic回归分析P9特异性自身抗体表达与流产的关系
分别在AIT和非AIT孕妇中行logistic回归分析P9特异性自身抗体表达与流产是否独立相关。将AIT和非AIT人群中妊娠年龄与P9特异性自身抗体一同纳入回归分析中作为Model1(AIT:OR=7.13,95%CI:3.46~14.69,P < 0.05;非AIT:OR=2.67,95%CI:1.80~3.96,P < 0.05);将公认流产相关因素妊娠年龄、BMI及吸烟、饮酒与P9特异性自身抗体一同纳入回归分析中作为Model2(AIT:OR = 6.31,95%CI:3.00~13.29,P < 0.05;非AIT:OR = 2.81,95%CI:1.86~4.25,P < 0.05);最后将上述流产公认因素以及UIC/Cr、SF和TPOAb、TgAb、TSH及FT4与P9特异性自身抗体一同纳入回归分析中作为Model3(AIT:OR = 8.42,95%CI:3.71~19.09,P < 0.05;非AIT:OR = 2.92,95%CI:1.91~4.46),P < 0.05)。提示高滴度P9特异自身抗体的表达是导致甲状腺功能正常AIT孕妇和非AIT孕妇流产发生的一个独立危险因素。
2.4 ROC曲线分析P9特异性自身抗体的流产预测价值AIT孕妇中P9特异性自身抗体预测流产发生风险的AUC值为0.75±0.04(P < 0.001,图 3),非AIT孕妇中的AUC值为0.66±0.03(P < 0.001)。说明该抗体的血清表达水平在甲状腺功能正常的AIT孕妇中具有更好的流产预测价值。在AIT孕妇中该抗体血清水平预测自然流产发生风险显著增加的最佳切点值为OD450 nm=1.21(Youden指数为0.431),在非AIT中为OD450 nm=1.31(Youden指数为0.288)。在血清P9自身抗体检测水平OD450 nm > 1.21的AIT孕妇中,自然流产发生率为54.3%,而 < 1.21者仅为15.3%,二者有统计学差异(P < 0.001)。在该抗体血清水平 > 1.31的非AIT孕妇中,流产发生率为43.5%,而≤1.31者则为16.7%,二者也有统计学差异(P < 0.001)。进一步表明血清高滴度水平的P9特异性自身抗体与自然流产具有较强的相关性,尤其是在AIT孕妇中。
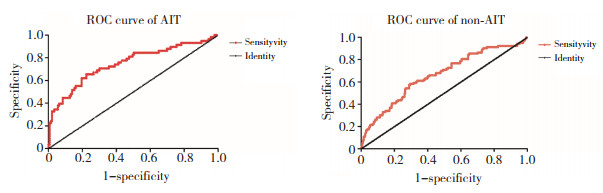
|
| 图 3 血清P9特异性自身抗体预测自发流产发生风险的受试者工作特征曲线 Fig.3 The receiver operating characteristic curve of serum P9-specific autoantibodies for predicting the risk of spontaneous abortion |
3 讨论
自然流产是妊娠期妇女常见的一种妊娠不良结局。研究[13]发现,甲状腺自身免疫与母体流产密切相关,但其机制尚不清楚。英国伦敦玛丽大学所做的系统回顾和荟萃分析显示,应用左旋甲状腺素干预可使自然流产的发生率减少52%[14]。但SUN等[15]的meta分析结果显示,给予甲状腺功能正常的AIT妊娠妇女左甲状腺素干预并未改善其妊娠不良结局。此外,甲状腺自身抗体可能也是AIT孕妇发生不明原因复发性流产的危险因素[16]。但研究[17]显示,在患有AIT的妇女中,具有正常妊娠史者与具有复发性自然流产史者相比,血TPOAb和TgAb并无统计学差异,故认为甲状腺自身抗体阳性与反复性自然流产无关。综上推测可能存在甲状腺功能减退和经典甲状腺自身抗体以外的因素促使AIT孕妇流产的发生率升高。
AIT虽然曾被认为是一种器官特异性自身免疫性疾病,但其患者体内存在某些非甲状腺特异自身抗体。研究[18]显示,甲状腺球蛋白(thyroglobulin,Tg)免疫可产生TgAb的同时,还可促使TPOAb等其他自身抗体的生成,这是由于Tg分子中B细胞抗原表位的扩散导致,而抗原扩散被认为是促进自身免疫病进展的一种机制[19]。本课题组前期动物实验研究结果也显示,给予小鼠Tg免疫不仅可引起其体内TgAb升高,也可促使ENO1Ab的产生增加。同样,给予小鼠ENO1重组蛋白免疫也可使机体产生ENO1Ab增加,并引起小鼠血清TgAb升高[12]。提示ENO1蛋白可能也是AIT致病机制中一个重要的自身抗原,尽管它并非甲状腺特异表达的蛋白。
ENO1已被发现在多种组织(如大脑、甲状腺、血管内皮、卵巢、胎盘等)中表达。最近的研究证实,在胎盘这个富含血管的组织部位确有较多量ENO1表达,并发现其表达可能与胎膜滞留有关。最新研究[7]发现,复发性流产患者胎盘蜕膜中ENO1蛋白表达量明显升高,认为血清抗ENO1Ab水平可作为不明原因的复发性流产的一种新的自身免疫生物标志物。除此之外,ENO1作为纤溶酶原结合蛋白可与纤溶酶原结合,促进其被激活成为纤溶酶,进而增强纤溶系统活性。在许多系统性自身免疫性疾病中,纤溶酶原结合蛋白抗原表位抗体的表达升高,后者可阻断纤溶酶原向纤溶酶转换,干扰体内纤溶系统,从而破坏纤维蛋白形成与溶解之间的动态平衡,可导致血栓前状态,并与自然流产密切相关[20]。AIT常与系统性自身免疫病伴发[21],故AIT妊娠妇女发生自然流产的机制很可能与自身免疫性疾病中诱发母体流产的机制存在相似之处。
韩冬等[22]利用噬菌体库展示技术结合Ellipro、PDB等生物信息学预测网络,发现人ENO1第257~268氨基酸可能是引起机体免疫应答的活性表位肽,此肽段特有的空间结构均有利于与抗体特异性结合。本研究的P9肽段完整包含了该肽段,且还是人ENO1蛋白发挥纤溶酶原结合作用的特殊肽段[23]。以上均提示P9肽段自身抗体可能通过干扰ENO1蛋白与纤溶酶原的结合而干扰纤溶系统的作用,导致流产风险的增加。本研究发现,AIT流产组血清抗P9自身抗体的表达水平明显高于AIT非流产组;非AIT流产组该抗体的表达水平亦明显高于非AIT非流产组。在AIT和非AIT妇女中,抗P9自身抗体均是引起自然流产的独立危险因素,但在AIT孕妇中具有更高预测流产风险的价值。血清中该抗体滴度水平检测对预测妇女(尤其是AIT孕妇)自然流产的风险具有一定临床意义。有必要对该抗体引起自然流产的作用机制进一步深入研究。同时,本课题组的前期研究[24]已发现,ENO1全蛋白特异总IgG在AIT患者血清中表达水平显著高于非AIT患者,提示ENO1蛋白分子中其他一些抗原决定簇特异的自身抗体可能也是促进AIT妇女流产风险增加的重要因素。
| [1] |
CATUREGLI P, DE REMIGIS A, ROSE NR. Hashimoto thyroiditis: clinical and diagnostic criteria[J]. Autoimmun Rev, 2014, 13(4/5): 391-397. DOI:10.1016/j.autrev.2014.01.007 |
| [2] |
STAGNARO-GREEN A, ABALOVICH M, ALEXANDER E, et al. Guidelines of the American Thyroid Association for the diagnosis and management of thyroid disease during pregnancy and postpartum[J]. Thyroid, 2011, 21(10): 1081-1125. DOI:10.1089/thy.2011.0087 |
| [3] |
CHEN MY, GILBERT N, LIU HX. Reduced expression of PD-L1 in autoimmune thyroiditis attenuate trophoblast invasion through ERK/MMP pathway[J]. Reproductive Biol Endocrinol, 2019, 17(1): 86. DOI:10.1186/s12958-019-0536-1 |
| [4] |
ADAMUS G. Impact of autoantibodies against glycolytic enzymes on pathogenicity of autoimmune retinopathy and other autoimmune disorders[J]. Front Immunol, 2017, 8: 505. DOI:10.3389/fimmu.2017.00505 |
| [5] |
ZHENG FH. Up-regulation of alpha-enolase (ENO1) by HIF-1α in retinal pigment epithelial cells after hypoxic challenge is not involved in the regulation of VEGF secretion[D]. Hongkong: The University of Hong Kong Libraries, 2014. DOI: 10.5353/th_b5388031.
|
| [6] |
BALDINI C, GIUSTI L, CIREGIA F, et al. Proteomic analysis of saliva: a unique tool to distinguish primary Sjögren's syndrome from secondary Sjögren's syndrome and other sicca syndromes[J]. Arthritis Res Ther, 2011, 13(6): R194. DOI:10.1186/ar3523 |
| [7] |
ZENG L, YANG K, LIU L, et al. Systematic biological and proteomics strategies to explore the regulation mechanism of Shoutai Wan on recurrent spontaneous Abortion's biological network[J]. J Ethnopharmacol, 2020, 263: 113156. DOI:10.1016/j.jep.2020.113156 |
| [8] |
LIU H, SHAN Z, LI C, et al. Maternal subclinical hypothyroidism, thyroid autoimmunity, and the risk of miscarriage: a prospective cohort study[J]. Thyroid, 2014, 24(11): 1642-1649. DOI:10.1089/thy.2014.0029 |
| [9] |
BREYMANN C, BIAN XM, BLANCO-CAPITO LR, et al. Expert recommendations for the diagnosis and treatment of iron-deficiency anemia during pregnancy and the postpartum period in the Asia-Pacific region[J]. J Perinat Med, 2011, 39(2): 113-121. DOI:10.1515/jpm.2010.132 |
| [10] |
LI C, PENG S, ZHANG X, et al. The urine iodine to creatinine as an optimal index of iodine during pregnancy in an iodine adequate area in China[J]. J Clin Endocrinol Metab, 2016, 101(3): 1290-1298. DOI:10.1210/jc.2015-3519 |
| [11] |
单忠艳. 妊娠和产后甲状腺疾病诊治指南: 中华医学会第十一次全国内分泌学学术会议论文集[C]. 广州: 2012.
|
| [12] |
LU Y, QIN J, XIANG Y, et al. Experimental evidence for alpha enolase as one potential autoantigen in the pathogenesis of both autoimmune thyroiditis and its related encephalopathy[J]. Int Immunopharmacol, 2020, 85: 106563. DOI:10.1016/j.intimp.2020.106563 |
| [13] |
MARIEE NG, TUCKERMAN E, LAIRD S, et al. The correlation of autoantibodies and uNK cells in women with reproductive failure[J]. J Reprod Immunol, 2012, 95(1/2): 59-66. DOI:10.1016/j.jri.2012.04.003 |
| [14] |
THANGARATINAM S, TAN A, KNOX E, et al. Association between thyroid autoantibodies and miscarriage and preterm birth: meta-analysis of evidence[J]. BMJ, 2011, 342: d2616. DOI:10.1136/bmj.d2616 |
| [15] |
SUN XD, HOU NN, WANG HS, et al. A meta-analysis of pregnancy outcomes with levothyroxine treatment in euthyroid women with thyroid autoimmunity[J]. J Clin Endocrinol Metab, 2020, 105(4): 1009-1019. DOI:10.1210/clinem/dgz217 |
| [16] |
CHEN X, JIN B, XIA J, et al. Effects of thyroid peroxidase antibody on maternal and neonatal outcomes in pregnant women in an iodine-sufficient area in China[J]. Int J Endocrinol, 2016, 2016: 6461380. DOI:10.1155/2016/6461380 |
| [17] |
ESPLIN MS, BRANCH DW, SILVER R, et al. Thyroid autoantibodies are not associated with recurrent pregnancy loss[J]. Am J Obstet Gynecol, 1998, 179(6 pt 1): 1583-1586. DOI:10.1016/s0002-9378(98)70029-8 |
| [18] |
THRASYVOULIDES A, LIAKATA E, LYMBERI P. Spreading of antibody reactivity to non-thyroid antigens during experimental immunization with human thyroglobulin[J]. Clin Exp Immunol, 2007, 147(1): 120-127. DOI:10.1111/j.1365-2249.2006.03246.x |
| [19] |
TUOHY VK, KINKEL RP. Epitope spreading: a mechanism for progression of autoimmune disease[J]. Arch Immunol Ther Exp (Warsz), 2000, 48(5): 347-351. |
| [20] |
YANG CD, HWANG KK, YAN W, et al. Identification of anti-plasmin antibodies in the antiphospholipid syndrome that inhibit degradation of fibrin[J]. J Immunol, 2004, 172(9): 5765-5773. DOI:10.4049/jimmunol.172.9.5765 |
| [21] |
BOCCUTI V, PERRONE A, D'INTRONO A, et al. An unusual association of three autoimmune disorders: celiac disease, systemic lupus erythematosus and Hashimoto's thyroiditis[J]. Autoimmun Highlights, 2016, 7(1): 1-3. DOI:10.1007/s13317-016-0079-9 |
| [22] |
韩冬, 王瑞玲, 韩魏巍, 等. 抗人α-烯醇化酶单克隆抗体的研制及其抗原识别表位初步鉴定[J]. 现代免疫学, 2015, 35(5): 393-398. |
| [23] |
KANG HJ, JUNG SK, KIM SJ, et al. Structure of human alpha-enolase (hENO1), a multifunctional glycolytic enzyme[J]. Acta Crystallogr D Biol Crystallogr, 2008, 64(6): 651-657. DOI:10.1107/s0907444908008561 |
| [24] |
张红梅, 秦娟, 项阳, 等. 抗α-烯醇化酶抗体在自身免疫性甲状腺炎中的表达[J]. 中国医科大学学报, 2016, 45(6): 499-502. DOI:10.12007/j.issn.0258-4646.2016.06.005 |
 2021, Vol. 50
2021, Vol. 50




