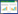文章信息
- 呼虹宇, 赵君爽, 李龙, 景治涛
- HU Hongyu, ZHAO Junshuang, LI Long, JING Zhitao
- 显微手术治疗侧脑室三角区肿瘤的疗效分析
- Curative effect of microsurgery for lateral ventricle trigone tumor
- 中国医科大学学报, 2021, 50(1): 76-80
- Journal of China Medical University, 2021, 50(1): 76-80
-
文章历史
- 收稿日期:2019-09-18
- 网络出版时间:2020-12-22 16:05
脑室内脑膜瘤占颅内脑膜瘤的0.5%~5%,其中侧脑室占80%,第三脑室占15%,第四脑室占5%[1]。侧脑室脑膜瘤中大部分肿瘤出现在侧脑室三角区,位于大脑深部,临近重要的皮质功能区(顶叶皮层中枢、颞叶的视神经辐射、优势半球的感觉语言中枢等)。位于侧脑室肿瘤大多生长缓慢,出现明显症状时肿瘤体积已较大,肿瘤全部切除的同时保护重要神经功能和相关的动静脉至关重要[2]。侧脑室肿瘤需要根据肿瘤周围结构解剖特点(视辐射、优势半球语言功能区、基底节、脉络丛动脉和脑深静脉等)、肿瘤位置、体积大小和生长方向选择正确的手术入路(经颞入路、顶枕入路、胼胝体后方入路)。研究[3]显示,神经导航和术中超声结合对于肿瘤暴露和供血动脉早期识别有很大帮助。本研究对我科2014年6月至2019年6月手术治疗的65例侧脑室三角区肿瘤患者临床资料进行分析,探讨显微镜下切除侧脑室三角区肿瘤的临床效果、手术入路选择及手术操作技巧。
1 材料与方法 1.1 临床资料选择2014年6月至2019年6月于我科行手术治疗的侧脑室三角区肿瘤患者65例。其中,男36例,女29例,年龄14~71岁,平均年龄(41.13±6.48)岁。病程数天至数月。术前颅内高压症状53例,视力、视野障碍9例,运动障碍6例。术后视力、视野障碍7例,癫痫4例,运动障碍2例,失语2例。颅脑CT平扫及颅脑增强磁共振检查结果显示,病变位于左侧侧脑室三角区39例,位于右侧侧脑室三角区26例。肿瘤直径范围2.6~7.2 cm,平均直径3.7 cm。其中侵犯胼胝体1例,偏向脑室体部3例,堵塞室间孔并合并脑积水3例,偏向枕角生长17例,偏向颞角生长19例,局限于三角区22例。
1.2 显微手术患者均在全身麻醉下实施手术,主刀医师均为有15年临床手术经验的主任医师。采用术中导航39例,未采用术中导航26例。46例患者采用俯卧位,19例采用侧俯卧位。肿瘤切除选择经胼胝体后部入路7例,颞中、颞下入路19例,顶枕皮质入路39例,见图 1~3。
|
| A,B,C,术前颅脑增强磁共振;D,术后颅脑增强磁共振. 图 1 颞叶入路切除肿瘤 |
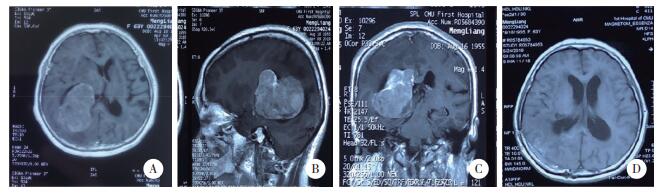
|
| A,术前颅脑增强磁共振;B,C,术中导航;D,术后颅脑增强磁共振. 图 2 顶枕入路术中导航下切除肿瘤 |
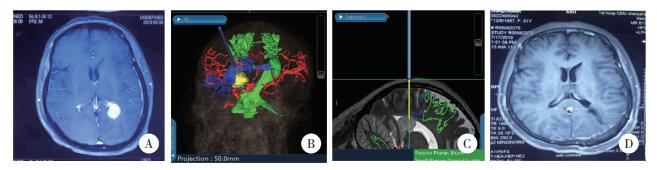
|
| A,B,C,术前颅脑增强磁共振;D,术后颅脑增强磁共振. 图 3 顶枕入路切除肿瘤 |
1.3 统计学分析
采用SPSS 22.0软件进行统计学分析。不同年龄、肿瘤直径、病理分型的术后GOS评分比较采用秩和检验,P < 0.05为差异有统计学意义。
2 结果结果显示,年龄≥42岁、肿瘤直径≥3.7 cm,病理分型为恶性的患者容易术后恢复不良。见表 1。
| 临床指标 | 术后GOS评分 | P | ||
| 5 | 3~4 | 1~2 | ||
| 年龄(岁) | 0.034 | |||
| < 42 | 27(41.54) | 3(4.62) | 0(0) | |
| ≥42 | 22(33.85) | 11(16.92) | 2(3.07) | |
| 病理分型 | 0.022 | |||
| 良性 | 35(53.85) | 3(4.62) | 1(1.54) | |
| 恶性 | 17(26.15) | 8(12.30) | 1(1.54) | |
| 肿瘤直径(cm) | 0.031 | |||
| < 3.7 | 28(43.08) | 5(7.69) | 0(0) | |
| ≥3.7 | 21(32.31) | 9(13.85) | 2(3.07) | |
2.1 术后病理结果
脑膜瘤37例(WHOⅠ级31例、WHOⅡ级5例、WHO Ⅲ级1例)、胶质瘤17例(WHOⅡ级6例、WHOⅢ级9例、WHOⅣ级2例),海绵状血管瘤4例,脉络丛乳头状瘤4例,转移癌3例。
2.2 肿瘤切除情况37例脑膜瘤患者均达到SimpsonⅠ级切除;17例胶质瘤中16例全部切除,1例部分切除;8例海绵状血管瘤及脉络丛乳头状瘤全部切除;3例转移癌中2例部分切除,1例转移癌活检。
2.3 术后并发症术后同向偏盲7例(术后均通过眼科治疗,其中3例偏盲症状好转,4例未见好转),癫痫4例(口服抗癫痫药物后均未复发),失语2例(2例均有运动性失语症,通过康复科语言练习逐渐好转),对侧肢体偏瘫2例(2例进入康复科肢体锻炼后好转)。4例术后出现颅内感染,其中3例行腰大池脑脊液引流,1例脑室外引流管注入万古霉素,感染均得到控制,预后良好。1例拔出脑室外引流管后出现脑积水,进行了脑室腹腔分流术,术后恢复良好。脑膜瘤1例术后1 d出现术区大面积异位血肿,急诊清除血肿并去除骨瓣,术后患者呼吸循环功能衰竭而死亡。
2.4 术后放化疗及随访患者术后均定期复查颅脑增强磁共振,脑膜瘤(WHOⅡ级和WHOⅢ级)6例,胶质瘤17例、转移癌3例术后均放化疗。平均随访15个月,脑膜瘤(WHOⅠ级)29例,脑膜瘤(WHOⅡ级)4例,海绵状血管瘤4例,脉络丛乳头状瘤3例,胶质瘤(WHOⅡ级)6例患者影像学上未见明显复发。3例(脑膜瘤WHOⅠ级2例,脉络丛乳头状瘤1例)失访。胶质瘤11例(WHOⅡ级9例,WHOⅢ级2例),转移癌3例,脑膜瘤(WHOⅡ级)2例复发。
3 讨论侧脑室三角区位置深且紧邻重要神经及血管结构,侧脑室三角区肿瘤切除手术对神经外科医生来说是巨大挑战。术前、术中在神经导航帮助下可以了解三角区病变体积大小、生长方向、不同主体位置、与周围脑组织结构关系,是否位于优势半球,从而选择最佳手术入路。然后通过良好的显微手术操作技巧,争取全部切除肿瘤的同时最大程度保护神经功能。
3.1 手术入路选择 3.1.1 经颞入路经颞入路包括颞中回、颞下回入路,适用于病变位于侧脑室三角区生长偏下且颞角扩大的病变。(1)颞中回入路,选取颞中回的中后1/3处,脑沟约3~4 cm的造瘘口,进入三角区,进行肿瘤切除。优点是操作者可以获得充分的操作空间,早期就可以处理脉络膜前动脉,阻断肿瘤供血。缺点是损伤视辐射、语言功能区,可能造成偏盲、失语等并发症[4]。该入路显露内侧静脉及脉络膜后动脉较晚,处理血管较为困难。(2)颞下回入路,从颅中窝的底部抬起颞下回,进入侧脑室三角区切除肿瘤。优点是可以减少对视辐射及优势半球语言功能区域的损伤。缺点是对颞叶牵拉较多,容易造成Labbe静脉损伤,影响脑血液回流,脑水肿加重[5]。本研究19例患者采取颞叶入路,其中选取颞中回入路17例,颞下回入路2例。
3.1.2 顶枕入路适用于肿瘤向枕角生长或局限于三角区内体积较小的肿瘤。以顶间沟作为手术入路的参照标志,皮层造瘘的大小主要根据肿瘤直径大小及生长方向,一般为3 cm左右。优点是通过顶间沟的解剖结构选择与肿瘤最短的距离手术入径,减少对角回及缘上回的损伤,降低术后视野缺损及优势半球语言障碍的发生率。缺点是不能早期处理肿瘤的供血脉络膜前动脉,有可能术中大出血,难以控制。然而在经过顶枕叶下部或顶颞叶交界处时切开皮质,虽然到达病变的距离缩短,但是增加了对视辐射、角回损伤的风险[6]。本研究39例采取顶枕入路。
3.1.3 胼胝体后方入路适用于病变位于优势半球、脉络丛后动脉供血或偏向内侧壁堵塞室间孔的肿瘤。经大脑后纵列切口胼胝体及透明隔,到达三角区的上部。优点是不需切开脑皮层,脉络膜后动脉易于处理,术中出血少,术野清晰,术后癫痫、视野缺损及语言功能障碍发生率低。缺点是术区操作空间较小,可能造成纵裂内的Galen静脉、丘纹静脉、胼周动脉及穹窿的损伤,可能引起记忆障碍、听觉和视觉失联合综合征[7]。本研究7例采取胼胝体后方入路。
3.2 术中神经导航应用由于长期肿瘤压迫,皮质或白质结构可能偏离正常的解剖位置,导致颅内结构重塑[8]。利用弥散张量成像(diffusion tensor imaging,DTI)的纤维跟踪技术来检测和定位重要的纤维束(视辐射和锥体束),将其导入神经导航系统,利用神经导航技术,使神经外科医生能够更准确定位[9]。本研究中对语言、运动和视力视野功能相关的区域进行了神经纤维重建。视力、视野是受三角区肿瘤影响最大的神经功能之一,这可能与视辐射受损有关。当病变位于侧脑室三角区时,侧脑室壁不可避免地受到压迫或破坏,视辐射也可能在病变生长时受到侵蚀。然而有研究[10]表明使用神经导航技术在语言功能保留方面无显著差异。利用神经导航定位Wernicle区和弓状束,使神经外科医生可以设计一种优化的手术入路,将脑组织损伤降到最低。术前行颅脑磁共振平扫、磁共振血管成像(magnetic resonance angiography,MRA)、DTI,术中经神经导航系统进行三维重建,术者可以观察到病变与颅内重要神经血管结构及纤维束的关系,并可以看到皮层与病变的关系,从而更容易达到完全切除。术中导航定位、准确性是核心问题。术前所获得的颅脑导航资料是在颅脑完全封密的状态下得到的,但是在术中应用高渗性液体时,脑脊液减少。剪开硬脑膜切除肿瘤时,脑脊液会流出,颅内压力下降,脑组织结构位置会改变,此时术中导航必然会降低手术的精准度(称为“术中漂移”)[11]。目前,一些新技术(使用术中超声可以动态显示残余肿瘤的位置及已经变换位置的深部血管,减少了脑移位、术中的偏差[12])可以减少术中漂移。应用术中低磁场颅脑磁共振平扫可以实时获得手术信息,显示出切除肿瘤后脑组织变形的图像,及时纠正误差,弥补术中漂移[13]。
3.3 良好的显微手术技巧有助于改善预后侧脑室三角区肿瘤大部分为良性,多数的占位病变可以达到完全切除。因此,提高显微手术技巧最大程度切除病变并保留神经功能对患者预后有利。显微手术技巧包括:(1)通过术中导航选取最佳皮质入口,在切除病变过程中避开皮质功能区。(2)注意保护丘纹静脉,丘纹静脉对静脉回流十分重要,若损伤则使用大量纤丝或明胶海绵填压止血,但可能会造成脑水肿、脑梗死。(3)对于直径 < 3 cm肿瘤,电凝肿瘤使整体缩小,进而便于整体切除;对于直径≥3 cm肿瘤,应采取分块切除,减少对脉络丛及脑室壁的损伤。(4)减少肿瘤组织出血,防止血液流入脑室内。用大量37 ℃生理盐水加抗生素反复冲洗脑室,直至脑室内的脑脊液呈清澈,以免肿瘤组织和积血进入脑室内系统,造成脑室壁粘连及室间孔及蛛网膜颗粒堵塞、脑脊液吸收障碍,造成术后高热及脑积水[14]。(5)对于残余肿瘤造成室间孔阻塞引起脑积水时,可以打通透明隔,也可以电凝脉络丛减少脑脊液分泌[15]。
综上所述,颅内侧脑室三角区占位病变手术切除程度关系到预后。完整切除肿瘤以及减少术后并发症可以保证术后患者预后良好。侧脑室有一定的容纳能力,当出现明显症状时肿瘤体积已经很大,可能压迫或侵犯大脑实质。术前影像学检查及术中使用神经导航技术可以帮助神经外科医师完整切除肿瘤,减少并发症以及对正常神经组织的损伤。高龄、肿瘤直径过大、肿瘤恶性程度高是患者预后的影响因素。利用神经导航技术选择最佳手术入路,良好显微手术操作技巧有利于完全切除肿瘤,减少术后并发症,提高患者生活质量。
| [1] |
LOUIS DN, PERRY A, REIFENBERGER G, et al. The 2016 world health organization classification of tumors of the central nervous system:a summary[J]. Acta Neuropathol, 2016, 131(6): 803-820. DOI:10.1007/s00401-016-1545-1 |
| [2] |
TANAKA T, KATO N, ARAI T, et al. Hemangiopericytoma in the trigone of the lateral ventricle[J]. Neurol Med Chir (Tokyo), 2011, 51(5): 378-382. DOI:10.2176/nmc.51.378 |
| [3] |
AGARWAL A, KANEKAR S. Intraventricular tumors[J]. Semin Ultrasound CT MRI, 2016, 37(2): 150-158. DOI:10.1053/j.sult.2015.12.003 |
| [4] |
许百男, 陈晓雷. 精准神经外科:微侵袭神经外科新理念[J]. 中华外科杂志, 2011, 49(8): 676-678. DOI:10.3760/cma.j.issn.0529-5815.2011.08.002 |
| [5] |
刘羽, 谢涛, 毛峰, 等. 角回后方皮层入路显微手术切除侧脑室三角区脑膜瘤[J]. 中国临床神经外科杂志, 2016, 21(11): 667-669. DOI:10.13798/j.issn.1009-153X.2016.11.005 |
| [6] |
SUN C, XIE T, ZHANG X, et al. To repeat or to recreate:a contralateral posterior interhemispheric transfalcine transprecuneus approach for recurrent meningiomas at the trigone of the lateral ventricle[J]. J Clin Neurosci, 2014, 21(11): 1968-1972. DOI:10.1016/j.jocn.2014.03.030 |
| [7] |
冯松山, 曾瑜, 黄正, 等. 侧脑室肿瘤的显微手术治疗策略[J]. 国际神经病学神经外科学杂志, 2016, 43(4): 314-318. DOI:10.16636/j.cnki.jinn.2016.04.007 |
| [8] |
黄进, 张岩松, 周志敏, 等. 多模态神经导航联合电生理技术在颅底肿瘤中的应用[J]. 南京医科大学学报(自然科学版), 2014, 34(12): 1684-1686, 1689. DOI:10.7655/NYDXBNS20141213 |
| [9] |
胡先超, 张少军, 韩易, 等. DTT成像联合神经导航在脑功能区肿瘤手术中的应用[J]. 中国微侵袭神经外科杂志, 2017, 22(3): 119-122. DOI:10.11850/j.issn.1009-122X.2017.03.007 |
| [10] |
FENG R, HU J, WU JS, et al. Comprehensive preoperative work-up and surgical treatment of low grade tumor/benign lesion related temporal lobe epilepsy[J]. J Clin Neurosci, 2017, 39: 203-208. DOI:10.1016/j.jocn.2017.01.013 |
| [11] |
GASSER T, SZELENYI A, SENFT C, et al. Intraoperative MRI and functional mapping[J]. Acta Neurochir Suppl, 2011, 109: 61-65. DOI:10.1007/978-3-211-99651-5_10 |
| [12] |
高莹, 石鑫, 杨磊, 等. 不同级别胶质瘤术中常规超声及超声造影声像图特征分析[J]. 中华临床医师杂志(电子版), 2013, 7(20): 9076-9080. DOI:10.3877/cma.j.issn.1674-0785.2013.20.017 |
| [13] |
MANGALORE S, ARYAN S, PRASAD C, et al. Imaging characteristics of supratentorial ependymomas:study on a large single institutional cohort with histopathological correlation[J]. Asian J Neurosurg, 2015, 10(4): 276-281. DOI:10.4103/1793-5482.162702 |
| [14] |
王光华, 马骏, 程令刚, 等. 侧脑室三角区脑膜瘤的手术治疗(附44例报告)[J]. 中华神经外科杂志, 2013, 29(5): 441-445. DOI:10.3760/cma.j.issn.1001-2346.2013.05.003 |
| [15] |
王晓东, 张恒柱. 侧脑室三角区肿瘤相关手术入路的研究进展[J]. 中国微侵袭神经外科杂志, 2015, 20(2): 94-96. DOI:10.11850/j.issn.1009-122X.2015.02.016 |
 2021, Vol. 50
2021, Vol. 50