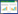文章信息
- 肖琦琪, 李智, 石晶, 赵雷, 魏翘楚, 滕月娥
- XIAO Qiqi, LI Zhi, SHI Jing, ZHAO Lei, WEI Qiaochu, TENG Yuee
- 基于HER2阳性晚期乳腺癌患者预后因素分析的回顾性研究及预后模型的建立
- Retrospective analysis of prognostic factors and establishment of a prognostic model for patients with HER2-positive advanced breast cancer
- 中国医科大学学报, 2021, 50(1): 57-62
- Journal of China Medical University, 2021, 50(1): 57-62
-
文章历史
- 收稿日期:2020-03-31
- 网络出版时间:2020-12-22 9:02
乳腺癌是发生在乳腺上皮组织的恶性肿瘤,其发病率居女性恶性肿瘤的第1位[1-2]。曲妥珠单抗是一种HER2阳性乳腺癌特异性靶向治疗药。大量研究[3-4]显示,曲妥珠单抗联合化疗能够改善HER2阳性晚期乳腺癌的生存,但临床实践中并非所有患者应用曲妥珠单抗治疗都有效[5-6],大约60%患者存在曲妥珠单抗的原发耐药[7]。目前,除了HER2表达,尚缺乏预测HER2阳性晚期乳腺癌疗效的生物学标记物。如何综合评估HER2阳性晚期乳腺癌预后,筛选预后不良因素并指导个体化治疗,已成为临床医生亟待解决的重大问题。
列线图可将复杂的回归方程转化为简单直观的图形,在医学研究和临床实践中得到越来越多的重视和应用[8-9]。本研究主要针对应用曲妥珠单抗治疗的HER2阳性晚期乳腺癌患者,运用Cox单因素及多因素分析,对影响其预后的独立因素进行筛选,并建立预后模型。同时运用列线图将其可视化,通过列线图模型预测HER2阳性乳腺癌患者的预后,为个体化治疗策略的制定提供依据。
1 材料与方法 1.1 研究对象选取2002年12月至2018年12月中国医科大学肿瘤内科收治的乳腺癌晚期患者1 728例。纳入标准:(1)年龄18~75周岁;(2)乳腺肿物穿刺或手术病理组织学证实为浸润性乳腺癌;(3)原发灶为HER2阳性乳腺癌;(4)除乳腺原发灶外,存在远隔部位转移;(5)曲妥珠单抗治疗 > 3个月;(6)临床信息完整(病理诊断明确、HER2表达明确、复发或转移后治疗情况明确、系统完整的随访基本信息)。排除标准:(1)局部晚期乳腺癌或乳腺癌局部区域复发;(2)男性乳腺癌;(3)乳腺癌合并有其他恶性肿瘤;(4)年龄 > 75岁;(5)存在心脏、肝脏、肾脏等严重合并症。根据入排标准统计得出乳腺癌合并其他恶性肿瘤31例,男性乳腺癌6例,年龄 > 75岁18例,HER2阴性乳腺癌1 256例,非浸润癌34例,局部晚期乳腺癌131例,临床资料缺失28例,最终224例病例资料纳入分析。
1.2 研究方法收集一般资料,包括姓名、年龄、乳腺癌家族史、ECOG评分、诊断时的月经状况等;收集临床病理资料,包括病理类型、淋巴结转移、免疫组化ki-67、HER2、组织学分级等;收集治疗信息,包括辅助治疗和一线治疗是否应用了曲妥珠单抗、曲妥珠单抗的用药时长及既往有无蒽环或紫衫类化疗;总体生存(overall survival,OS)起止时间定义为确诊为乳腺癌复发至患者死亡或随访终止的时间。每3个月进行1次电话随访,终止日期为2019年8月31日。
激素受体(hormone receptor,HR)阳性[10]为ER和/或PR免疫组化≥1%表达。HER2阳性[11]判定标准:(1)标准免疫组化检测HER2为“3+”;(2)标准免疫组化学检测为“2+”时,需进一步完善FISH检测,根据2013年ASCO/CAP标准,HER2/CEP17≥2.0或HER2基因拷贝数≥6,则HER2为阳性。
1.3 统计学分析所有数据均采用SPSS r26.0.0.0软件进行分析。Cox风险比例模型用于操作系统影响OS的单因素和多因素分析。生存曲线采用Kaplan-Meier曲线(log- rank检验)。P < 0.05为差异有统计学意义。应用R软件(http://www.R-project.org)建立列线图预后模型。列线图中代入Cox风险比模型中多因素分析的独立预后因素。内部验证采用1 000次bootstrap自抽样方法,衡量该模型的预测精度使用一致性系数(concordance index,C-index)[12]。C-index的范围为0.5~1,完全一致用1表示,提示实际结果与预测模型完全一致,完全不一致用0.5表示,提示模型的预测能力较差。将实际生存概率和预测生存概率进行比较,得到校准曲线。较正曲线越靠近对角线,预测模型的符合度越高。
2 结果 2.1 一般临床资料截至2019年8月31日,224例患者的中位随访时间为30个月(随访时间范围为4~162个月)。相关临床病理基本特征情况见表 1。
| Clinicopathological feature | n(%) |
| Age(year) | |
| ≤50 | 116(51.79) |
| > 50 | 108(48.21) |
| Menstruation | |
| Not menopause | 81(36.16) |
| Menopause | 143(63.84) |
| Family history | |
| No | 211(94.20) |
| Yes | 13(5.80) |
| ECOG | |
| 0 | 16(7.14) |
| 1 | 201(89.73) |
| 2-3 | 7(3.13) |
| Invasive carcinoma type | |
| Invasive ductal carcinoma | 206(91.96) |
| Invasive lobular carcinoma or other mixed invasive carcinoma | 18(8.04) |
| T Stage | |
| T1 | 53(23.66) |
| T2 | 121(54.02) |
| T3 | 32(14.28) |
| T4 | 14(6.25) |
| NA | 4(1.79) |
| N Stage | |
| 0 | 26(11.61) |
| 1 | 51(22.77) |
| 2 | 83(37.05) |
| 3 | 48(21.43) |
| NA | 16(7.14) |
| Histological grade | |
| Ⅰ | 11(4.91) |
| Ⅱ | 156(69.64) |
| Ⅲ | 35(15.63) |
| NA | 22(9.82) |
| HR | |
| Negative | 105(46.88) |
| Positive | 119(53.12) |
| Ki-67 | |
| ≤20% | 58(25.89) |
| > 20% | 134(59.82) |
| NA | 32(14.29) |
| HER2(immunohistochemistry) | |
| 2 | 92(41.07) |
| 3 | 132(58.93) |
| Hepatic metastasis | |
| No | 153(68.30) |
| Yes | 71(31.70) |
| Pulmonary metastasis | |
| No | 143(63.84) |
| Yes | 81(36.16) |
| Non-visceral metastasis | |
| No | 132(58.93) |
| Yes | 92(41.07) |
| Number of metastatic sites | |
| < 3 | 161(71.88) |
| ≥3 | 63(28.12) |
| DFS(month) | |
| ≤24 | 141(62.90) |
| > 24 | 83(37.10) |
| Whether trastuzumab is first-line medication | |
| No | 77(34.37) |
| Yes | 147(65.63) |
| Line number of trastuzumab for the first time | |
| < 3 | 199(88.84) |
| ≥3 | 25(11.16) |
| Duration of trastuzumab(month) | |
| < 6 | 58(25.89) |
| 6-12 | 113(50.45) |
| > 12 | 53(23.66) |
| Whether to apply lapatinib or pyrotinib | |
| No | 173(77.23) |
| Yes | 51(22.77) |
| Whether to apply paclitaxel or anthracycline chemotherapy | |
| No | 6(2.68) |
| Yes | 218(97.32) |
2.2 影响OS预后因素的分析
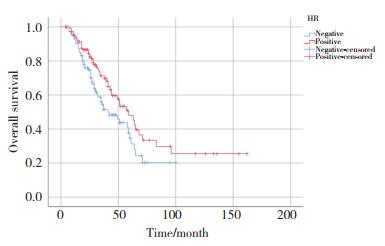
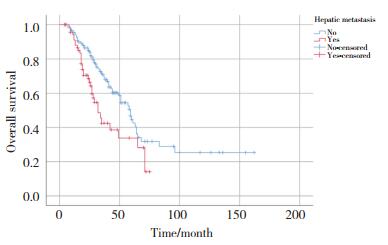
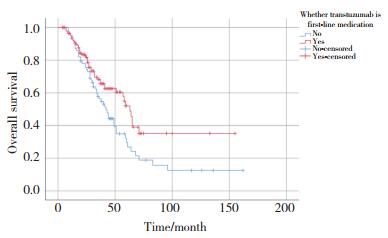
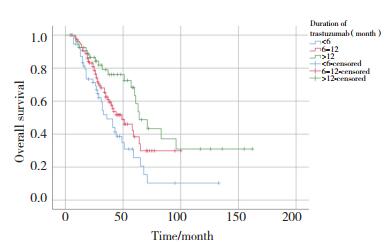
单因素及多因素分析结果显示,肿瘤的N分期(P = 0.013)、HR状态(P = 0.035)、是否发生肝转移(P = 0.007)、无病生存期(disease free survival,DFS)(P < 0.001)、一线治疗是否应用曲妥珠单抗(P = 0.007)以及曲妥珠单抗治疗时长(P = 0.019)与HER2阳性晚期乳腺癌患者的OS有关(表 2)。其中HR状态(P = 0.027),是否发生肝转移(P = 0.038),一线治疗是否应用曲妥珠单抗(P = 0.001)以及曲妥珠单抗治疗时长(P = 0.028)为影响HER2阳性晚期乳腺癌患者OS的独立预后因素,见表 3,图 1~4。
| Clinicopathological feature | Univariate Cox analysis | ||
| HR | 95%CI | P | |
| Age | 1.01 | 0.99-1.04 | 0.162 |
| Menstruation | 1.01 | 0.67-1.52 | 0.963 |
| Family history | 1.02 | 0.47-2.20 | 0.968 |
| ECOG | 1.29 | 0.74-2.25 | 0.371 |
| Invasive carcinoma type | 0.95 | 0.67-1.35 | 0.768 |
| T Stage | 1.11 | 0.89-1.37 | 0.366 |
| N Stage | 1.22 | 1.04-1.43 | 0.013 |
| Histological grade | 1.33 | 0.92-1.94 | 0.131 |
| HR | 0.65 | 0.44-0.97 | 0.035 |
| Ki-67 | 0.85 | 0.57-1.28 | 0.432 |
| HER2 | 0.92 | 0.66-1.28 | 0.627 |
| Hepatic metastasis | 1.75 | 1.17-2.64 | 0.007 |
| Pulmonary metastasis | 1.00 | 0.67-1.51 | 0.987 |
| Non-visceral metastasis | 0.82 | 0.55-1.22 | 0.322 |
| Number of metastatic sites | 1.08 | 0.81-1.23 | 0.680 |
| DFS | 0.46 | 0.30-0.71 | < 0.001 |
| Whether trastuzumab is first-line medication | 0.58 | 0.39-0.86 | 0.007 |
| Line number of trastuzumab for the first time | 1.55 | 0.84-2.85 | 0.159 |
| Duration of trastuzumab | 0.72 | 0.55-0.95 | 0.019 |
| Whether to apply lapatinib or pyrotinib | 0.74 | 0.53-1.16 | 0.235 |
| Whether to apply paclitaxel or anthracycline chemotherapy | 1.08 | 0.92-1.34 | 0.438 |
| Clinicopathological feature | Multivariate Cox analysis | ||
| HR | 95%CI | P | |
| N stage | 1.17 | 0.98-1.39 | 0.085 |
| HR | 0.62 | 0.40-0.95 | 0.027 |
| Hepatic metastasis | 1.57 | 1.03-2.41 | 0.038 |
| DFS | 0.64 | 0.39-1.03 | 0.064 |
| Whether trastuzumab is first-line medication | 0.49 | 0.33-0.74 | 0.001 |
| Duration of trastuzumab | 0.74 | 0.56-0.97 | 0.028 |
|
| 图 1 HR影响OS的Kaplan-Meier曲线 Fig.1 Kaplan-Meier curve of HR affecting OS |
|
| 图 2 肝转移影响OS的Kaplan-Meier曲线 Fig.2 Kaplan-Meier curve of hepatic metastasis affecting OS |
|
| 图 3 一线治疗采用曲妥珠单抗影响OS的Kaplan-Meier曲线 Fig.3 Kaplan-Meier curve of whether trastuzumab is first-line medication affecting OS |
|
| 图 4 抗HER2治疗时长影响OS的Kaplan-Meier曲线 Fig.4 Kaplan-Meier curve of the duration of trastuzumab affecting OS |
2.3 建立OS列线图预后模型
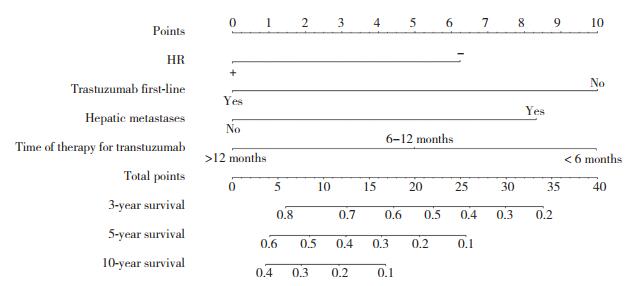
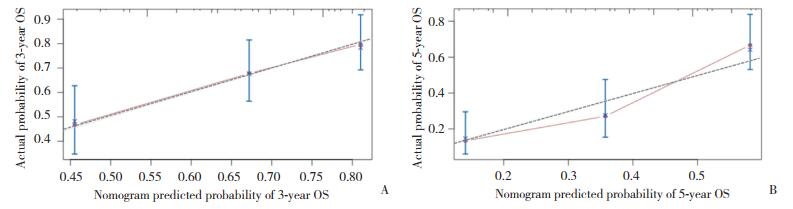
将多因素分析得到的独立预后因素列为输入变量引入列线图预后模型。输出变量为总分,3年、5年及10年的OS(图 5)。总分值越小代表 3年、5年及10年的总体生存概率越大,反之越小。经计算,本研究所建的列线图模型C-index为0.779。证明本研究的列线图分辨率较好。横坐标为Cox风险比模型计算的预测生存概率,纵坐标为实际生存概率,将横纵坐标进行比较,得到校正曲线。该预测模型与实际情况吻合程度较高(图 6)。
|
| 图 5 OS列线图模型 Fig.5 Nomogram model of OS |
|
| A, 3-year; B, 5-year. 图 6 HER2阳性晚期乳腺癌患者复发后OS列线图校正曲线 Fig.6 OS nomogram calibration curve after recurrence in patients with HER2-positive advanced breast cancer |
3 讨论
本研究属于单中心回顾性研究,利用实际临床数据获得便捷的预后因素分析模型。分析HER2阳性晚期乳腺癌患者曲妥珠单抗治疗的预后与临床病理特征之间的关联,筛选独立预后因素。通过Cox单因素与多因素分析,结果显示,HR表达(P = 0.027)、肝转移(P = 0.038)、一线治疗应用曲妥珠单抗(P = 0.001)以及曲妥珠单抗治疗时长(P = 0.028)为影响HER2阳性晚期乳腺癌患者OS的独立预后因素。
远处转移是绝大部分乳腺癌死亡的最直接原因。其中肝转移及脑转移整体预后差,中位生存期短[13-14]。本研究发现,即使是经过曲妥珠单抗治疗的患者肝转移仍然是复发后OS的独立预后因素,提示内脏转移在HER2阳性晚期乳腺癌的预后价值。HR的表达状态是影响乳腺癌预后的重要因素。MURTHY等[13]的相关研究指出,HR阳性与统计学上较长的OS相关。本研究结果显示,HR表达水平是影响HER2阳性晚期乳腺癌患者复发后OS的独立预后因素,与既往的研究结果一致。
目前一些临床试验证明了曲妥珠单抗治疗HER2阳性乳腺癌的有效性与安全性,可明显改善患者的预后。SWAIN等[15]的CLEOPATRA研究表明,应用曲妥珠单抗联合帕妥珠单抗及多西他赛治疗对延长HER2阳性乳腺癌患者的OS具有积极作用。与以往报道不同的是,本研究对象是晚期应用曲妥珠单抗治疗的人群,研究终点为患者复发后的总体生存。结果发现曲妥珠单抗的使用时长及曲妥珠单抗是否为一线用药对延长HER2阳性晚期乳腺癌患者的生存时间起到了积极的作用。由此可见,在临床应用中,曲妥珠单抗的尽早尽长的使用对于延缓疾病进展,提高患者生存时长具有重要意义。
然而,本研究在一定程度上存在局限性。本研究样本量有限,列线图模型缺少大样本的外部验证,对研究结果的准确性和可靠性产生影响。由于在本研究期间帕妥珠单抗尚未在中国上市,未收集应用帕妥珠单抗治疗的患者,对患者的总体生存产生一定影响。此外,本研究收集患者年度跨度大,部分早年患者Ki-67、T分期、N分期及组织学分级出现了数据缺失的情况,也可能对研究结果产生一定影响。
| [1] |
SIEGEL RL, MILLER KD, JEMAL A. Cancer statistics, 2016[J]. CA:A Cancer J Clin, 2016, 66(1): 7-30. DOI:10.3322/caac.21332 |
| [2] |
TORRE LA, BRAY F, SIEGEL RL, et al. Global cancer statistics, 2012[J]. CA:A Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [3] |
ROMOND EH, PEREZ EA, BRYANT J, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer[J]. N Engl J Med, 2005, 353(16): 1673-1684. DOI:10.1056/NEJMoa052122 |
| [4] |
BLUMENTHAL GM, SCHER NS, CORTAZAR P, et al. First FDA approval of dual anti-HER2 regimen:pertuzumab in combination with trastuzumab and docetaxel for HER2-positive metastatic breast cancer[J]. Clin Cancer Res, 2013, 19(18): 4911-4916. DOI:10.1158/1078-0432.CCR-13-1212 |
| [5] |
TOLANEY SM, GUO H, PERNAS S, et al. Seven-year follow-up analysis of adjuvant paclitaxel and trastuzumab trial for node-negative, human epidermal growth factor receptor 2-positive breast cancer[J]. J Clin Oncol, 2019, 37(22): 1868-1875. DOI:10.1200/jco.19.00066 |
| [6] |
CAMERON D, PICCART-GEBHART MJ, GELBER RD, et al. 11 years' follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer:final analysis of the HERceptin adjuvant (HERA) trial[J]. Lancet, 2017, 389(10075): 1195-1205. DOI:10.1016/S0140-6736(16)32616-2 |
| [7] |
HAN ML, GU YT, LU PW, et al. Exosome-mediated lncRNA AFAP1-AS1 promotes trastuzumab resistance through binding with AUF1 and activating ERBB2 translation[J]. Mol Cancer, 2020, 19: 26. DOI:10.1186/s12943-020-1145-5 |
| [8] |
LIANG WH, ZHANG L, JIANG GN, et al. Development and validation of a nomogram for predicting survival in patients with resected non-small-cell lung cancer[J]. J Clin Oncol, 2015, 33(8): 861-869. DOI:10.1200/jco.2014.56.6661 |
| [9] |
SUN W, JIANG YZ, LIU YR, et al. Nomograms to estimate long-term overall survival and breast cancer-specific survival of patients with luminal breast cancer[J]. Oncotarget, 2016, 7(15): 20496-20506. DOI:10.18632/oncotarget.7975 |
| [10] |
LAMBERT JM, CHARI RVJ. Ado-trastuzumab emtansine (T-DM1):an antibody-drug conjugate (ADC) for HER2-positive breast cancer[J]. J Med Chem, 2014, 57(16): 6949-6964. DOI:10.1021/jm500766w |
| [11] |
WOLFF AC, HAMMOND MEH, HICKS DG, et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer:American society of clinical oncology/college of American pathologists clinical practice guideline update[J]. J Clin Oncol, 2013, 31(31): 3997-4013. DOI:10.1200/JCO.2013.50.9984 |
| [12] |
WITTENBECHER C, ŠTAMBUK T, KUXHAUS O, et al. Plasma N-glycans as emerging biomarkers of cardiometabolic risk:a prospective investigation in the EPIC-Potsdam cohort study[J]. Diabetes Care, 2020, 43(3): 661-668. DOI:10.2337/dc19-1507 |
| [13] |
MURTHY P, KIDWELL KM, SCHOTT AF, et al. Clinical predictors of long-term survival in HER2-positive metastatic breast cancer[J]. Breast Cancer Res Treat, 2016, 155(3): 589-595. DOI:10.1007/s10549-016-3705-3 |
| [14] |
FERETIS M, SOLODKYY A. Yttrium-90 radioembolization for unresectable hepatic metastases of breast cancer:a systematic review[J]. World J Gastro Oncol, 2020, 12(2): 228-236. DOI:10.4251/wjgo.v12.i2.228 |
| [15] |
SWAIN SM, KIM SB, CORTÉS J, et al. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA study):overall survival results from a randomised, double-blind, placebo-controlled, phase 3 study[J]. Lancet Oncol, 2013, 14(6): 461-471. DOI:10.1016/S1470-2045(13)70130-X |
 2021, Vol. 50
2021, Vol. 50