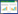文章信息
- 王翠翠, 马晓欣
- WANG Cuicui, MA Xiaoxin
- 基于网络药理学探讨当归-菟丝子治疗多囊卵巢综合征的作用靶标和信号通路
- Mechanisms of polycystic ovary syndrome treatment using Angelicae Sinensis Radix-Cuscutae Semen based on network pharmacology
- 中国医科大学学报, 2021, 50(1): 51-56
- Journal of China Medical University, 2021, 50(1): 51-56
-
文章历史
- 收稿日期:2019-12-25
- 网络出版时间:2020-12-22 9:18
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期女性最常见的妇科内分泌疾病,通常表现为高雄激素血症和排卵障碍。其病因尚不明确,可能是遗传因素与环境因素共同作用的结果。临床上主要采取个性化的对症治疗,以达到满足生育要求、缓解临床症状的目的。从中医角度,PCOS辨证多为脏腑功能失调、痰淤阻滞、虚实夹杂,临床常见有肾虚、痰湿、气血淤滞、肝经郁热等类型,故现代医者多从肾、脾、肝论治PCOS,在调节脏腑功能同时,注重活血燥湿化痰,从而使气血正常运行,排卵如常,胞宫按时满溢[1]。借助中医传承辅助系统,得到治疗PCOS使用频率最高且药物组合频数最多的两味中药——当归和菟丝子[2]。当归味苦、温,无毒,首要功效是补气和血,最宜用于妇女月经不调。菟丝子甘、温,归肾、肝、脾经,具有滋补肝肾、固精缩尿、安胎、明目、止泻之功效。菟丝子还有雌激素样作用,可促进雌性动物卵巢和子宫发育,促进排卵[3],具体机制尚不明确。网络药理学是基于系统生物学的理论,对药物的有效成分进行多靶点、多途径的生物系统网络分析。本文运用网络药理学方法筛选当归-菟丝子两味中药的活性成分,预测其与PCOS相关的靶标与信号通路,构建疾病-药物-成分-靶标的网络,分析当归-菟丝子治疗PCOS可能涉及的作用靶标和信号通路。
1 材料与方法 1.1 当归-菟丝子活性成分的获取利用中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)检索当归和菟丝子两味药物所有的化学成分。根据药代动力学原理和平台推荐,在检索结果中限定口服生物利用度≥30%且类药性≥0.18,获得的化学成分作为当归和菟丝子两味中药的活性成分。
1.2 当归-菟丝子活性成分对应靶标的获取再次利用TCMSP检索当归和菟丝子所有活性成分对应的靶标,并通过Uniprot数据库(https://www.uniprot.org)获取候选靶标对应的基因ID。
1.3 PCOS疾病靶标的获取分别检索Genecards数据库(https://www.genecards.org)和基因疾病关联数据库(DisGeNET,http://www.disgenet.org)中与PCOS相关的靶基因,去重、合并,获得所有基因数据,将当归-菟丝子的活性成分对应的靶标与疾病的靶标共同映射绘制韦恩图,获得活性成分治疗PCOS的潜在作用靶标。
1.4 药物-成分-疾病靶标网络图构建运用Cytoscape软件(3.7.2版本)将药物-成分-疾病靶标的网络关系可视化,以进一步了解当归和菟丝子两味中药的活性成分与治疗PCOS潜在作用靶标的对应关系。
1.5 靶标蛋白相互作用网络构建将当归-菟丝子治疗PCOS潜在作用的靶蛋白导入蛋白质相互作用数据库(STRING,https://string-db.org),限定物种为人,产生蛋白-蛋白相互作用网络,设置最小蛋白间相互作用分值为0.9,将结果以TSV格式导出,并利用R语言(https://www.r-project.org)将每个潜在靶标的连接度进行排序,并以柱状图的形式列出前30位的关键靶标基因。
1.6 基因本体注释(gene ontology,GO)生物学过程及京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路分析将当归和菟丝子治疗PCOS的潜在靶标基因ID导入DAVID数据库[4](https://david.ncifcrf.gov/summary.jsp),进行GO和KEGG代谢通路富集分析。选取满足校正后P < 0.05且Q < 0.05的生物学过程和通路,并根据校正后的P值升序排序,选取前20条,使用R语言绘制柱状图。
2 结果 2.1 当归-菟丝子的活性成分及对应靶标从TCMSP中共获取当归的化学成分125种,菟丝子的化学成分29种。筛选出当归的活性成分2种,菟丝子的活性成分11种,重复1种,见表 1。同时,在数据库中获取当归和菟丝子活性成分的对应候选靶标共375个,其中菟丝子活性成分sophranol未找到相应靶标,故当归-菟丝子关键有效的活性成分共11种。
| ID | Name | OB(%) | DL | Source |
| MOL000358 | β-sitosterol | 36.91 | 0.75 | Angelicae Sinensis Radix |
| MOL000449 | Stigmasterol | 43.83 | 0.76 | Angelicae Sinensis Radix |
| MOL001558 | Sesamin | 56.55 | 0.83 | Cuscutae Semen |
| MOL000184 | NSC63551 | 39.25 | 0.76 | Cuscutae Semen |
| MOL000354 | Isorhamnetin | 49.60 | 0.31 | Cuscutae Semen |
| MOL000358 | β-sitosterol | 36.91 | 0.75 | Cuscutae Semen |
| MOL000422 | Kaempferol | 41.88 | 0.24 | Cuscutae Semen |
| MOL005043 | Campest-5-en-3β-ol | 37.58 | 0.71 | Cuscutae Semen |
| MOL005440 | Isofucosterol | 43.78 | 0.76 | Cuscutae Semen |
| MOL005944 | Matrine | 63.77 | 0.25 | Cuscutae Semen |
| MOL006649 | Sophranol | 55.42 | 0.28 | Cuscutae Semen |
| MOL000953 | CLR | 37.87 | 0.68 | Cuscutae Semen |
| MOL000098 | Quercetin | 46.43 | 0.28 | Cuscutae Semen |
| OB,oral bioavailability;DL,drug-likeness. | ||||
2.2 当归-菟丝子的活性成分治疗PCOS的潜在作用靶标预测
在Uniprots数据库中输入靶标名称,获得375个候选靶标的相应基因。将其与GeneCards数据库和DisGeNET数据库检索到的与PCOS疾病有关的靶基因相映射,用韦恩图筛选出当归-菟丝子治疗PCOS的潜在作用靶标共135个。
2.3 当归、菟丝子-活性成分-潜在作用靶标网络构建根据当归、菟丝子两味中药共包含的11种关键有效的活性成分,以及对应的135个与PCOS相关的潜在作用靶标,导入Cytoscape软件进行网络构建,并给予可视化展示。药物-活性成分-潜在作用靶标网络图共包括148个节点,其中当归-菟丝子的关键活性成分11种,与PCOS相关的135个潜在作用靶标形成382种对应关系,见图 1。其中红色代表疾病PCOS,黄色代表当归-菟丝子,紫色代表两味中药中关键有效的活性成分,绿色代表两味中药与疾病有关的潜在作用靶标,相连的线表示两味中药与有效活性成分、有效活性成分与疾病靶标的对应关系。
|
| 图 1 当归-菟丝子的关键活性成分与疾病靶标的网络 Fig.1 Network of the key active ingredients of Angelicae Sinensis Radix-Cuscutae Semen and the disease targets in PCOS |
2.4 当归-菟丝子靶标蛋白相互作用网络
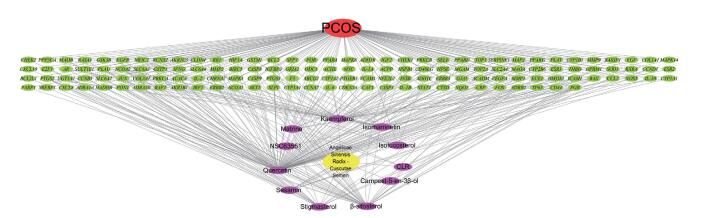
将当归-菟丝子中具有治疗PCOS作用的潜在作用靶标导入STRING数据库,从而获得蛋白质之间相互作用的网络图,共135个节点和418条边,结果以TSV文件导出,并利用R语言将每个靶标的邻接节点数进行统计排序,排名前30名的靶标用柱状图的形式进行可视化展示,见图 2。其中AKT1的邻接节点为29个,JUN邻接节点为28个,MAPK1的邻接节点为26个,IL-6的邻接节点为20个,雌激素受体1(estrogen receptor alpha,ESR1)的邻接节点为19个。说明这几个基因可能在蛋白质互作网络中发挥重要的作用,是当归-菟丝子治疗PCOS的关键基因。
|
| 图 2 当归-菟丝子治疗PCOS可能的关键基因 Fig.2 Bar graph of the key targets of Angelicae Sinensis Radix-Cuscutae Semen in PCOS |
2.5 GO生物学过程富集分析
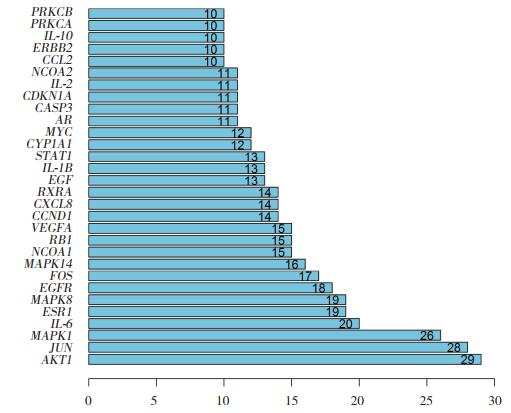
利用DAVID数据库对当归-菟丝子活性成分对应的潜在靶标进行生物学过程分析,见图 3。P值越小,说明当归-菟丝子治疗PCOS涉及该生物学过程的可能性越大。条形图中,颜色越红,P值越小,说明富集越明显。
|
| 图 3 当归-菟丝子治疗PCOS潜在作用靶标的GO富集 Fig.3 GO enrichment of the potential treatment targets of Angelicae Sinensis Radix-Cuscutae Semen |
2.6 KEGG通路富集分析
再次利用DAVID数据库对当归-菟丝子活性成分对应的潜在靶标进行通路分析,见图 4。条形图中,颜色越红,P值越小,富集越明显,说明此通路与治疗疾病的关系可能越大。
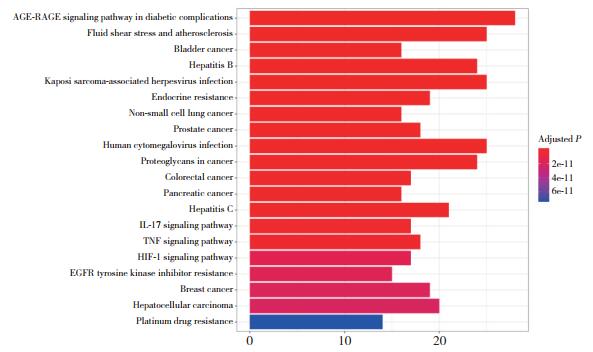
|
| 图 4 当归-菟丝子治疗PCOS潜在作用靶标的KEGG富集通路 Fig.4 KEGG pathway analysis of the potential treatment targets of Angelicae Sinensis Radix-Cuscutae Semen |
3 讨论
PCOS为妇科内分泌常见疾病,中医常以当归-菟丝子作为补肾活血药方之一用于治疗PCOS[5]。本研究利用数据库筛选出当归-菟丝子中11种有效活性成分,其中研究最多的是槲皮素。有研究[6]表明,与安慰剂组相比,槲皮素可增加PCOS患者血清脂联素水平,降低血糖、胰岛素、胆固醇和甘油三酯水平,降低体内雄激素和黄体生成素水平,改善脂联素介导的胰岛素抵抗和异常的激素水平。在脱氢表雄酮诱导的PCOS小鼠模型中,有学者发现槲皮素可显著降低小鼠体质量,减小卵巢体积,改善PCOS小鼠的胰岛素抵抗状态,降低肝脏葡萄糖激酶和己糖激酶的特异性活性,明显增加PCOS小鼠ERα和GLUT4基因表达水平,预示槲皮素可能是治疗PCOS胰岛素抵抗和不孕的理想化合物[7]。
根据靶点预测技术,预测出当归-菟丝子治疗PCOS潜在的作用靶点共135个,利用蛋白相互作用网络,分析其中可能的关键靶标有AKT1、JUN、MAPK1、IL-6和ESR1等。蛋白激酶B即AKT与雄激素之间可形成正反馈,在颗粒黄体细胞增殖和卵泡生长方面具有重要的作用。有研究[8]发现,高雄激素型PCOS患者颗粒黄体细胞中雄激素、AKT1、AKT2的表达增高,说明AKT1和AKT2高表达可能是高雄激素血症型PCOS患者颗粒黄体细胞功能异常的原因之一。有学者利用基因芯片技术筛选出PCOS差异基因,通过拓扑和功能富集分析,构建转录因子-microRNA协同调节网络,发现转录因子SP1与miR-355-5p可能共同作用于靶基因JUN,参与Wnt信号通路、转化生长因子-β信号通路和细胞周期的调控,在PCOS的发生、发展中发挥重要的作用[9]。MAPK可能参与调节细胞的生长、分化、对环境的应激适应、炎症反应等多红细胞生理和病理过程。研究[10]发现,用二甲双胍和氟他胺治疗PCOS小鼠,可上调肝脏和肠管的胰岛素信号通路,包括胰岛素受体、MAPK1和AKT2等,从而改善PCOS小鼠胰岛素抵抗的状态。IL-6是活化的T细胞和成纤维细胞产生的淋巴因子,IL-6可以调节C反应蛋白转录水平,两者联合可以预测PCOS患者发生2型糖尿病和心血管疾病的风险[11]。ESR1编码雌激素受体,可能与雌激素受体2形成同型二聚体或异型二聚体,影响靶组织中的细胞增殖和分化。PCOS患者常因为子宫内膜功能异常,造成生育力降低。有学者发现,来曲唑可增加ESR1的表达,通过Wnt/β-catenin通路,增加子宫内膜厚度,提高PCOS患者的妊娠率[12]。
GO注释结果显示,当归-菟丝子的135个潜在作用靶标主要富集在核受体活性、转录因子活性调节序列特异性DNA结合、类固醇激素受体活性、细胞因子受体结合、蛋白质异源二聚体活性、类固醇结合及近端启动子序列特异性DNA结合等,KEGG的富集通路主要在糖尿病并发症AGE-RAGE信号通路、液体剪切应力、动脉粥样硬化和内分泌抵抗等。解释了PCOS以胰岛素抵抗为特征以及远期易出现2型糖尿病和心血管疾病的可能原因。
综上所述,本研究表明,当归-菟丝子治疗PCOS的活性成分可能为槲皮素、谷固醇、山柰酚、芝麻素和异鼠李素等11种化合物,这些活性成分可能通过AKT1、MAPK1、IL-6和ESR1等靶标作用于糖尿病并发症AGE-RAGE信号通路、液体剪切应力、动脉粥样硬化和内分泌抵抗等信号通路,发挥治疗作用。但是,本研究仅在分子水平初步预测当归-菟丝子治疗PCOS可能涉及的信号通路,今后仍需要更多的研究以进一步阐明其作用机制。
| [1] |
夏波, 孙红. 多囊卵巢综合征的中药治疗研究进展[J]. 世界最新医学信息文摘(电子版), 2019, 19(28): 82-83. DOI:10.19613/j.cnki.1671-3141.2019.28.035 |
| [2] |
陈迪, 张诏, 王仪雯, 等. 基于数据挖掘探索多囊卵巢综合征临床用药规律[J]. 中医药导报, 2018, 24(23): 70-73. |
| [3] |
雷露, 张文艳, 吉秀家. 吴克明教授运用新加苁蓉菟丝丸治疗多囊卵巢综合征的经验[J]. 广西中医药, 2012, 35(5): 49-50. DOI:10.3969/j.issn.1003-0719.2012.05.024 |
| [4] |
JIAO X, SHERMAN BT, HUANG DA W, et al. DAVID-WS:a stateful web service to facilitate gene/protein list analysis[J]. Bioinformatics, 2012, 28(13): 1805-1806. DOI:10.1093/bioinformatics/bts251 |
| [5] |
金炫廷, 马堃, 单婧. 补肾活血中药治疗多囊卵巢综合征导致排卵障碍性不孕的临床研究[J]. 中国中药杂志, 2014, 39(1): 140-143. DOI:10.4268/cjcmm20140126 |
| [6] |
REZVAN N, MOINI A, GORGANI-FIRUZJAEE S, et al. Oral quercetin supplementation enhances adiponectin receptor transcript expression in polycystic ovary syndrome patients:a randomized placebo-controlled double-blind clinical trial[J]. Cell J, 2018, 19(4): 627-633. DOI:10.22074/cellj.2018.4577 |
| [7] |
NEISY A, ZAL F, SEGHATOLESLAM A, et al. Amelioration by quercetin of insulin resistance and uterine GLUT4 and ERα gene expression in rats with polycystic ovary syndrome (PCOS)[J]. Reprod Fertil Dev, 2019, 31(2): 315-323. DOI:10.1071/rd18222 |
| [8] |
NEKOONAM S, NAJI M, NASHTAEI MS, et al. Expression of AKT1 along with AKT2 in granulosa-lutein cells of hyperandrogenic PCOS patients[J]. Arch Gynecol Obstet, 2017, 295(4): 1041-1050. DOI:10.1007/s00404-017-4317-9 |
| [9] |
LIU HY, HUANG YL, LIU JQ, et al. Transcription factor-microRNA synergistic regulatory network revealing the mechanism of polycystic ovary syndrome[J]. Mol Med Rep, 2016, 13(5): 3920-3928. DOI:10.3892/mmr.2016.5019 |
| [10] |
KUPREEVA M, DIANE A, LEHNER R, et al. Effect of metformin and flutamide on insulin, lipogenic and androgen-estrogen signaling, and cardiometabolic risk in a PCOS-prone metabolic syndrome rodent model[J]. Am J Physiol Endocrinol Metab, 2019, 316(1): E16-E33. DOI:10.1152/ajpendo.00018.2018 |
| [11] |
NACB LMPG COMMITTEE MEMBERS, MYERS GL, CHRISTENSON RH, et al. National academy of clinical biochemistry laboratory medicine practice guidelines:emerging biomarkers for primary prevention of cardiovascular disease[J]. Clin Chem, 2009, 55(2): 378-384. DOI:10.1373/clinchem.2008.115899 |
| [12] |
MEHDINEJADIANI S, AMIDI F, MEHDIZADEH M, et al. Effects of letrozole and clomiphene citrate on Wnt signaling pathway in endometrium of polycystic ovarian syndrome and healthy women[J]. Biol Reprod, 2019, 100(3): 641-648. DOI:10.1093/biolre/ioy187 |
 2021, Vol. 50
2021, Vol. 50