文章信息
- 刘鸿雁, 孙冲, 李倩, 刘梅
- LIU Hongyan, SUN Chong, LI Qian, LIU Mei
- 氟伐他汀钠对皮肤鳞状细胞癌细胞增殖、凋亡及PI3K/Akt/mTOR通路的影响
- Effects of fluvastatin sodium on the proliferation, apoptosis, and PI3K/Akt/mTOR pathway in human cutaneous squamous cell carcinoma cells
- 中国医科大学学报, 2020, 49(9): 841-845
- Journal of China Medical University, 2020, 49(9): 841-845
-
文章历史
- 收稿日期:2019-02-27
- 网络出版时间:2020-09-11 11:54
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,CSCC)是世界上第二常见的皮肤癌,发病率不断升高[1]。近年来,我国CSCC的发病率也逐年升高,发病年龄呈现年轻化趋势。CSCC严重影响患者的生活质量,给患者带来了沉重的身心负担[2]。他汀类是治疗中老年人群高脂血症的常用药物。近年来,随着他汀类药物的广泛应用和对其作用机制的深入研究,其抗肿瘤的作用受到广泛关注[3-4]。在肺癌[5]、肝癌[6]、结直肠癌[7]、乳腺癌[8]等方面相关研究取得了一定进展,但他汀类药物在皮肤肿瘤方面的研究国内鲜有报道。本研究以培养的人CSCC SCL-1细胞为研究对象,观察氟伐他汀钠对SCL-1细胞的增殖、凋亡的影响,并探讨其可能的分子机制。
1 材料与方法 1.1 主要材料和试剂人CSCC细胞株SCL-1由德国柏林自由大学本杰明·富兰克林医学中心惠赠。主要试剂包括氟伐他汀钠(上海源叶生物科技有限公司)、DMEM细胞培养液(美国Hyclone公司)、胎牛血清(美国Bioscience公司)、噻唑蓝(北京索莱宝公司)、二甲基亚砜(美国Sigma公司)、Annexin v/PI凋亡试剂盒(上海优宁维有限公司)、trizol试剂(美国Invitrogen公司)、反转录试剂盒(日本Toyobo公司)、实时qPCR试剂盒(日本Toyobo公司)。
1.2 方法 1.2.1 氟伐他汀钠储存液及工作液配制用DMSO将氟伐他汀钠充分溶解,配制成800 μmol/L浓度的母液(DMSO终浓度≤0.01%),22 μm滤器过滤,4 ℃避光保存;用含10%胎牛血清的DMEM培养液稀释成含氟伐他汀钠10、20、50、100 μmol/L的工作液。
1.2.2 细胞培养将SCL-1细胞培养于含10%胎牛血清的DMEM培养液中,置于37 ℃、5% CO2饱和湿度的培养箱中。观察培养基清亮,细胞呈贴壁生长,形态良好,细胞铺满瓶壁70%~80%可以传代。
1.2.3 MTT检测细胞增殖抑制率收集处于对数生长期的SCL-1细胞,以5×104/mL的细胞密度接种于96孔板。每孔加入100 μL细胞悬液,继续培养24 h;吸去96孔板中的培养液,实验组分别加入10、20、50、100 μmol/L工作液;设空白组(只加入培养液无细胞)和对照组(加入与实验组等量培养基),每组各设6个复孔。置于5%CO2、37 ℃培养箱中继续培养24、48、72 h。在预定时间前4 h以MTT法在酶联免疫检测仪上测定各孔的吸光度(optical density,OD),实验重复3次。细胞增殖抑制率=(1-OD实验组/ OD对照组)× 100%。
1.2.4 流式细胞术Annexin V-FITC/PI双标记检测细胞凋亡收集处于对数生长期的SCL-1细胞,分别加入10、20、50、100 μmol/L的氟伐他汀钠培养24 h、48 h后离心收集细胞。用400 μL 1×结合缓冲液使细胞悬浮,调整细胞浓度约为1×106/mL,1 000 r/min离心5 min,沉淀细胞,孵育缓冲液洗1次,加入5 μL AnnexinV-FITC,混匀后于2~8 ℃避光孵育15 min。加入10 μLPI混匀后2~8 ℃避光孵育5 min,在1 h内流式细胞仪检测细胞凋亡率。在双变量流式细胞仪的散点图上,以左下象限显示活细胞,为(FITC-/PI-);右上象限为非活细胞,即晚期凋亡细胞和死细胞,为(FITC+/PI+);右下象限表示早期凋亡细胞,显现(FITC+/PI-)。实验重复3次,统计早期凋亡率。
1.2.5 实时qPCR法检测磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinases,PI3K)、蛋白激酶B(protein kinase B,PKB,又称Akt)、雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)mRNA相对表达量将细胞生长状态良好的SCL-1细胞接种于6孔板内并培养过夜,分别加入10、20、50、100 μmol/L的氟伐他汀钠培养24 h,按照Trizol试剂说明书的方法行总RNA提取,采用分光光度计检测RNA质量。使用反转录试剂盒将RNA转录为cDNA,而后使用实时qPCR试剂盒进行扩增,扩增基因包括PI3K、aKt、mTOR,内参基因为GAPDH,根据Genebank公布的序列,采用Oligo6设计所需引物,引物序列见表 1。以空白对照组的表达量定义为1,采用2-△△Ct法进行相对定量,实验重复3次。
| Gene | Upstream primer sequence(5’-3’) | Downstream primer sequence(5’-3’) |
| PI3K | CTGCCTGCGACAGATGAGTG | TCCGATTACCAAGTGCTCTTTC |
| Akt | AGCGACGTGGCTATTGTGAAG | GCCATCATTCTTGAGGAGGAAGT |
| mTOR | TCCGAGAGATGAGTCAAGAGG | CACCTTCCACTCCTATGAGGC |
| GAPDH | ACAACTTTGGTATCGTGGAAGG | GCCATCACGCCACAGTTTC |
1.3 统计学分析
应用SPSS 23.0软件进行数据统计分析。采用x ±s描述正态分布资料的分布特征。两样本均数比较采用t检验,多样本均数比较采用方差分析,样本间多重比较采用Dunnett检验,P < 0.05为差异有统计学意义。
2 结果 2.1 氟伐他汀钠对SCL-1细胞增殖的影响结果显示,用10、20、50、100 μmol/L氟伐他汀钠干预SCL-1细胞后,相同时间随着氟伐他汀钠浓度增加SCL-1细胞抑制率上升(P < 0.01);同浓度氟伐他汀钠对SCL-1细胞分别干预24、48、72 h后,细胞增殖的抑制率随干预时间增加而上升(P < 0.01),见表 2。氟伐他汀钠在48 h对SCL-1的IC50为10.70 μmol/L。
| Group | Inhibition rate of SCL-1 cells | ||
| 24 h | 48 h | 72 h | |
| 10 μmol/L | 16.97±4.08 | 44.66±0.581) | 79.19±1.051) |
| 20 μmol/L | 20.07±4.262) | 63.04±0.101), 2) | 87.61±0.541),2) |
| 50 μmol/L | 23.72±3.762) | 68.18±0.441),2) | 90.08±0.541),2) |
| 100 μmol/L | 28.25±3.412) | 70.75±0.321),2) | 92.91±0.431),2) |
| 1)P < 0.01 vs the same group at 24 h;2)P < 0.01 vs 10 μmol/L group at the same time point. | |||
2.2 氟伐他汀钠对SCL-1细胞早期凋亡的影响
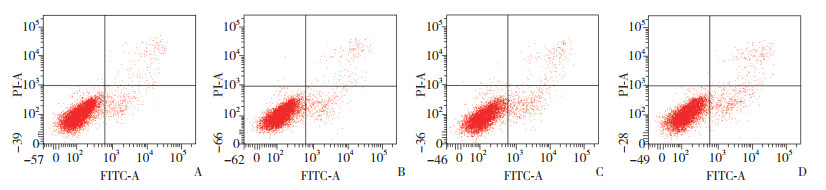
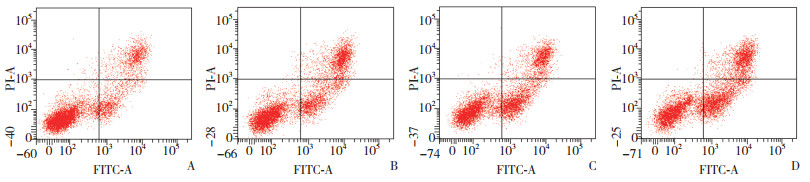
结果显示,不同浓度处理SCL-1细胞早期凋亡率随氟伐他汀钠的浓度增加而上升,呈现浓度依赖性(P < 0.01);相同浓度下,48 h早期凋亡率高于24 h,差异有统计学意义(P < 0.01)。见表 3,图 1、2。
| Group | Early apoptosis rate of SCL-1 cells | |
| 24 h | 48 h | |
| 0 μmol/L | 0.97±0.12 | 4.80±0.521) |
| 10 μmol/L | 3.47±0.061) | 13.73±0.551),2) |
| 20 μmol/L | 3.73±0.311) | 20.90±0.521),2) |
| 50 μmol/L | 4.67±0.381) | 28.73±0.651),2) |
| 100 μmol/L | 5.20±0.261) | 30.57±0.251),2) |
| 1)P < 0.01 vs 0 μmol/L group at the same time point;2)P < 0.01 vs the same group at 24 h. | ||
|
| A, 10 μmol/L group; B, 20 μmol/L group; C, 50 μmol/L group; D, 100 μmol/L group. 图 1 各组24 h时Annexin V-FITC/PI双染流式细胞分析散点图 Fig.1 Annexin V-FITC/PI double staining flow cytometry scatter plots of SCL-1 cells after 24 h treatment with different concentrations of fluvastatin sodium |
|
| A, 10 μmol/L group; B, 20 μmol/L group; C, 50 μmol/L group; D, 100 μmol/L group. 图 2 各组48 h时Annexin V-FITC/PI双染流式细胞分析散点图 Fig.2 Annexin V-FITC/PI double staining flow cytometry scatter plots of SCL-1 cells after 48 h treatment with different concentrations of fluvastatin sodium |
2.3 不同浓度氟伐他汀钠对PI3K、Akt、mTOR mRNA表达的影响
结果显示,不同浓度的氟伐他汀钠培养SCL-1细胞24 h后PI3K、、mTOR mRNA相对表达量随着药物浓度的升高而降低(P < 0.01)。见表 4。
| Group | PI3K mRNA | Akt mRNA | mTOR mRNA |
| 0 μmol/L group | 100.00±4.09 | 100.00±4.75 | 100.00±4.21 |
| 10 μmol/L group | 83.31±4.181) | 81.36±6.261) | 82.47±1.941) |
| 20 μmol/L group | 36.38±3.581) | 43.46±7.981) | 60.70±13.921) |
| 50 μmol/L group | 27.79±7.561) | 28.56±8.561) | 40.83±13.101) |
| 100 μmol/L group | 20.70±4.381) | 21.88±5.511) | 34.62±10.261) |
| 1)P < 0.01 vs 0 μmol/L group. | |||
3 讨论
他汀类药物是3-羟基-3-甲基戊二酰辅酶A(3-hydroxy3-methylglutaryl coenzyme A,HMG-CoA)还原酶具有高度专一性的竞争性强力抑制剂。自20世纪80年代问世以来,普遍应用于临床高脂血症的治疗[9-10]。HMG-CoA参与甲羟戊酸代谢途径,他汀类药物作为该酶的抑制剂抑制了甲羟戊酸以及下游产物的生成,从而抑制肿瘤细胞的生长、侵袭、转移、细胞增殖和分化,调控细胞周期[11-12]。他汀类药物能发挥多效细胞作用,其潜在机制包括:(1)洛伐他汀在SCC9、SCC25细胞系中可以损害线粒体功能并降低细胞ADP/ATP比率,触发了LKB1/AMPK通路活化,从而影响肿瘤蛋白的翻译[13];(2)Hippo通路是一条经典的致癌通路,TAZ是该通路的下游效应物,有研究[14]发现他汀类对TAZ高表达的肝癌细胞具有抗增殖和诱导凋亡作用;(3)辛伐他汀抑制了DNA与NF-κB转录因子结合,抑制抗凋亡蛋白BCL-XL表达,增加PTEN转录,从而发挥诱导细胞凋亡的作用[15]。
CSCC是一种常见的皮肤肿瘤,治疗方式多样,其中以手术切除为佳。然而由于手术治疗易引起组织缺损且容易留下瘢痕,又因局部外用药物及放射治疗方法存在局限性,较易复发,临床应用受限[16]。因此探寻新的治疗药物来抑制CSCC的发生发展具有很高的临床价值。他汀类药物在多种肿瘤中表现了显著的生物学效应,本研究采用了临床常用的氟伐他汀钠处理SCL-1细胞,实验结果表明氟伐他汀钠以浓度依赖性和时间依赖性的方式抑制SCL-1细胞增殖。流式细胞术Annexin V-FITC/PI双标法结果显示氟伐他汀钠的浓度越高、作用时间越长,SCL-1细胞凋亡率越高,由此可推测氟伐他汀钠可以抑制SCL-1细胞的增殖,促进其凋亡。
PI3K介导的Akt/mTOR通路是一条经典的促存活和抗凋亡的信号转导通路,在上皮源性恶性肿瘤的发生、发展、转归中具有重要作用[17]。本研究在明确氟伐他汀钠能够诱导SCL-1凋亡后,进一步对可能发挥作用的分子机制进行分析,结果显示,氟伐他汀钠可以降低PI3K、Akt、mTOR mRNA相对表达量,且随着药物浓度的增加抑制作用明显增强。这表明氟伐他汀钠可以抑制SCL-1细胞内PI3K/Akt/mTOR通路。
综上所述,氟伐他汀钠具有抑制人CSCC增殖并诱导其凋亡的作用,推测其机制之一可能与抑制PI3K/Akt/mTOR通路有关,本研究为CSCC的药物治疗开拓了新的方向。
| [1] |
TEJERA-VAQUERIZO A, DESCALZO-GALLEGO MA, OTERO-RIVAS MM, et al. Skin cancer incidence and mortality in Spain:a systematic review and meta-analysis[J]. Actas Dermosifiliogr, 2016, 107(4): 318-328. DOI:10.1016/j.ad.2015.12.008 |
| [2] |
惠栓. 光动力疗法治疗恶性肿瘤作用机制的研究进展[J]. 岭南现代临床外科, 2013, 13(2): 161-164. DOI:10.3969/j.issn.1009-976X.2013.02.027 |
| [3] |
王惠英, 张志辉, 范例, 等. 他汀类药物非降脂作用的临床用途探讨[J]. 临床合理用药杂志, 2013, 6(4): 179-180. DOI:10.3969/j.issn.1674-3296.2013.04.157 |
| [4] |
TAMANOI F, AZIZIAN M, ASHRAFI M, et al. Mevalonate pathway and human cancers[J]. Curr Mol Pharmacol, 2017, 10(2): 77-85. DOI:10.2174/1874467209666160112123205 |
| [5] |
LEVINE BD, CAGAN RL. Drosophila lung cancer models identify trametinib plus statin as candidate therapeutic[J]. Cell Rep, 2016, 14(6): 1477-1487. DOI:10.1016/j.celrep.2015.12.105 |
| [6] |
FRIEDMAN GD, ACHACOSO N, FIREMAN B, et al. Statins and reduced risk of liver cancer:evidence for confounding[J]. J Natl Cancer Inst, 2016, 108(10): djw109. DOI:10.1093/jnci/djw109 |
| [7] |
RENMAN D, LUNDBERG E, GUNNARSSON U, et al. Statin consumption as a risk factor for developing colorectal cancer:a retrospective case study[J]. World J Surg Oncol, 2017, 15(1): 222. DOI:10.1186/s12957-017-1287-0 |
| [8] |
VAN WYHE R, RAHAL O, WOODWARD W. Effect of statins on breast cancer recurrence and mortality:a review[J]. Breast Cancer:Targets Ther, 2017, 9: 559-565. DOI:10.2147/bctt.s148080 |
| [9] |
WANG HH, GARRUTI G, LIU M, et al. Cholesterol and lipoprotein metabolism and atherosclerosis:recent advances in reverse cholesterol transport[J]. Ann Hepatol, 2017, 16: S27-S42. DOI:10.5604/01.3001.0010.5495 |
| [10] |
DEMIERRE MF, HIGGINS PD, GRUBER SB, et al. Statins and cancer prevention[J]. Nat Rev Cancer, 2005, 5(12): 930-942. DOI:10.1038/nrc1751 |
| [11] |
DE LLOBET LI, BARO M, MESIA R, et al. Simvastatin enhances the effects of radiotherapy and cetuximab on a cell line (FaDu) derived from a squamous cell carcinoma of head and neck[J]. Transl Oncol, 2014, 7(4): 513-522. DOI:10.1016/j.tranon.2014.02.008 |
| [12] |
KARLIC H, THALER R, GERNER C, et al. Inhibition of the mevalonate pathway affects epigenetic regulation in cancer cells[J]. Cancer Genet, 2015, 208(5): 241-252. DOI:10.1016/j.cancergen.2015.03.008 |
| [13] |
MA L, NIKNEJAD N, GORN-HONDERMANN I, et al. Lovastatin induces multiple stress pathways including LKB1/AMPK activation that regulate its cytotoxic effects in squamous cell carcinoma cells[J]. PLoS One, 2012, 7(9): e46055. DOI:10.1371/journal.pone.0046055 |
| [14] |
HIGASHI T, HAYASHI H, KITANO Y, et al. Statin attenuates cell proliferative ability via TAZ (WWTR1) in hepatocellular carcinoma[J]. Med Oncol, 2016, 33(11): 123. DOI:10.1007/s12032-016-0845-6 |
| [15] |
GHOSH-CHOUDHURY N, MANDAL CC, GHOSH-CHOUDHURY N, et al. Simvastatin induces derepression of PTEN expression via NFkappaB to inhibit breast cancer cell growth[J]. Cell Signal, 2010, 22(5): 749-758. DOI:10.1016/j.cellsig.2009.12.010 |
| [16] |
宋静卉. 氨基酮戊酸光动力疗法治疗皮肤癌前病变及浅表皮肤癌的临床疗效探讨[J]. 中外医疗, 2015, 34(13): 33-35. DOI:10.16662/j.cnki.1674-0742.2015.13.080 |
| [17] |
张娟, 徐丹, 何黎, 等. PI3K/Akt/mTOR信号通路在上皮源性恶性肿瘤中的研究进展[J]. 现代肿瘤医学, 2017, 25(14): 2330-2333. DOI:10.3969/j.issn.1672-4992.2017.14.038 |
 2020, Vol. 49
2020, Vol. 49