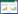文章信息
- 包博文, 梁金娥, 沈泽明, 金悦, 于诗彤, 刘云鹏, 车晓芳
- BAO Bowen, LIANG Jine, SHEN Zeming, JIN Yue, YU Shitong, LIU Yunpeng, CHE Xiaofang
- 长寿蛋白6对胃癌预后的影响及作用机制
- Prognostic significance and mechanism of sirtuin 6 in gastric cancer
- 中国医科大学学报, 2020, 49(9): 829-834
- Journal of China Medical University, 2020, 49(9): 829-834
-
文章历史
- 收稿日期:2019-03-13
- 网络出版时间:2020-09-11 14:38
胃癌是全球高发恶性肿瘤之一,其发病率和死亡率分别位居第五位和第三位[1]。虽然近年来胃癌诊断与治疗技术的发展在一定程度上延长了患者的总生存期,但由于大部分患者在初诊时即被诊断为晚期,常因快速多脏器转移而导致死亡,5年生存率仅为5%[2]。因此,寻找敏感、特异的生物标志物对准确判断胃癌患者预后具有重要意义。
长寿蛋白6(sirtuin 6,SIRT6)是NAD+依赖性组蛋白去乙酰酶长寿蛋白家族成员之一[3-4]。现已明确,除去乙酰化酶活性外,SIRT6还具有去长链脂肪酰基化酶活性[3, 5-6],在DNA修复、转录复制、端粒维持、细胞凋亡等生物过程中发挥重要作用。已有研究显示,SIRT6的异常表达与包括肿瘤在内的多种疾病的发生发展密切相关。然而,SIRT6在肿瘤中发挥何种作用结论尚不一致。在甲状腺癌[7-8]、皮肤鳞状细胞癌[9]、乳腺癌[10]及前列腺癌[11]等肿瘤中,SIRT6表达明显上调,且高表达患者预后不良,提示SIRT6发挥促癌作用;而在肺癌[12]、结肠癌[13]、肝癌[14-15]、骨肉瘤[16]等肿瘤组织中SIRT6表达则明显低于癌旁组织,低表达患者分期较差且生存期较短,提示SIRT6发挥抑癌作用。这种表达和对预后作用的不一致性提示SIRT6在不同肿瘤中可能发挥不同作用,SIRT6对肿瘤的影响还需进行深入探讨。目前仅有的关于SIRT6对胃癌预后影响的研究中,Zhou等[17]利用免疫组化方法分析了SIRT6在67例胃癌组织中的表达情况,结果发现SIRT6低表达患者的生存期明显缩短,提示SIRT6是胃癌预后的保护因素。然而,该研究中临床样本量相对较小,且未探讨SIRT6通过何种机制影响胃癌预后,因此SIRT6在胃癌中的作用和机制尚需深入研究。
为明确SIRT6在胃癌中的作用和机制,本研究利用人类肿瘤相关的基因表达汇编(gene expression omnibus,GEO)分析SIRT6对预后的影响及其与临床病理学参数的相关性,并利用基因集富集分析(gene set enrichment analysis,GSEA)结合细胞实验,探讨SIRT6影响胃癌发生发展的机制,旨在为明确SIRT6在胃癌中的预后意义和作用机制提供新的线索。
1 材料与方法 1.1 数据收集及样本信息从美国国家生物技术信息中心(national center of biotechnollogy information,NCBI)的GEO(http://www.ncbi.nlm.nih.gov)中下载基因表达谱胃癌样本数据集GSE62254。收集GEO数据集中具有完整临床病理学参数和生存资料的病例。
1.2 数据集筛选基于SIRT6 mRNA表达量,计算1年、3年和5年生存期时的受试者操作特征曲线(receiver operating characteristic curve,ROC)曲线下的面积(area under curve,AUC)及约登指数(Youden index),选取AUC值最大的曲线计算出SIRT6表达的最佳截断值。根据此最佳截断值将数据进行二分类,低于该值的样本为低表达组,高于该值的样本为高表达组。
1.3 GSEA采用GSEA3.0版本[18-19]进行分析。按1.2分组原则将样本分为SIRT6高表达组和低表达组。利用GSEA网站MsigDB数据库中获得c2.cp.kegg.v6.2.symbols.gmt数据集,按默认加权富集统计的方法进行富集分析,设置随机组合次数为1 000次。
1.4 细胞培养胃癌细胞株MGC803(3111C0001CCC000227)购于国家细胞资源平台,在含10%胎牛血清的RPMI 1640培养液中于5 % CO2、37 ℃及饱和湿度条件下培养。2~3 d传代1次,取对数生长期细胞用于实验。
1.5 siRNA顺时转染将SIRT6 siRNA 6 μL、Jet转染试剂4μL及缓冲液200 μL混匀并静置10 min后加入6孔板的MGC803细胞中,转染48 h后进行后续Westernblotting或transwell检测。SIRT6 siRNA由唯尚立德公司合成,正义序列为5’-UCCAUCACGCUGGGUACAU-3’,反义序列为5’-AUGUACCCAGCGUGAUGGA-3’。
1.6 细胞迁移实验分别取2×104个MGC803/NC及MGC803/siSIRT6细胞种于transwell小室的上室,下室加入含2.5%胎牛血清的RPMI 1640或DMEM培养液,培养24 h后,取出小室,PBS冲洗2次,Giemsa染色40 min,显微镜下观察并计数迁移至小室下层的细胞数。
1.7 统计学分析使用R语言及SPSS 16.0软件进行统计学分析。利用χ2检验分析SIRT6的表达与临床病理参数间的相关性,采用Kaplan-Meier和Log-rank检验法进行生存分析。P < 0.05为差异有统计学意义。
2 结果 2.1 SIRT6表达与胃癌患者预后的相关性比较1年、3年、5年总生存期下的SIRT6表达值的AUC,结果显示总生存期1年时SIRT6表达值的AUC最大(AUC=0.615),从而计算出SIRT6的最佳截断值为1.82(图 1A)。将GSE62254数据集中283例具有完整临床资料的病例按SIRT6的最佳截断值分为高表达组和低表达组。其中高表达组88例,低表达组195例。采用log-rank法进行生存分析结果显示,SIRT6表达水平低的患者总生存期明显低于表达水平高的患者(P < 0.001),提示SIRT6是胃癌的预后保护因子,其表达水平低的患者预后不良(图 1B)。
|
| A, ROC curves was used to compare the AUC of SIRT6 expression for 1-, 3-, and 5-year overall survival; B, Kaplan-Meier was used to estimate the OS probability based on the expression of SIRT6, in which red plots indicates high-SIRT6 group, while the blue plot represents low-SIRT6 group. OS, overall survival. 图 1 SIRT6表达与胃癌患者预后的关系 Fig.1 Effect of SIRT6 expression on the prognosis of gastric cancer |
2.2 SIRT6表达与临床病理学参数的相关性
利用χ2检验分析SIRT6高表达组和低表达组与各临床病理学参数的关系。结果如表 1所示,SIRT6高表达组中M1分期比例显著低于低表达组(分别为3.5%、12.7%,P = 0.031),提示SIRT6高表达可能抑制胃癌转移。然而,SIRT6表达与性别、年龄、组织学分级、T分期、N分期并无明显相关性。这一结果提示SIRT6低表达可能通过促进胃癌转移引起预后不良。
| Variables | SIRT6 expression | P | |
| Low | High | ||
| T stage | 0.163 | ||
| 2-3 | 184 | 79 | |
| 4 | 11 | 9 | |
| Gender | 0.495 | ||
| Male | 65 | 33 | |
| Female | 130 | 55 | |
| Age | 0.248 | ||
| < 60years | 76 | 28 | |
| ≥60years | 119 | 60 | |
| N stage | 0.080 | ||
| 0 | 19 | 17 | |
| 1-2 | 139 | 57 | |
| 3 | 37 | 14 | |
| M stage | 0.031 | ||
| 0 | 173 | 85 | |
| 1 | 22 | 3 | |
| Grade* | 0.151 | ||
| Poor | 106 | 37 | |
| Moderately/well | 70 | 39 | |
| *,there are 31 censored samples without the Grade in 283 patients. | |||
2.3 SIRT6对胃癌细胞迁移的影响
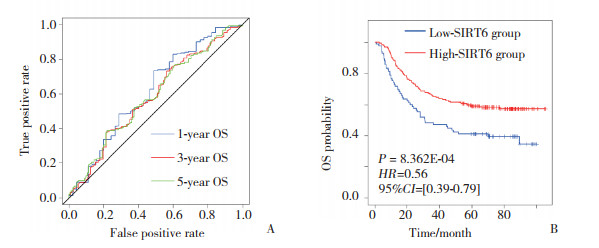
为探讨SIRT6对胃癌细胞迁移的影响,在MGC803细胞中瞬时敲减SIRT6后,transwell小室法检测其迁移能力的变化。结果显示,敲减SIRT6后,MGC803胃癌细胞中SIRT6的蛋白表达水平明显降低(图 2A),迁移能力也明显增强(P < 0.05)(图 2B、2C),提示SIRT6表达下调可促进胃癌细胞转移。
|
| A, SIRT6 expression in MGC823 cells transfected with the NC or the siSIRT6 group; B, after transfected with the NC or the siSIRT6 group, the migration ability of MGC823 was observed by the microscopy (×200);C, the numbers of migrated cell by counting three fields. *P < 0.05 vs NC group. 图 2 SIRT6对胃癌细胞迁移的影响 Fig.2 Effect of SIRT6 on cell migration in gastric cancer cells |
2.4 SIRT6功能基因集富集分析
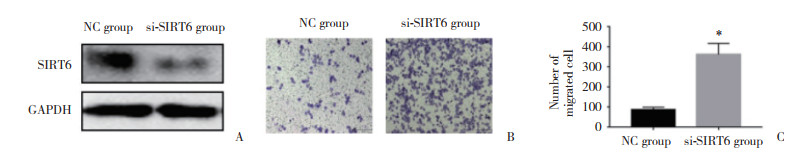
为探讨SIRT6可能通过哪些通路影响胃癌转移,利用KEGG通路基因集作为参照基因集进行了GSEA分析。结果显示,SIRT6低表达与Wnt信号通路及骨架蛋白调控等通路相关,提示SIRT6表达水平降低可能通过激活Wnt信号及骨架蛋白调控等通路促进了胃癌细胞的转移。见图 3。
|
| 图 3 SIRT6功能基因集富集分析 Fig.3 Gene set enrichment analysis of SIRT6 |
2.5 SIRT6对Wnt通路及细胞骨架调控通路中integrin α5的影响
敲减SIRT6后检测β-catenin失活型磷酸化水平及integrin α5及integrinv的表达水平。如图 4所示,敲减SIRT6后,β-catenin失活型磷酸化水平降低,integrin α5表达水平升高,而integrinv并无明显变化,提示SIRT6可抑制Wnt通路活化及细胞骨架相关蛋白integrin α5的表达。提示SIRT6表达水平降低可通过激活Wnt通路,上调integrin α5促进胃癌细胞转移。
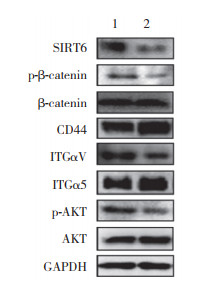
|
| 1, NC group; 2, si-SIRT6 group. 图 4 SIRT6对下游相关通路的影响 Fig.4 The effect of SIRT6 on the downstream pathway |
3 讨论
本研究通过分析GSE62254胃癌数据集发现SIRT6低表达的胃癌患者转移发生率高且预后不良,SIRT6是胃癌预后保护因素;通过在胃癌细胞中敲减SIRT6发现SIRT6表达水平降低可通过活化Wnt通路及上调intergrin α5蛋白表达促进胃癌细胞迁移。
现有研究显示,SIRT6可抑制肺癌[12, 20]、结直肠癌[13, 21]、膀胱癌[20]等肿瘤的发生发展。在肺癌中,SIRT6低表达患者的总生存期及无复发生存期(disease-free survival,DFS)均短于高表达患者,且低表达患者更易发生淋巴结转移;另有研究[13, 21]显示,SIRT6在结直肠癌组织中的表达显著低于癌旁组织,且其低表达患者的肿瘤浸润能力更强,发生淋巴结转移的概率也明显提高。同样在膀胱尿路上皮癌研究[22]中也证实SIRT6的表达与T分期呈负相关。这些研究提示了在多种肿瘤中SIRT6可能作为预后保护因子,通过抑制肿瘤细胞增殖和转移发挥抑制肿瘤发生发展的作用,其低表达往往导致肿瘤进展迅速、预后较差。本研究中分析GSE62254数据集中SIRT6 mRNA表达水平与胃癌预后的关系时发现,SIRT6低表达患者总生存期明显短于高表达患者,与既往胃癌的研究结果类似。本研究还发现SIRT6低表达患者的转移发生率明显升高,且在胃癌细胞中敲减SIRT6后,细胞的迁移能力明显增强。然而本研究并未发现SIRT6表达与肿瘤大小具有相关性。这些结果提示SIRT6表达降低可能通过促进转移而非促进肿瘤增殖导致胃癌预后不良。同时也提示SIRT6可作为潜在的胃癌预后预测的生物学标志物。当然,由于本研究是利用GEO数据库中SIRT6 mRNA水平进行的分析,无法完全代表SIRT6在胃癌中的蛋白表达情况,后续还应扩大样本量、并结合免疫组化方法分析其对胃癌预后的影响,进一步明确SIRT6是否可作为胃癌预后预测的生物学标志物。
研究[13]发现,SIRT6在结肠癌细胞系中均呈低表达,且其表达减低通过激活AKT通路发挥促进结肠癌细胞增殖侵袭、抑制凋亡作用。Szymura等[23]研究发现,SIRT6可以抑制GFPT2和N-钙黏蛋白的表达,逆转非小细胞肺癌细胞上皮-间质转化(epithelial-mesenchymal transition,EMT),进而抑制其侵袭转移。SIRT6表达较高的骨肉瘤患者总生存率也明显优于低表达者,且SIRT6的表达减低也能促进N-钙黏蛋白的表达,增强骨肉瘤细胞的增殖转移能力[16]。然而,本研究发现敲减SIRT6虽然增强了胃癌细胞的迁移能力,但并未发现其发生EMT形态改变,也并未检测到AKT通路的活化。因此本研究又利用GSEA富集分析方法,分析GSE62254胃癌数据集中与SIRT6低表达显著相关的信号通路,探索SIRT6低表达促进胃癌转移的新的可能机制。结果发现SIRT6低表达与Wnt信号激活及骨架蛋白调控等通路密切相关。进一步通过敲减胃癌细胞中的SIRT6表达后证实,β-catenin活化水平及integrin α5表达水平升高。这充分证明SIRT6可抑制Wnt通路活化及integrin α5表达,从而抑制胃癌细胞转移。以上结果揭示了SIRT6抑制胃癌发生发展的新机制。
综上所述,本研究利用在线数据分析、GSEA分析及细胞实验证明SIRT6低表达可能通过激活Wnt通路及上调integrin α5表达促进胃癌细胞转移,导致胃癌患者预后不良。本研究揭示了SIRT6在胃癌发展中的作用,为明确SIRT6是否能成为胃癌预后标志物及治疗靶点提供了线索和科学依据。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
HUNDAHL SA, PHILLIPS JL, MENCK HR. The National Cancer Data Base Report on poor survival of US gastric carcinoma patients treated with gastrectomy:Fifth Edition American Joint Committee on cancer staging, proximal disease, and the "different disease" hypothesis[J]. Cancer, 2000, 88(4): 921-932. DOI:10.1002/(SICI)1097-0142(20000215)88:4<921::AID-CNCR24>3.0.CO;2-S |
| [3] |
GIBLIN W, SKINNER ME, LOMBARD DB. Sirtuins:guardians of mammalian healthspan[J]. Trends Genet, 2014, 30: 271-286. DOI:10.1016/j.tig.2014.04.007 |
| [4] |
D'ONOFRIO N, VITIELLO M, CASALE R, et al. Sirtuins in vascular diseases:emerging roles and therapeutic potential[J]. Biochim Biophys Acta, 2015, 1852(7): 1311-1322. DOI:10.1016/j.bbadis.2015.03.001 |
| [5] |
FRYE RA. Phylogenetic classification of prokaryotic and eukaryotic Sir2-like proteins[J]. Biochem Biophys Res Commun, 2000, 273(2): 793-798. DOI:10.1006/bbrc.2000.3000 |
| [6] |
IMAI S, ARMSTRONG CM, KAEBERLEIN M, et al. Transcriptional silencing and longevity protein Sir2 is an NAD-dependent histone deacetylase[J]. Nature, 2000, 403(6771): 795-800. DOI:10.1038/35001622 |
| [7] |
YANG Z, YU WP, HUANG RH, et al. SIRT6/HIF-1α axis promotes papillary thyroid cancer progression by inducing epithelial-mesenchymal transition[J]. Cancer Cell Int, 2019, 19: 17. DOI:10.1186/s12935-019-0730-4 |
| [8] |
QU N, HU JQ, LIU L, et al. SIRT6 is upregulated and associated with cancer aggressiveness in papillary thyroid cancer via BRAF/ERK/Mcl-1 pathway[J]. Int J Oncol, 2017, 50(5): 1683-1692. DOI:10.3892/ijo.2017.3951 |
| [9] |
MING M, HAN WN, ZHAO BZ, et al. SIRT6 promotes COX-2 expression and acts as an oncogene in skin cancer[J]. Cancer Res, 2014, 74(20): 5925-5933. DOI:10.1158/0008-5472.CAN-14-1308 |
| [10] |
KHONGKOW M, OLMOS Y, GONG C, et al. SIRT6 modulates paclitaxel and epirubicin resistance and survival in breast cancer[J]. Carcinogenesis, 2013, 34(7): 1476-1486. DOI:10.1093/carcin/bgt098 |
| [11] |
LIU YW, XIE QR, WANG BS, et al. Inhibition of SIRT6 in prostate cancer reduces cell viability and increases sensitivity to chemotherapeutics[J]. Protein Cell, 2013, 4(9): 702-710. DOI:10.1007/s13238-013-3054-5 |
| [12] |
CHEN T, SUN ZJ, LIU FL, et al. RASSF1A and SIRT6 in non-small cell lung cancer:relationship with clinical outcome[J]. Oncol Lett, 2017, 14(5): 5759-5764. DOI:10.3892/ol.2017.6172 |
| [13] |
TIAN JH, YUAN LL. Sirtuin 6 inhibits colon cancer progression by modulating PTEN/AKT signaling[J]. Biomedecine Pharmacother, 2018, 106: 109-116. DOI:10.1016/j.biopha.2018.06.070 |
| [14] |
LIU JH, YU Z, XIAO YY, et al. Coordination of FOXA2 and SIRT6 suppresses the hepatocellular carcinoma progression through ZEB2 inhibition[J]. Cancer Manag Res, 2018, 10: 391-402. DOI:10.2147/CMAR.S150552 |
| [15] |
ZHANG ZG, QIN CY. Sirt6 suppresses hepatocellular carcinoma cell growth via inhibiting the extracellular signal-regulated kinase signaling pathway[J]. Mol Med Rep, 2014, 9(3): 882-888. DOI:10.3892/mmr.2013.1879 |
| [16] |
GAO Y, QU YX, ZHOU Q, et al. SIRT6 inhibits proliferation and invasion in osteosarcoma cells by targeting N-cadherin[J]. Oncol Lett, 2019, 17(1): 1237-1244. DOI:10.3892/ol.2018.9676 |
| [17] |
ZHOU JM, WU A, YU XT, et al. SIRT6 inhibits growth of gastric cancer by inhibiting JAK2/STAT3 pathway[J]. Oncol Rep, 2017, 38(2): 1059-1066. DOI:10.3892/or.2017.5753 |
| [18] |
SUBRAMANIAN A, TAMAYO P, MOOTHA VK, et al. Gene set enrichment analysis:a knowledge-based approach for interpreting genome-wide expression profiles[J]. Proc Natl Acad Sci USA, 2005, 102(43): 15545-15550. DOI:10.1073/pnas.0506580102 |
| [19] |
MOOTHA VK, LINDGREN CM, ERIKSSON KF, et al. PGC-1alpha-responsive genes involved in oxidative phosphorylation are coordinately downregulated in human diabetes[J]. Nat Genet, 2003, 34(3): 267-273. DOI:10.1038/ng1180 |
| [20] |
GONG J, WANG HY, LOU WW, et al. Associations of sirtuins with clinicopathological parameters and prognosis in non-small cell lung cancer[J]. Cancer Manag Res, 2018, 10: 3341-3356. DOI:10.2147/CMAR.S166946 |
| [21] |
QI J, CUI CH, DENG QW, et al. Downregulated SIRT6 and upregulated NMNAT2 are associated with the presence, depth and stage of colorectal cancer[J]. Oncol Lett, 2018, 16(5): 5829-5837. DOI:10.3892/ol.2018.9400 |
| [22] |
WU MH, DICKINSON SI, WANG X, et al. Expression and function of SIRT6 in muscle invasive urothelial carcinoma of the bladder[J]. Int J Clin Exp Pathol, 2014, 7(10): 6504-6513. |
| [23] |
SZYMURA SJ, ZAEMES JP, ALLISON DF, et al. NF-κB upregulates glutamine-fructose-6-phosphate transaminase 2 to promote migration in non-small cell lung cancer[J]. Cell Commun Signal, 2019, 17(1): 24. DOI:10.1186/s12964-019-0335-5 |
 2020, Vol. 49
2020, Vol. 49