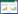文章信息
- 刘秋阁, 刘亚楠, 王刚, 吕金燕, 李贺明, 王若雨
- LIU Qiuge, LIU Yanan, WANG Gang, LÜ Jinyan, LI Heming, WANG Ruoyu
- 循环肿瘤细胞监测在晚期非小细胞肺癌疗效评价和预后评估中的作用
- Role of circulating tumor cell monitoring in the therapy efficacy evaluation and prognosis assessment of advanced non-small cell lung cancer
- 中国医科大学学报, 2020, 49(9): 812-817, 823
- Journal of China Medical University, 2020, 49(9): 812-817, 823
-
文章历史
- 收稿日期:2020-04-28
- 网络出版时间:2020-09-11 11:47
2. 辽宁省乳腺及消化肿瘤分子标志物高通量筛选及靶向药物转化重点实验室, 辽宁 大连 116001
2. The Key Laboratory of Biomarker High Throughput Screening and Target Translation of Breast and Gastrointestinal Tumor, Dalian 116001, China
肺癌是全世界范围内最常见的恶性肿瘤, 且发病率、死亡率均为恶性肿瘤的第一位[1]。肺癌患者中约85%诊断为非小细胞肺癌(non-small cell lung cancer, NSCLC) [2]。我国作为肺癌大国, 大约75%的肺癌患者诊断时为疾病晚期, 5年生存率偏低[3]。肿瘤的转移是影响患者死亡的关键因素。研究[4-5]表明, 循环肿瘤细胞(circulating tumor cell, CTC)与肿瘤血行转移具有明显相关性。CTC在抗肿瘤疗效监测、预测肿瘤患者预后等方面有重要作用[6-7]。本研究通过检测晚期NSCLC患者接受不同治疗前后外周血中CTC数目及动态变化, 探讨其与临床参数、疗效及预后的相关性。
1 材料与方法 1.1 研究资料纳入2013年7月至2017年8月于大连大学附属中山医院接受治疗的54例晚期NSCLC患者。纳入标准: (1)年龄≥18岁, 经病理学确诊为Ⅲ期或Ⅳ期无法根治性切除的NSCLC患者;(2)分期依据国际肺癌研究协会2009年第七版的标准。排除标准: (1)非病理学诊断;(2)存在严重的内科疾病或其他恶性肿瘤病史。该研究已获得大连大学附属中山医院伦理委员会批准, 所有入组患者均签署知情同意书。
1.2 研究方法 1.2.1 CTC采集检测及阳性标准NSCLC患者接受晚期一线治疗, 包括化疗、放疗、靶向治疗和其他(主要为唑来膦酸抗骨转移治疗)。分别于晚期一线治疗开始的前1 d (基线)和末次治疗结束后1个月内采血(治疗后)。末次治疗定义为一线治疗失败, 疾病进展。样本采集要求为清晨空腹采集外周血7.5 mL。CTC检测主要基于CellSearch系统, 相关试剂耗材以及CTC检测方法和判定标准见文献[8-9]。本研究CTC阳性标准为镜下CTC≥1。
1.2.2 疗效评价标准基于实体瘤疗效评价标准(response evaluation criteria in solid tumors, RECIST) 1.1版本进行评效。分为部分缓解(partial response, PR), 完全缓解(complete response, CR), 病变进展(progressive disease, PD), 病变稳定(stable disease, SD), 疾病控制(disease control, DC)。其中, DC为CR+PR+SD。
1.2.3 患者随访随访方式主要为门诊和电话随访, 截止到2018年12月31日, 入组的54例患者全部完成随访, 随访率达100%。随访终点的判定为患者PD或者死亡。患者的中位随访时间为16个月。
1.3 统计学分析采用SPSS 20.0软件进行统计分析, 生存分析采用Kaplan-Meier生存曲线;单因素及多因素生存分析应用Cox比例风险回归模型。P < 0.05为差异有统计学意义。
2 结果 2.1 患者临床资料和基线CTC数目比较54例患者中, 基线CTC阴性组与阳性组一般临床资料无统计学差异(P > 0.05), 见表 1。
| Characteristics | n (%) | CTC-positive | CTC-negative | CTC positive rate (%) | χ2 | P |
| Sex | 0.003 | 0.983 | ||||
| Male | 32(59.3) | 13 | 19 | 40.6 | ||
| Female | 22(40.7) | 9 | 13 | 40.9 | ||
| Age (year) | 0.307 | 0.580 | ||||
| ≥68 | 27(50.0) | 10 | 17 | 37.0 | ||
| <68 | 27(50.0) | 12 | 15 | 44.4 | ||
| Smoking status | 0.673 | 0.412 | ||||
| Smoker | 21(38.9) | 10 | 11 | 47.6 | ||
| Non-smoker | 33(61.1) | 12 | 21 | 36.4 | ||
| Histopathology | 0.482 | 0.914 | ||||
| Adenocarcinoma | 34(63.0) | 13 | 21 | 38.2 | ||
| Squamous cell carcinoma | 16(29.6) | 7 | 9 | 43.8 | ||
| Others | 4(7.4) | 2 | 2 | 50.0 | ||
| Tumor stage at diagnosis | 0.132 | 0.449 | ||||
| Ⅲ | 8(14.8) | 2 | 6 | 25.0 | ||
| Ⅳ | 46(85.2) | 20 | 26 | 43.5 | ||
| Therapy strategy | 3.290 | 0.349 | ||||
| Chemotherapy | 13(24.1) | 6 | 7 | 46.2 | ||
| Radiotherapy | 12(22.2) | 3 | 9 | 25.0 | ||
| Targeted therapy | 15(27.8) | 5 | 10 | 33.3 | ||
| Others | 14(25.9) | 8 | 6 | 57.1 |
2.2 CTC计数与无进展生存期(progression free survival, PFS)的关系
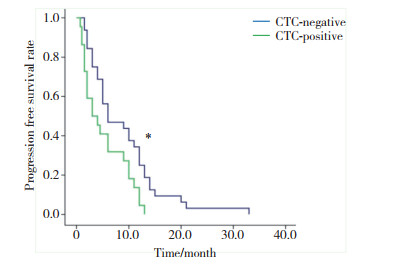
基线CTC阴性组和阳性组患者分别为32例(59.3%)和22例(40.7%), 中位PFS分别为(6.0±2.8)个月和(3.0±1.5)个月, 差异有统计学意义(χ2=6.252, P = 0.012), 见图 1。治疗后CTC阴性组和阳性组患者分别为30例(55.6%)、24例(44.4%), 中位PFS分别为(4.0±0.8)个月和(1.0±0.3)个月, 差异无统计学意义(χ2=2.002, P = 0.155), 见图 2。
|
| *P < 0.05 vs CTC-positive group. 图 1 基线CTC阳性组与阴性组PFS比较 Fig.1 Comparison of PFS between baseline CTC-positive and -negative groups |
|
| 图 2 治疗后CTC阳性组与阴性组PFS比较 Fig.2 Comparison of PFS between CTC-positive and -negative groups after treatment |
2.3 基线CTC与总生存期(overall survival, OS)的关系
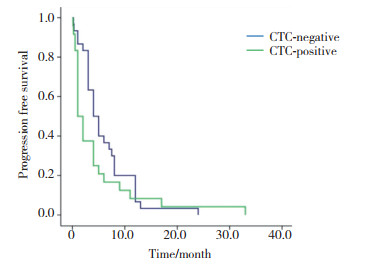
基线CTC阴性组和阳性组患者分别为32例(59.3%)和22例(40.7%), 中位OS分别为(23.0±3.0)个月和(9.0±1.4)个月, 差异有统计学意义(χ2=5.350, P = 0.021), 见图 3。
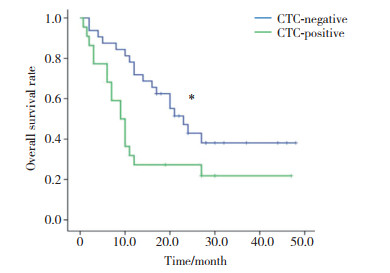
|
| *P < 0.05 vs CTC-positive group. 图 3 基线CTC阳性组与阴性组OS比较 Fig.3 Comparison of OS between baseline CTC-positive and -negative groups |
2.4 CTC变化与PFS和OS的关系
定义基线CTC为CTC0, 治疗后CTC为CTC1。治疗后CTC1-CTC0 > 0与CTC1-CTC0≤0患者分别有17例和37例, 中位PFS分别为(4.0±1.5)个月和(6.0±0.6)个月(χ2=0.630, P = 0.428), 见图 4。中位OS分别为(12.0±7.5)个月和(17.0±5.1)个月(χ2=0.003, P = 0.960), 见图 5。

|
| 图 4 CTC变化与PFS比较 Fig.4 Comparison of changes in CTC with PFS |
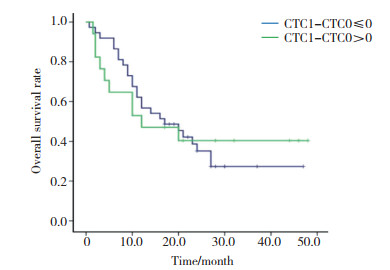
|
| 图 5 CTC变化与OS比较 Fig.5 Comparison of changes in CTC with OS |
2.5 基线CTC状态及CTC变化与PFS和OS的关系 2.5.1 基线CTC状态及CTC变化与PFS的关系
基线CTC阴性, 即CTC0=0的患者32例, 治疗后CTC1-CTC0 > 0和CTC1-CTC0≤0的患者分别为11例和21例, 中位PFS分别为(4.0±1.2)个月和(9.0±2.3)个月(χ2=1.437, P = 0.231)。基线CTC阳性, 即CTC0≥1的患者22例, 治疗后CTC1-CTC0 > 0和CTC1-CTC0≤0患者分别为6例和16例, 中位PFS分别为为(2.0±2.8)个月和(3.0±1.3)个月(χ2=0.003, P = 0.954)。4组间总体差异无统计学意义(χ2=7.375, P = 0.061), 见图 6。
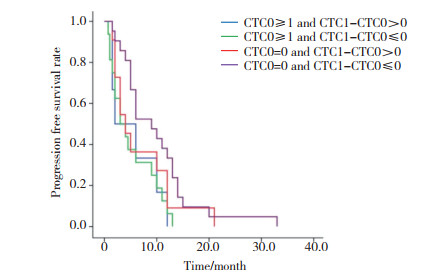
|
| 图 6 基线CTC状态及CTC变化与PFS关系 Fig.6 Comparison of baseline CTC status with changes in PFS |
2.5.2 基线CTC状态及CTC变化与OS的关系
基线CTC阴性即CTC0=0的患者32例, 治疗后CTC1-CTC0 > 0和CTC1-CTC0≤0的患者分别为11例和21例, 中位OS分别为(13.0± 3.9)和(21.0±3.8)个月(χ2=1.677, P = 0.195)。基线CTC阳性即CTC0≥1的患者22例, 治疗后CTC1-CTC0 > 0和CTC1-CTC0≤0患者分别有6例和16例, 中位OS分别为(3.0±3.3)个月和(9.0±2.0)个月(χ2=2.434, P = 0.119)。4组间总体差异有统计学意义(χ2=13.960, P = 0.003), 见图 7。
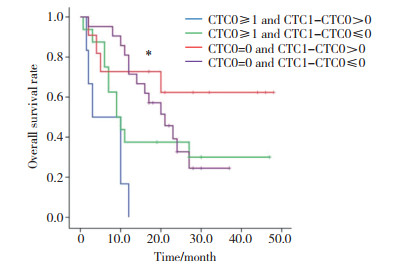
|
| *P < 0.01 overall comparison of the four groups. 图 7 基线CTC状态及CTC变化与OS关系 Fig.7 Comparison of baseline CTC status with changes in OS |
2.6 CTC变化和疗效评价的关系
CTC1-CTC0 > 0患者17例, 其中, PD 11例(64.7%), SD及PR 6例(35.3%);CTC1-CTC0≤0患者37例, PD 9例(24.3%), DC是28例(75.7%), 差异有统计学意义(χ2=8.145, P = 0.004), 见表 2。
| CTC variations | Evaluation of therapeutic response | χ2 | P | |
| DC | PD | |||
| CTC1-CTC0≤0 | 28 | 9 | 8.145 | 0.004 |
| CTC1-CTC0>0 | 6 | 11 | ||
2.7 治疗方法和CTC变化与疗效评价的关系
根据治疗方案将54例患者分为4组, 分别是单纯化疗组、化疗联合放疗组、化疗联合靶向治疗组和其他组。13例接受化学治疗患者中, 4例CTC1-CTC0 > 0, 评效为DC和PD分别为1例和3例;9例CTC1-CTC0≤0, 评效为DC和PD分别为8例和1例;2组无统计学差异(P = 0.052)。12例接受联合放射治疗患者中4例CTC1-CTC0 > 0, 评效为DC和PD分别为3例和1例;8例CTC1-CTC0≤0, 评效为DC和PD分别为7例和1例;2组无统计学差异(P = 1.000)。15例接受联合靶向治疗患者中4例CTC1-CTC0 > 0, 评效为DC和PD分别为1例和3例;11例CTC1-CTC0≤0, 评效为DC和PD分别为7例和4例;2组无统计学差异(P = 0.282)。14例接受其他治疗方式的患者中, 5例CTC1-CTC0 > 0, 评效为DC和PD分别为1例和4例;9例CTC1-CTC0≤0, 评效为DC和PD分别为6例和3例;2组无统计学差异(P = 0.266), 见表 3。
| Therapy strategy | CTC changes | Therapeutic response evaluation [n (%)] | P | |
| PD | DC | |||
| Chemotherapy | 0.052 | |||
| CTC1-CTC0>0 | 3(75.0) | 1(25.0) | ||
| CTC1-CTC0≤0 | 1(11.1) | 8(88.9) | ||
| Radiotherapy | 1.000 | |||
| CTC1-CTC0>0 | 1(25.0) | 3(75.0) | ||
| CTC1-CTC0≤0 | 1(12.5) | 7(87.5) | ||
| Targeted therapy | 0.282 | |||
| CTC1-CTC0>0 | 3(75.0) | 1(25.0) | ||
| CTC1-CTC0≤0 | 4(36.4) | 7(63.6) | ||
| Others | 0.266 | |||
| CTC1-CTC0>0 | 4(80.0) | 1(20.0) | ||
| CTC1-CTC0≤0 | 3(33.3) | 6(66.7) | ||
2.8 生存分析
采用Cox比例风险回归模型对患者的临床资料及基线CTC计数状态进行单因素分析, 结果显示CTC状态和吸烟史与OS有相关性(P < 0.05), 性别和年龄等因素与OS无相关性(P > 0.05)。采用Cox比例风险回归模型对患者年龄、吸烟史及治疗方式和基线CTC状态进行多因素分析, 结果显示, 年龄、吸烟史、治疗方式、基线CTC状态是影响患者预后的独立因素(P < 0.05), 见表 4。
| Characteristic | Univariate analysis | P | Multivariate analysis | P | ||
| HR | 95%CI | HR | 95%CI | |||
| Age (year) | 0.287 | 0.03 | ||||
| ≥68 | 1(standard) | 1(standard) | ||||
| <68 | 1.437 | 0.737-2.802 | 2.179 | 1.066-4.457 | ||
| Smoking status | 0.020 | 0.008 | ||||
| Smoker | 1(standard) | 1(standard) | ||||
| Non-smoker | 0.671 | 0.480-0.939 | 0.367 | 0.176-0.766 | ||
| Histopathology | ||||||
| Adenocarcinoma | 1(standard) | |||||
| Squamous cell carcinoma | 1.115 | 0.590-2.108 | 0.736 | |||
| Others | 1.023 | 0.390-2.681 | 0.964 | |||
| Tumor stage at diagnosis | 0.632 | |||||
| Ⅲ | 1(standard) | |||||
| Ⅳ | 1.114 | 0.716-1.735 | ||||
| Treatment methods | ||||||
| Chemotherapy | 1(standard) | 1(standard) | ||||
| Radiotherapy | 0.986 | 0.559-1.739 | 0.961 | 0.530 | 0.211-1.336 | 0.178 |
| Targeted therapy | 0.565 | 0.276-1.154 | 0.117 | 0.176 | 0.058-0.536 | 0.002 |
| Others | 0.754 | 0.339-1.424 | 0.384 | 0.247 | 0.092-0.667 | 0.006 |
| CTC | 0.026 | 0.022 | ||||
| CTC-negative | 1(standard) | 1(standard) | ||||
| CTC-positive | 0.467 | 0.239-0.913 | 0.423 | 0.203-0.882 | ||
3 讨论
疗效评价在晚期NSCLC患者诊疗中至关重要。目前疗效评价主要基于患者的影像学检查和血清肿瘤标志物检测。然而, 由于晚期NSCLC个体生物学的异质性, 部分患者出现临床不可预测的结果。因此, 临床中亟需一类敏感度和特异度高、可重复性强且方便易行的疗效评估手段。
CTC是指从肿瘤原发灶或转移灶中脱离进入血液循环的肿瘤细胞。研究表明, CTC形成是肿瘤血液转移的前提[10], 与肿瘤的病理分期及预后密切相关[11]。既往肺癌相关的研究[12-13]报告, Ⅳ期NSCLC患者外周血中的CTC数量明显高于Ⅲ期患者, 且CTC计数与患者的远处转移相关。在使用CellSearch系统的相关研究[14-15]已证实基线CTC计数和患者预后的相关性。因此, CTC检测在恶性肿瘤的辅助诊断、疗效评估及预后等方面有着巨大的应用潜力, 明显优于目前临床常用的检测技术[16-17]。本研究证实了在晚期NSCLC患者中基线CTC计数与PFS和OS相关, 且基线CTC状态是影响患者预后的独立因素, 与既往研究结果一致。然而, 目前针对患者治疗前后CTC动态变化与治疗疗效的关系研究较少, 且结论不尽相同。因此, 本研究进一步探究在晚期NSCLC患者中CTC动态监测与疗效评估的关系。
CTC动态变化或许可以作为治疗疗效的监测工具, MUINELO-ROMAY等[18]研究表明CTC计数变化可以提示患者治疗起效与否, 且能预测患者总体治疗疗效。ZHOU等[19]研究却表明CTC计数变化与患者化疗疗效无相关性。本研究发现治疗过程中CTC动态增多或不变/减少与评效为PD或DC相关。在疗效评估中, CTC动态变化与RECIST评效有相关性。根据基线CTC状态和动态变化趋势分为4个亚组, 并分析各亚组PFS和OS差异。在基线CTC状态相同条件下, 治疗前后CTC增多组的PFS和OS低于治疗前后CTC不变或减少组, 证实了治疗前后的CTC计数动态变化与晚期NSCLC患者的治疗疗效相关。
本研究患者基线CTC阳性率为40.7%, 相比文献[20]报道结果偏低。分析造成偏差的主要原因是使用了CellSearch系统, 该系统基于EpCAM阳性即上皮源性的肿瘤细胞, 而CTC的形成伴随着肿瘤细胞的上皮间质转化[21]。因此可能造成CTC检测结果偏低。此外本研究表明基线CTC与患者临床分期无相关性, 与部分研究结果存在差异。分析原因, 除检测技术的不同外, 还可能与入组病例数不足、个体异质性等因素有关。
本研究通过检测晚期NSCLC患者外周血中CTC数目, 进一步探讨基线CTC状态及治疗前后CTC动态变化在晚期NSCLC疗效评估和预后判断的价值, 为临床实践提供更多参考。然而, 因样本数目有限、CTC检测方法存在不足、随访时间不够, CTC计数及动态变化是否可以评估晚期NSCLC患者治疗疗效及预后还需要更多临床研究来证实。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA:A Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
孙可欣, 郑荣寿, 张思维, 等. 2015年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2019, 28(1): 1-11. DOI:10.11735/j.issn.1004-0242.2019.01.A001 |
| [3] |
SHE J, YANG P, HONG Q, et al. Lung cancer in China:challenges and interventions[J]. Chest, 2013, 143(4): 1117-1126. DOI:10.1378/chest.11-2948 |
| [4] |
FABISIEWICZ A, GRZYBOWSKA E. CTC clusters in cancer progression and metastasis[J]. Med Oncol, 2017, 34(1): 12. DOI:10.1007/s12032-016-0875-0 |
| [5] |
SUN Y, WU G, CHENG KS, et al. CTC phenotyping for a preoperative assessment of tumor metastasis and overall survival of pancreatic ductal adenocarcinoma patients[J]. E Bio Medicine, 2019, 46: 133-149. DOI:10.1016/j.ebiom.2019.07.044 |
| [6] |
HONG X, SULLIVAN RJ, KALINICH M, et al. Molecular signatures of circulating melanoma cells for monitoring early response to immune checkpoint therapy[J]. Proc Natl Acad Sci U S A, 2018, 115(10): 2467-2472. DOI:10.1073/pnas.1719264115 |
| [7] |
ZHANG X, LI H, YU X, et al. Analysis of circulating tumor cells in ovarian cancer and their clinical value as a biomarker[J]. Cell Physiol Biochem, 2018, 48(5): 1983-1994. DOI:10.1159/000492521 |
| [8] |
CRISTOFANILLI M. Circulating tumor cells, disease progression, and survival in metastatic breast cancer[J]. Semin Oncol, 2006, 33(3): s9-s14. DOI:10.1053/j.seminoncol.2006.03.016 |
| [9] |
DE WIT S, ROSSI E, WEBER S, et al. Single tube liquid biopsy for advanced non-small cell lung cancer[J]. Int J Cancer, 2019, 144(12): 3127-3137. DOI:10.1002/ijc.32056 |
| [10] |
LOZAR T, GERSAK K, CEMAZAR M, et al. The biology and clinical potential of circulating tumor cells[J]. Radiol Oncol, 2019, 53(2): 131-147. DOI:10.2478/raon-2019-0024 |
| [11] |
ZHANG Z, XIAO Y, ZHAO J, et al. Relationship between circulating tumour cell count and prognosis following chemotherapy in patients with advanced non-small-cell lung cancer[J]. Respirology, 2016, 21(3): 519-525. DOI:10.1111/resp.12696 |
| [12] |
WEI T, ZHU D, YANG Y, et al. The application of nano-enrichment in CTC detection and the clinical significance of CTCS in non-small cell lung cancer (NSCLC) treatment[J]. PLoS One, 2019, 14(7): e0219129. DOI:10.1371/journal.pone.0219129 |
| [13] |
ZHOU J, DONG F, CUI F, et al. The role of circulating tumor cells in evaluation of prognosis and treatment response in advanced non-small-cell lung cancer[J]. Cancer Chemother Pharmacol, 2017, 79(4): 825-833. DOI:10.1007/s00280-017-3269-x |
| [14] |
RIETHDORF S, O'FLAHERTY L, HILLE C, et al. Clinical applications of the CellSearch platform in cancer patients[J]. Adv Drug Deliv Rev, 2018, 125: 102-121. DOI:10.1016/j.addr.2018.01.011 |
| [15] |
TAMMINGA M, DE WIT S, SCHUURING E, et al. Circulating tumor cells in lung cancer are prognostic and predictive for worse tumor response in both targeted- and chemotherapy[J]. Transl Lung Cancer Res, 2019, 8(6): 854-861. DOI:10.21037/tlcr.2019.11.06 |
| [16] |
DE BRUYN C, BAERT T, VAN DEN BOSCH T, et al. Circulating transcripts and biomarkers in uterine tumors:is there a predictive role?[J]. Curr Oncol Rep, 2020, 22(2): 12. DOI:10.1007/s11912-020-0864-5 |
| [17] |
MUINELO-ROMAY L, CASAS-AROZAMENA C, ABAL M. Liquid biopsy in endometrial cancer:new opportunities for personalized oncology[J]. Int J Mol Sci, 2018, 19(8): 2311. DOI:10.3390/ijms19082311 |
| [18] |
MUINELO-ROMAY L, VIEITO M, ABALO A, et al. Evaluation of circulating tumor cells and related events as prognostic factors and surrogate biomarkers in advanced NSCLC patients receiving first-line systemic treatment[J]. Cancers, 2014, 6(1): 153-165. DOI:10.3390/cancers6010153 |
| [19] |
ZHOU J, DONG F, CUI F, et al. The role of circulating tumor cells in evaluation of prognosis and treatment response in advanced non-small-cell lung cancer[J]. Cancer Chemother Pharmacol, 2017, 79(4): 825-833. DOI:10.1007/s00280-017-3269-x |
| [20] |
骆许静, 马耀先, 孙桢, 等. 循环肿瘤细胞在肺癌中的表达及其临床意义研究[J]. 实用癌症杂志, 2019, 34(5): 753-755. DOI:10.3969/j.issn.1001-5930.2019.05.017 |
| [21] |
LIU DG, XUE L, LI J, et al. Epithelial-mesenchymal transition and GALC expression of circulating tumor cells indicate metastasis and poor prognosis in non-small cell lung cancer[J]. Cancer Biomark, 2018, 22(3): 417-426. DOI:10.3233/CBM-170995 |
 2020, Vol. 49
2020, Vol. 49