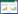文章信息
- 张萌萌, 潘鑫, 关海霞, 王晓黎
- ZHANG Mengmeng, PAN Xin, GUAN Haixia, WANG Xiaoli
- 一个家族性低钾型周期性麻痹家系报道
- A report of familial hypokalemic periodic paralysis
- 中国医科大学学报, 2020, 49(9): 798-802
- Journal of China Medical University, 2020, 49(9): 798-802
-
文章历史
- 收稿日期:2019-04-09
- 网络出版时间:2020-09-11 10:06
2. 哈尔滨医科大学附属第二医院感染病科, 哈尔滨 150001
2. Department of Infectious Diseases, The Second Affiliated Hospital of Harbin Medical University, Harbin 150001, China
低钾型周期性麻痹(hypokalemic periodic paralysis, HypoPP)是一种常染色体显性遗传的骨骼肌离子通道病, 其最主要的临床特征是周期性发作的肌肉软瘫, 发作时伴随低钾血症。HypoPP中约有40%~60%由编码骨骼肌细胞L型电压门控钙通道的α1亚基的CACNA1S基因突变导致, 约7%~14%由骨骼肌细胞膜电压门控型钙通道α亚单位SCN4A基因突变导致, 尚有30%左右病因未明确[1-3]。目前国外病例报道的家族性HypoPP (familial HypoPP, f-HypoPP)较多, 发病率估计为1/10万, 最常见的突变位点是CACNA1S基因的R528H和R1239H。国内多为散发性HypoPP (sporadic HypoPP, s-HypoPP)病例报道, 报道的突变位点与国外有所不同, 如在国外最常见的突变类型R528H在国内报道较少, 仅协和医院曾报道过1例[4]。本文报道了一个东北地区三代家族遗传的f-HypoPP家系的基因和临床特点, 其突变位点为CACNA1S基因的R528H, 携带者的临床特征不尽一致。同时, 本文对国内外已报道的CACNA1S基因导致的HypoPP病例进行了归纳总结。
1 材料与方法 1.1 研究对象本研究纳入先证者及其家属共6人(包括先证者本人, 先证者姥姥、母亲、大姐、二姐、表妹)。6人中4人曾发生过肌无力症状, 2人无症状。先证者接受了病史采集、甲状腺功能、肾功能、尿常规、甲状腺和肾上腺相关激素、影像学检查, 以排除继发性低钾型周期性麻痹。本研究通过我院伦理委员会审核, 所有研究对象均签署了知情同意书。
1.2 检测方法肝肾功能、血电解质等采用全自动生化仪测定, 并行口服葡萄糖耐量试验、胰岛素释放试验。促肾上腺皮质激素、皮质醇采用免疫化学发光法测定。肾素、血管紧张素、醛固酮、胰岛素等采用放射免疫法测定。
提取先证者及其家属基因组DNA后, 采用经过生物素标记的探针(P039-Exome, 北京迈基诺公司)与文库DNA杂交, 进行外显子捕获, 在NextSeq 500 (美国Illumina公司)上进行高通量测序, 测序数据经Burrows-Wheeler Aligner (0.7.10-r1039)软件比对到人类基因组并分析(基因组版本为GRCh37/hg19)。重点筛查与低钾血症临床表型相关的基因(panel包括36个基因)。对检出的基因突变采用Sanger测序验证, 并对先证者亲属进行突变位点分析。
1.3 文献检索以“低钾型周期性麻痹(hypokalemic periodic paralysis)、CACNA1S基因(CACNA1S)、CACNA1S基因突变(CACNA1S mutation) ”等为检索词, 检索PubMed、万方、维普、CNKI等中英文数据库, 截止时间为2019年1月, 检索CACNA1S基因突变导致的HypoPP的相关文献, 并限定为人类研究。
2 结果 2.1 先证者及其家属的临床资料先证者, 男, 21岁, 以“间断乏力10年, 加重2个月”为主诉收入院。先证者10年前无明显诱因间断出现全身无力、不能行走症状, 就诊于当地医院, 诊断为“低钾血症”, 2018年6月7日于当地医院行补钾治疗, 住院期间血钾值波动在2.4~5.4 mmol/L, 为进一步诊治来我院。查体:体温36.8 ℃, 脉搏74次/min, 呼吸18次/min, 血压120/80 mmHg。辅助检查:甲状腺功能正常, 住院期间血钾值波动在2.55~5.21 mmol/L, 肾上腺增强3D-CT未见异常, 促肾上腺皮质激素-皮质醇节律和测定值在正常范围, 肾素-血管紧张素-醛固酮水平正常。先证者及其家属的其他临床资料见表 1。经询问, 家系中包括先证者共4人有类似症状, 其余2人无类似临床表现。
| Item | Ⅲ3 (proband) | Ⅰ 2 | Ⅱ 1 | Ⅲ1 | Ⅲ2 | Ⅲ 6 |
| Genotype | p.528 R/H | p.528 R/H | p.528 R/H | p.528 R/R | p.528 R/H | p.528 R/R |
| Gender/age | Male/21 years | Female/77 years | Female/50 years | Female/26 years | Female/23 years | Female/18 years |
| Age at onset (year) | 11 | 42 | 13 | - | 13 | - |
| Main trigger | Rest after exercise, carbohydrate rich meal, cold | Not clear | Rest after exercise, carbohydrate rich meal, cold | - | Rest after exercise, carbohydrate rich meal, cold | - |
| Frequency | once/1-4 weeks | Only once at 42 years of age | once/1-2 years, decreased after 20 years of age | - | once/1-2 year, decreased after 20 years of age | - |
| Duration | 2-3 days | 2-3 months | 2-3 days | - | 2-3 days | - |
| Potassium level at attack (mmol/L) | 2.55 | - | 1.92 | - | 2.81 | - |
2.2 基因检测结果
对先证者及其家属共6人(其中有症状者4人, 无症状者2人)留取了DNA, 全外显子组测序提示, 先证者的CACNA1S基因有1个杂合突变, 为c.1583G > A (编码区第1583号核苷酸由鸟嘌呤变异为腺嘌呤), 导致氨基酸改变p.R528H (第528号氨基酸由精氨酸变异为组氨酸)。经Sanger测序验证, 并对先证者亲属进行突变位点分析, 提示有症状者(先证者及其二姐、母亲、姥姥)存在相同变异, 无症状者(大姐和表妹)为正常(图 1、表 1)。
|
| 图 1 先证者的家系图和CACNA1S基因测序结果 Fig.1 Pedigree of the kindred and sequencing results of the CACNA1S gene |
2.3 已发表文献报道的CACNA1S基因突变位点的位置和特征
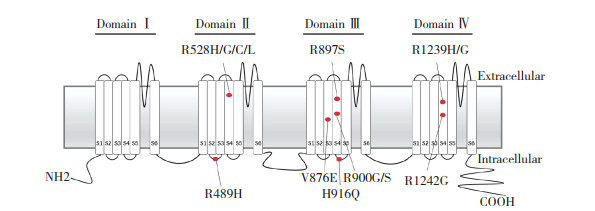
共检索到中文文献和学位论文22篇, 外文文献40篇, 确认涵盖了所有已报道的导致HypoPP的CACNA1S基因突变的相关文献。目前已报道过的CACNA1S基因突变位点共有8处, 其位置和特征见表 2和图 2。其中, R528H和R1239H这2个位点最为多见, 其他位点基本为个例报道。R528位点的氨基酸可变为4种不同的氨基酸, 其中3种(H/G/C)可造成HypoPP, 1种(L)可造成横纹肌溶解症伴无症状间歇性高肌酸激酶血症。在报道CACNA1S基因突变导致HypoPP的文献中, R528H在国外HypoPP病例报道中非常常见(22/40), 但在国内仅协和医院报道过1次(1/20)。
| Site of amino acid | Domain | Predicted protein change | Phenotype | Race | Frequency | Reference |
| 489 | Cytoplasm | R → H | Hypokalemic periodic paralysis | Caucasian | Rare | 5 |
| 528 | S4 domain Ⅱ | R → H | Hypokalemic periodic paralysis | Caucasian, Japanese, Korean, Chinese | Common | 4, 6 |
| R → G | Hypokalemic periodic paralysis | Chinese | Rare | 7 | ||
| R → C | Hypokalemic periodic paralysis | Chinese | Rare | 8 | ||
| R → L | Rhabdomyolysis with asymptomatic intermittent hypercreatine kinase | Caucasian | Rare | 9 | ||
| 876 | S3 domain Ⅲ | V → E | Hypokalemic periodic paralysis | South American, Chinese | Rare | 10 |
| 897 | S4 domain Ⅲ | R → S | Hypokalemic periodic paralysis | Turkey, Caucasian | Rare | 11 |
| R → M | Hypokalemic periodic paralysis | Chinese | Rare | 4 | ||
| 900 | S4 domain Ⅲ | R → G | Hypokalemic periodic paralysis | Japanese | Rare | 12 |
| R → S | Hypokalemic periodic paralysis | Caucasian, Chinese | Rare | 2, 4 | ||
| 916 | Cytoplasm | H → Q | Hypokalemic periodic paralysis | Chinese | Rare | 13 |
| 1 239 | S4 domain Ⅳ | R → H | Hypokalemic periodic paralysis | Caucasian, Japanese, Korean, African, Chinese | Common | 14 |
| R → G | Hypokalemic periodic paralysis | Caucasian, Korean | Rare | 2 | ||
| 1 242 | S4 domain Ⅳ | R → G | Normokalemic periodic paralysis | Caucasian | Rare | 15 |
|
| 图 2 CACNA1S基因示意图和已报道的突变位点位置 Fig.2 Schematic diagram of reported pathogenic variants of hypokalemic periodic paralysis in the CACNA1S gene |
3 讨论
HypoPP的临床特点为血钾低于3.5 mmol/L时发作性麻痹, 表现为肌肉松弛, 近端肌群较远端肌群更为常见, 深肌腱反射正常至减弱不等。发作逐渐进展数分钟至数小时, 持续时间为数分钟至数天, 会自行恢复。发作频率各异, 以天、周、月为单位常见, 有的患者甚至一生仅发作1次, 如本家系中的Ⅰ2, 仅在42岁时发作1次。主要诱因:剧烈运动(67%)或饱食之后(如丰盛晚餐后的第2天清晨, 45%);次要诱因:寒冷(24%), 发热、应激、兴奋、恐惧等与肾上腺素增高相关的因素(12%), 盐分摄入(11%);其他因素:如长时间静坐、糖皮质激素或酒精摄入、麻醉过程等。起病年龄2~30岁(平均14岁) [3, 16]。
目前HypoPP的诊断标准尚不完全统一, 有研究[7]推荐以下标准:2次或2次以上的肌无力发作, 伴随发作期间有记录的血清钾 < 3.5 mmol/L;或1次肌无力发作和1次家族成员肌无力发作, 伴随发作期间有记录的血清钾 < 3.5 mmol/L;或下述6条特点中的3条或3条以上: (1) 20岁前发病;(2)发作时间超过2 h;(3)存在诱因(碳水化合物丰富的膳食、运动后休息时的症状发作、应激等);(4)钾摄入会改善症状;(5)家族病史或基因证实的骨骼钙或钠通道突变家族史;(6)延长运动试验阳性。并且排除低钾血症的其他原因(肾、肾上腺、甲状腺功能障碍, 肾小管性酸中毒, 利尿和泻药滥用), 可适当完善临床试验进行鉴别, 如尿钾(尿钾/尿肌酐比值)测定、甲状腺功能、肌电图、特殊的运动激发实验、甚至肌肉活检等。
本文报道了一个典型的三代家族遗传的f-HypoPP家系的基因和临床特点, 为常染色体显性遗传模式, 其突变位点为CACNA1S基因的R528H。目前, 在大多数HypoPP患者中行基因检测会发现其为CACNA1S或SCN4A的杂合突变携带者(约70%), 另有30%左右的患者无法明确定位到致病基因突变位点[1]。目前已报道过的CACNA1S基因突变位点中R528H和R1239H最为多见, 其他位点基本为个例报道。国内HypoPP病例的基因突变率远低于国外, 提示国内还需更多的病例研究来证实是否国内外的基因型存在种族差异。R528位于CACNA1S蛋白的第二结构域的S4片段, 在该位点已发现多种突变模式(R/H/G/C/L), 其中R/H/G/C造成的表型为HypoPP, 但R/L表型为横纹肌溶解症伴无症状间歇性高肌酸激酶血症[9]。已知造成HypoPP的CACNA1S基因突变的8个位点中有5个位于该基因编码钙通道的同源结构域的S4片段, 是电压感受器的关键部位, 但这些突变造成低钾血症的具体机制目前仍不甚明确。
HypoPP的治疗包括针对症状的监测和治疗(如对症补钾, 监测血钾水平, 监测呼吸功能、心电图等)以及避免诱因、预防发作(低盐、低糖、富含钾饮食, 间断口服补钾)。药物治疗目前还比较有限, 可使用碳酸酐酶抑制剂(乙酰唑胺, 成人250~500 mg/d, 儿童5~10 mg·kg-1·d-1, 3次/d)或二氯苯甲酰胺(50 mg, 2次/d), 在部分患者(50%)中有效。需注意的是, 碳酸酐酶抑制剂的不良反应包括感觉异常、疲劳、轻度可逆性认知障碍和肾结石的风险增加。如上述药物治疗仍不能避免反复发作, 可尝试使用保钾利尿剂, 如氨苯蝶啶(50~150 mg/d)、螺内酯(25~100 mg/d)或依普利酮(50~100 mg/d)。预防继发性损伤也很重要, 如创造安全性环境、避免跌倒等[17]。本研究的家系中, 女性症状相对较轻, 仅间断口服补钾治疗即可, 由于目前国内购药途径有限, 先证者仅给予口服补钾和螺内酯治疗, 症状改善不十分明显。
综上所述, 本文报道了一个我国东北地区三代家族遗传的f-HypoPP家系的基因和临床特点, 提示了CACNA1S基因的热点突变R528H在我国可能并不罕见, 还需更大的HypoPP人群研究来证实。
| [1] |
MATTHEWS E, PORTARO S, KE Q, et al. Acetazolamide efficacy in hypokalemic periodic paralysis and the predictive role of genotype[J]. Neurology, 2011, 77(22): 1960-1964. DOI:10.1212/WNL.0b013e31823a0cb6 |
| [2] |
MATTHEWS E, LABRUM R, SWEENEY MG, et al. Voltage sensor charge loss accounts for most cases of hypokalemic periodic paralysis[J]. Neurology, 2009, 72(18): 1544-1547. DOI:10.1212/01.wnl.0000342387.65477.46 |
| [3] |
MILLER TM, DIAS DA SILVA MR, MILLER HA, et al. Correlating phenotype and genotype in the periodic paralyses[J]. Neurology, 2004, 63(9): 1647-1655. DOI:10.1212/01.wnl.0000143383.91137.00 |
| [4] |
崔云英, 王芬, 李春艳, 等. 低钾型周期性麻痹患者的临床及基因特征[J]. 医学研究杂志, 2016, 45(9): 72-75. DOI:10.11969/j.issn.1673-548X.2016.09.019 |
| [5] |
STUNNENBERG BC, RAAPHORST J, DEENEN JCW, et al. Prevalence and mutation spectrum of skeletal muscle channelopathies in the Netherlands[J]. Neuromuscul Disord, 2018, 28(5): 402-407. DOI:10.1016/j.nmd.2018.03.006 |
| [6] |
JURKAT-ROTT K, LEHMANN-HORN F, ELBAZ A, et al. A calcium channel mutation causing hypokalemic periodic paralysis[J]. Hum Mol Genet, 1994, 3(8): 1415-1419. DOI:10.1093/hmg/3.8.1415 |
| [7] |
WANG Q, LIU M, XU C, et al. Novel CACNA1S mutation causes autosomal dominant hypokalemic periodic paralysis in a Chinese family[J]. J Mol Med (Berl), 2005, 83(3): 203-208. DOI:10.1007/s00109-005-0638-4 |
| [8] |
YANG B, YANG Y, TU W, et al. A rare case of unilateral adrenal hyperplasia accompanied by hypokalaemic periodic paralysis caused by a novel dominant mutation in CACNA1S:features and prognosis after adrenalectomy[J]. BMC Urol, 2014, 14: 96. DOI:10.1186/1471-2490-14-96 |
| [9] |
ANANDAN C, CIPRIANI MA, LAUGHLIN RS, et al. Rhabdomyolysis and fluctuating asymptomatic hyperCKemia associated with CACNA1S variant[J]. Eur J Neurol, 2018, 25(2): 417-419. DOI:10.1111/ene.13528 |
| [10] |
KE T, GOMEZ CR, MATEUS HE, et al. Novel CACNA1S mutation causes autosomal dominant hypokalemic periodic paralysis in a South American family[J]. J Hum Genet, 2009, 54(11): 660-664. DOI:10.1038/jhg.2009.92 |
| [11] |
CHABRIER S, MONNIER N, LUNARDI J. Early onset of hypokalaemic periodic paralysis caused by a novel mutation of the CACNA1S gene[J]. J Med Genet, 2008, 45(10): 686-688. DOI:10.1136/jmg.2008.059766 |
| [12] |
HIRANO M, KOKUNAI Y, NAGAI A, et al. A novel mutation in the calcium channel gene in a family with hypokalemic periodic paralysis[J]. J Neurol Sci, 2011, 309(1/2): 9-11. DOI:10.1016/j.jns.2011.07.046 |
| [13] |
LI FF, LI QQ, TAN ZX, et al. A novel mutation in CACNA1S gene associated with hypokalemic periodic paralysis which has a gender difference in the penetrance[J]. J Mol Neurosci, 2012, 46(2): 378-383. DOI:10.1007/s12031-011-9596-1 |
| [14] |
KUSUMI M, KUMADA H, ADACHI Y, et al. Muscle weakness in a Japanese family of Arg1239His mutation hypokalemic periodic paralysis[J]. Psychiatry Clin Neurosci, 2001, 55(5): 539-541. DOI:10.1046/j.1440-1819.2001.00902.x |
| [15] |
FAN C, LEHMANN-HORN F, WEBER MA, et al. Transient compartment-like syndrome and normokalaemic periodic paralysis due to a Cav 1.1 mutation[J]. Brain, 2013, 136(Pt 12): 3775-3786. DOI:10.1093/brain/awt300 |
| [16] |
CAVEL-GREANT D, LEHMANN-HORN F, JURKAT-ROTT K. The impact of permanent muscle weakness on quality of life in periodic paralysis:a survey of 66 patients[J]. Acta Myol, 2012, 31(2): 126-133. |
| [17] |
LEVITT JO. Practical aspects in the management of hypokalemic periodic paralysis[J]. J Transl Med, 2008, 6: 18. DOI:10.1186/1479-5876-6-18 |
 2020, Vol. 49
2020, Vol. 49