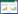文章信息
- 褚旭芳, 王笑楠, 范秋灵, 汪旭
- CHU Xufang, WANG Xiaonan, FAN Qiuling, WANG Xu
- 芦丁在葡聚糖硫酸钠诱导的小鼠急性结肠炎中的作用及其机制
- Role of rutin in dextran sodium sulfate-induced acute colitis in mice and the mechanism underlying its effects
- 中国医科大学学报, 2020, 49(9): 788-792
- Journal of China Medical University, 2020, 49(9): 788-792
-
文章历史
- 收稿日期:2019-06-03
- 网络出版时间:2020-09-11 10:53
2. 中国医科大学附属第一医院 肾内科, 沈阳 110001
2. Department of Nephrology, The First Hospital, China Medical University, Shenyang 110001, China
炎症性肠病(inflammatory bowel disease, IBD)是一种顽固性、慢性非特异性炎性疾病, 其特征是嗜中性粒细胞、巨噬细胞、淋巴细胞和肥大细胞透壁渗透引起肠道炎症发展, 最终引起黏膜破坏和溃疡[1]。IBD包括溃疡性结肠炎和克罗恩病。传统观念认为, 溃疡性结肠炎主要与辅助性T细胞(helper T cell, Th) 2型反应相关, 然而越来越多的研究表明, 溃疡性结肠炎还与由结肠黏膜中的促炎细胞因子如γ干扰素(interferon-γ, IFN-γ)、白细胞介素(interleukin, IL)-1β、肿瘤坏死因子-α、IL-17过量产生介导的Th1和Th17免疫应答有关[2-3]。而葡聚糖硫酸钠(dextran sulfate sodium, DSS)诱导的小鼠结肠炎是与人类非常相似、研究最广泛的动物模型[4]。芦丁是一种大量存在于荞麦、洋葱、茶叶和苹果等植物中的黄酮醇, 具有抗炎、抗氧化、细胞保护、血管保护、神经保护和心脏保护等活性。目前, 芦丁主要作为血管保护剂应用于临床。据报道, 芦丁对溃疡性结肠炎具有一定的治疗作用, 但关于芦丁和溃疡性结肠炎的研究较少, 尚未见研究报道芦丁通过调节肠固有层T淋巴细胞(lamina propria lymphocyte, LPL)的免疫应答对结肠炎起作用。本研究通过构建DSS诱导的小鼠急性结肠炎模型, 采用动物模型、流式细胞染色等方法探讨芦丁对急性结肠炎的作用及其机制。
1 材料与方法 1.1 实验动物BALB/c小鼠(SPF级), 雄性, 6~8周, 体质量18~22 g, 购自北京维通利华实验动物技术有限公司。饲养于中国医科大学实验动物中心SPF级动物实验室, 温度24 ℃, 湿度(50±10) %, 勤换垫料, 喂食SPF级小鼠饲料和清洁消毒饮水。本研究经中国医科大学动物实验伦理委员会批准。
1.2 DSS诱导的小鼠急性结肠炎模型的建立和观察将小鼠随机分成实验组(n = 3)和对照组(n = 3)。2组小鼠均自由饮用配置的3%DSS溶液。实验组将芦丁按50 mg·kg-1·d-1剂量灌胃, 对照组以等体积(5×10-6 mL·kg-1·d-1)生理盐水灌胃。实验重复3次。依照COOPER等[5]的评分标准, 每天称量并记录各组小鼠的体质量。体质量下降评分:0, 无体质量下降;1, 体质量下降1%~5%;2, 体质量下降6%~10%;3, 体质量下降11%~20%;4, 体质量下降 > 20%。观察小鼠的大便性状、便血情况。大便性状评分:0, 大便正常;2, 大便松软;4, 稀便。大便隐血评分:0, 正常;2, 隐血阳性;4, 肉眼血便。计算疾病活动指数(disease activity index, DAI), DAI=体质量下降评分+大便性状评分+大便隐血评分。
1.3 结肠病理观察建模5 d后脱颈处死小鼠, 取小鼠结肠近心端二分之一组织, 约0.5 cm, 冲洗干净, 置于4%多聚甲醛溶液中4 ℃避光保存。经过脱水、透明、浸蜡、包埋、切片、烤片、脱腊、HE染色、脱水透明封片后, 在光学显微镜下观察结肠组织的病理变化。根据SUN等[6]的炎症分级标准进行评分。上皮(E):0, 黏膜组织完整;1, 杯状细胞消失;2, 杯状细胞大面积消失;3, 隐窝消失;4, 隐窝大面积消失。炎症浸润(I):0, 无炎症浸润;l, 基底部炎症浸润;2, 炎症浸润到黏膜肌层;3, 黏膜肌层有大量炎症浸润, 黏膜层增厚并伴有水肿;4, 炎症浸润到黏膜下层。病理评分=E+I。
1.4 肠LPL的提取取出从回盲部游离至肛门口的大肠, 去除肠管上的派氏淋巴结, 用PBS洗净后将结肠组织剪碎, 在补充有1%胎牛血清和5 mmol/L乙二胺四乙酸的RPMI 1640培养基中振荡, 150 r/min、37 ℃水浴20 min, 重复2次。弃上清以除去上皮细胞和上皮内淋巴细胞。加入补充有20%胎牛血清的RPMI 1640、1 mL混合胶原酶(200 U/mL)和50 µL DNase-Ⅰ (10 mg/mL)振荡, 150 r/min、37 ℃水浴60 min, 用20 mL注射器反复吹打50次后再次水浴30 min, 吹打50次后, 收集消化溶液的上清液, 小心地在45%/66.6%不连续的细胞分离液梯度上分层, 并在室温下以2 000 r/min离心10 min。弃上清, 加Hanks平衡盐溶液至10 mL, 振荡, 取液体与台盼蓝各10 µL计数细胞, 显微镜下预测细胞数。
1.5 流式细胞术胞内染色检测肠固有层中Th细胞细胞计数后, 悬浮在补充有10%胎牛血清的RPMI 1640培养基中。将细胞分为阴性孔和阳性孔, 各200 µL, 分别加入到96孔板中。阳性孔:细胞悬液200 µL+佛波酯10 µL+离子霉素8 µL;阴性孔:细胞悬液200 µL, 吹打混匀;阳性孔和阳性孔均加入布雷菲德菌素A 4 µL, 吹打混匀, 置于37 ℃、5%CO2的细胞培养箱孵育4 h。孵育结束后按照制造商(美国BD Biosciences公司)的说明进行表面抗体染色、固定、破膜、洗涤, 并用细胞内抗体染色。染色后的细胞用流式细胞仪(FACSAria, 美国BD Biosciences公司)检测。
1.6 统计学分析采用SPSS 22.0软件进行统计分析, 数据以x±s表示, 组间比较采用Student t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 芦丁对DSS诱导的急性结肠炎具有保护作用2组小鼠口服3%DSS溶液5 d后均出现腹泻、黑便或便血和体质量减轻等结肠炎症状, 表明小鼠急性结肠炎模型造模成功。与对照组相比, 实验组小鼠体质量损失较低, 第1天(实验组与对照组分别为104.6%±0.4%和102.8%±0.5%, P < 0.01)和第5天(实验组与对照组分别为103.1%±0.7%和97.3%±3.1%, P < 0.05)有统计学差异。第1天后对照组的DAI高于实验组, 并于第4天出现统计学差异(实验组与对照组分别为1.33±0.94和4.33±0.47, P < 0.05)。见图 1。
|
| A, weight loss; B, disease activity index. * P < 0.05 vs control group; ** P < 0.01 vs control group. 图 1 2组小鼠体质量和DAI的变化 Fig.1 Changes in weight loss and disease activity index of mice in two groups |
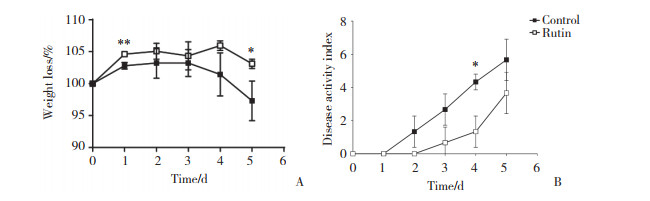
实验组和对照组的结肠长度分别为(6.86±0.89) cm和(7.21±0.85) cm, 2组比较无统计学差异(P > 0.05)。实验组与对照组相比, 结肠炎症较轻, 组织学评分显著降低(实验组与对照组分别为2.0±1.4和6.0±0.8, P < 0.05)。见图 2。
|
| A, colon length; B, colon histopathology (×10). 图 2 2组小鼠结肠长度和组织病理学 Fig.2 Colon length and histopathology of mice in two groups |
2.2 芦丁改变急性结肠炎小鼠结肠LPL中的免疫细胞组成
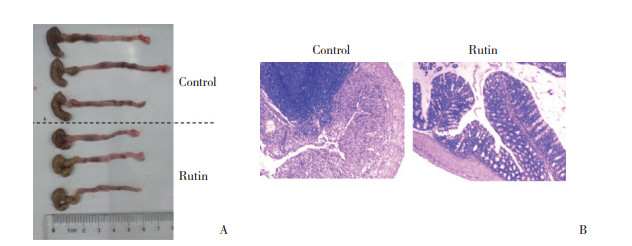
流式细胞术结果显示, 与对照组相比, 实验组小鼠LPL中的CD4+和CD8+ T淋巴细胞比例明显降低(P < 0.05), γδT细胞绝对数和比例未见明显变化。表明芦丁对DSS诱导的小鼠急性结肠炎具有有效的免疫调节作用。见图 3、4。
|
| A, proportion of CD4+ and CD8+ T lymphocytes; B, cell percent and cell number of CD4+ and CD8+ T lymphocytes. * P < 0.05 vs control group. 图 3 2组小鼠LPL中CD4+和CD8+ T淋巴细胞的比例和绝对数 Fig.3 Proportion and absolute number of CD4+ and CD8+ T lymphocytes in LPL of mice in two groups |
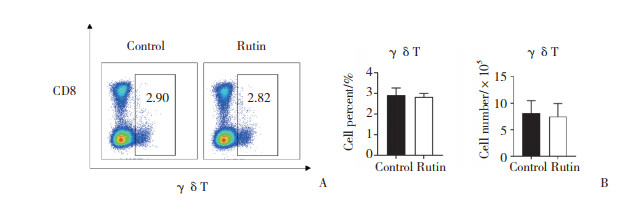
|
| A, proportion of γδT lymphocytes; B, cell percent and cell number of γδT lymphocytes. 图 4 2组小鼠LPL中γδT细胞的比例和绝对数 Fig.4 Proportion and absolute number of γδT lymphocytes in LPL of mice in two groups |
2.3 芦丁抑制DSS诱导的结肠炎模型中肠LPL中Th1和Th17细胞免疫应答
流式细胞术结果显示, 与对照组相比, 实验组小鼠中CD4+ T细胞中Th1诱导分化的IFN-γ+细胞比例明显降低(P < 0.05), Th17诱导分化的IL-17A+细胞比例和绝对数均明显降低(P < 0.05), IFN-γ+ IL-17A+细胞绝对数明显降低(P < 0.01)。见图 5。
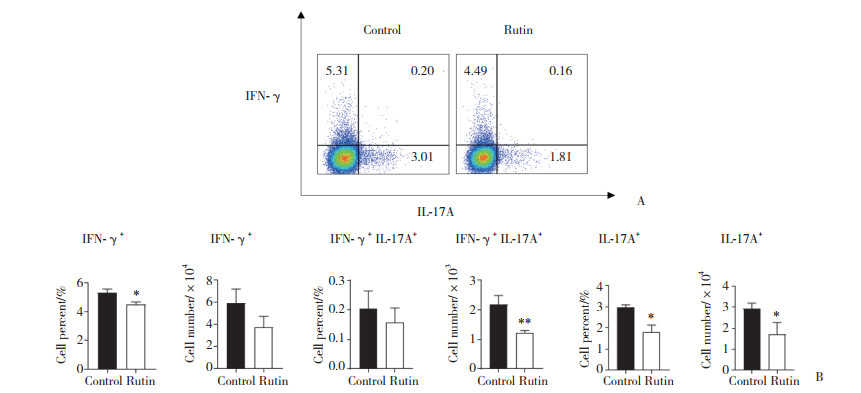
|
| A, proportion of CD4+ IFN-γ+, CD4+ IL-17A+, and CD4+ IFN-γ+ IL-17A+ T lymphocytes; B, cell percent and cell number of CD4+ IFN-γ+, CD4+ IL-17A+, and CD4+ IFN-γ+ IL-17A+ T lymphocytes. * P < 0.05 vs control group; ** P < 0.01 vs control group. 图 5 2组小鼠LPL中Th1和Th17细胞的比例和绝对数 Fig.5 Proportion and absolute number of Th1 and Th17 cells in LPL of mice in two groups |
3 讨论
溃疡性结肠炎是IBD中一种慢性肠道炎性疾病, 在世界范围内其发病率高, 确切发病机制尚不明确。针对特定免疫应答组分的非甾体抗炎药、免疫抑制剂和生物疗法可有效控制溃疡性结肠炎的症状, 但这些治疗有潜在的不良反应, 如类固醇依赖和严重感染[7]。因此, 寻求一种新的治疗溃疡性结肠炎的方法非常必要。芦丁具备活性丰富、可用性广、制备简单、价格便宜和不良反应少等优点, 有研究表明, 芦丁对实验性结肠炎具有保护作用。DSS结肠炎模型由于其快速、简单、可重复性和可控性在IBD研究中非常流行, 并且与人类溃疡性结肠炎有很多类似的症状和体征, 包括腹泻、血便、体质量减轻、结肠缩短和黏膜溃疡[4, 7]。因此, 本研究探讨了芦丁对DSS诱导的急性结肠炎的作用及其机制, 结果表明, 芦丁对DSS诱导的急性结肠炎具有保护作用。
淋巴细胞代表在初始和重复接触抗原期间产生免疫应答所需的关键白细胞亚群, 根据表面上B或T细胞受体的表达将其分化为B淋巴细胞和T淋巴细胞, T淋巴细胞根据其T细胞受体进一步分为αβT淋巴细胞和γδT淋巴细胞, αβT淋巴细胞进一步可分为CD4+或CD8+ αβT淋巴细胞[8]。CD4+ T淋巴细胞可进一步分化成Th1、Th2、Th17、调节性T细胞等细胞。在IBD的免疫病理学中, 关键机制之一是CD4+ T细胞的失衡, 其主要包括表达IFN-γ的Th1细胞, 分泌IL-4的Th2细胞, 表达IL-17A、IL-17F的Th17细胞以及表达IL-22的Th22细胞[9]。Th1细胞参与针对细胞内病原体的免疫应答, 涉及包括IBD在内的多种免疫疾病[10]。结肠炎症的易感性与免疫系统中的Th1极化相关, 在诱导肿瘤坏死因子-α和IFN-γ产生中尤其明显[11]。IBD全基因组关联研究[12]提示, 至少有24个单核苷酸多态性与Th17调节的细胞内网络和信号转导相关的基因座相关, 表明Th17对IBD发病机制发挥重要作用。Th17及其细胞因子IL-17A、IL-21、IL-22在活动性IBD涉及的肠黏膜中增加, 并且其增加与临床-内窥镜评估的疾病活动性相关[13]。此外, T细胞的可塑性, 特别是沿Th1-Th17和Th17-Treg轴的可塑性, 在IBD肠道免疫反应的调节中起着重要作用[12]。有研究[14]表明, 共享Th1标记的Th17细胞亚群可能特异性参与克罗恩病和溃疡性结肠炎的肠道炎症, 表明肠IFN-γ+ IL-17+共同产生的CD4+ T细胞也可能作为疾病活动性的生物标志物。因此, 本研究通过流式细胞术分析2组小鼠LPL中Th1和Th17细胞的免疫应答, 研究芦丁对DSS诱导的急性结肠炎的作用机制, 结果表明, 芦丁可能通过抑制Th1和Th17的免疫应答发挥作用。
综上所述, 芦丁可能通过抑制免疫应答在DSS诱导的急性结肠炎的发生、发展中起到重要的保护作用, 其机制包括肠LPL中CD4+、CD8+ T淋巴细胞和Th1和Th17细胞减少及促炎细胞因子IFN-γ和IL-17A分泌减少。本研究为芦丁可能成为缓解IBD个体急性炎症的新型治疗方法提供了实验依据, 但更细致的作用机制还需进一步研究。本研究样本量相对较少, 且缺少相关研究与报道。因此, 需要更多、更详实的研究甚至临床试验来验证芦丁作为免疫调节剂应用于IBD的潜力。
| [1] |
RABIŠKOVÁ M, BAUTZOVÁ T, GAJDZIOK J, et al. Coated chitosan pellets containing rutin intended for the treatment of inflammatory bowel disease:in vitro characteristics and in vivo evaluation[J]. Int J Pharm, 2012, 422(1/2): 151-159. DOI:10.1016/j.ijpharm.2011.10.045 |
| [2] |
ALEX P, ZACHOS NC, NGUYEN T, et al. Distinct cytokine patterns identified from multiplex profiles of murine DSS and TNBS-induced colitis[J]. Inflamm Bowel Dis, 2009, 15(3): 341-352. DOI:10.1002/ibd.20753 |
| [3] |
ACHARYA S, TIMILSHINA M, JIANG L, et al. Amelioration of experimental autoimmune encephalomyelitis and DSS induced colitis by NTG-A-009 through the inhibition of Th1 and Th17 cells differentiation[J]. Sci Rep, 2018, 8(1): 7799. DOI:10.1038/s41598-018-26088-y |
| [4] |
CHASSAING B, AITKEN JD, MALLESHAPPA M, et al. Dextran sulfate sodium (DSS) -induced colitis in mice[J]. Curr Protoc Immunol, 2014, 104: 15. DOI:10.1002/0471142735.im1525s104 |
| [5] |
COOPER HS, MURTHY SN, SHAH RS, et al. Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J]. Lab Invest, 1993, 69(2): 238-249. |
| [6] |
SUN X, SOMADA S, SHIBATA K, et al. A critical role of CD30 ligand/CD30 in controlling inflammatory bowel diseases in mice[J]. Gastroenterology, 2008, 134(2): 447-458. DOI:10.1053/j.gastro.2007.11.004 |
| [7] |
PANDURANGAN AK, MOHEBALI N, NORHAIZAN ME, et al. Gallic acid attenuates dextran sulfate sodium-induced experimental colitis in BALB/c mice[J]. Drug Des Devel Ther, 2015, 9: 3923-3934. DOI:10.2147/DDDT.S86345 |
| [8] |
SEKELOVA Z, POLANSKY O, STEPANOVA H, et al. Different roles of CD4, CD8 and γδ T-lymphocytes in naive and vaccinated chickens during Salmonella Enteritidis infection[J]. Proteomics, 2017, 17(13/14): 10. DOI:10.1002/pmic.201700073 |
| [9] |
GUI X, LI J, UENO A, et al. Histopathological features of inflammatory bowel disease are associated with different CD4+ T cell subsets in colonic mucosal lamina propria[J]. J Crohns Colitis, 2018, 12(12): 1448-1458. DOI:10.1093/ecco-jcc/jjy116 |
| [10] |
GWELA A, SIDDHANATHI P, CHAPMAN RW, et al. Th1 and innate lymphoid cells accumulate in primary sclerosing cholangitis-associated inflammatory bowel disease[J]. J Crohns Colitis, 2017, 11(9): 1124-1134. DOI:10.1093/ecco-jcc/jjx050 |
| [11] |
YANG F, WANG D, LI Y, et al. Th1/Th2 balance and Th17/Treg-mediated immunity in relation to murine resistance to dextran sulfate-induced colitis[J]. J Immunol Res, 2017, 2017: 7047201. DOI:10.1155/2017/7047201 |
| [12] |
UENO A, JEFFERY L, KOBAYASHI T, et al. Th17 plasticity and its relevance to inflammatory bowel disease[J]. J Autoimmun, 2018, 87: 38-49. DOI:10.1016/j.jaut.2017.12.004 |
| [13] |
JIANG W, SU J, ZHANG X, et al. Elevated levels of Th17 cells and Th17-related cytokines are associated with disease activity in patients with inflammatory bowel disease[J]. Inflamm Res, 2014, 63(11): 943-950. DOI:10.1007/s00011-014-0768-7 |
| [14] |
GLOBIG AM, HENNECKE N, MARTIN B, et al. Comprehensive intestinal T helper cell profiling reveals specific accumulation of IFN-γ+IL-17+ coproducing CD4+ T cells in active inflammatory bowel disease[J]. Inflamm Bowel Dis, 2014, 20(12): 2321-2329. DOI:10.1097/MIB.0000000000000210 |
 2020, Vol. 49
2020, Vol. 49