文章信息
- 雷天霞, 王海星, 刘香, 郑永胜, 陈进忠, 吴建海
- LEI Tianxia, WANG Haixing, LIU Xiang, ZHENG Yongsheng, CHEN Jinzhong, WU Jianhai
- 微探头内镜超声在直径≤1 cm的直肠神经内分泌瘤内镜治疗中的应用价值
- Application of endoscopic ultrasonography using a miniature probe scanner in the endoscopic treatment of rectal neuroendocrine tumors with diameters of ≤ 1 cm
- 中国医科大学学报, 2020, 49(8): 757-760
- Journal of China Medical University, 2020, 49(8): 757-760
-
文章历史
- 收稿日期:2019-10-16
- 网络出版时间:2020-07-08 17:06
2. 中国医科大学附属盛京医院消化内科, 沈阳 110004
近年来,直肠神经内分泌瘤发病率呈快速上升趋势,约占消化道神经内分泌瘤的48%[1]。术前评估肿瘤大小、浸润深度以及有无远处转移对于直肠神经内分泌瘤治疗极其重要[1]。最新的共识指南[2-3]推荐对于直径≤1 cm直肠神经内分泌瘤,因远处浸润转移风险较低,且大部分局限于黏膜层及黏膜下层,可通过内镜下治疗达到临床治愈。
内镜超声检查评估直肠神经内分泌瘤的大小和局部分期准确性很高,对于确定治疗方案有很大参考价值。直肠神经内分泌瘤评估一般使用微探头内镜超声检查(频率20 MHz),可以清晰显示病灶浸润消化道管壁的层次,可根据病变内部回声提供诊断依据。但由于穿透性较弱,对于直肠周围有无淋巴结转移的评估价值有限。小的直肠神经内分泌瘤一般局限于黏膜层及黏膜下层,极少浸润至固有肌层,也极少有远处淋巴结转移。本研究探讨微探头内镜超声检查在直径≤1 cm的直肠神经内分泌瘤治疗中的应用价值。
1 材料与方法 1.1 研究对象、仪器与分组收集厦门大学附属第一医院内镜中心2011年8月到2018年12月经内镜诊治的直径≤1 cm直肠神经内分泌瘤患者临床资料。纳入标准:(1)确诊为直肠神经内分泌瘤;(2)临床资料完整。排除标准:(1)肿瘤直径 > 1 cm;(2)合并其他恶性肿瘤。共纳入59例患者,男33例(55.9%),女26例(44.1%),平均年龄(45.02±10.89)岁。共63个病灶纳入本研究(其中4例患者直肠上均有2个病灶)。患者均是常规内镜检查中偶然发现病灶,无临床症状,均在术前行盆腹腔CT扫描或核磁共振检查评估有无肠周淋巴结及远处转移。根据术前是否行微探头内镜超声检查分为内镜超声组(EUS组,n = 40)和对照组(n = 19)。仪器包括电子胃镜或结肠镜(260或290型,日本Olympus公司)、超声内镜系统(EU-M2000,日本Olympus公司)。
1.2 治疗患者术前均未行活检。45例行内镜下黏膜剥离术(endoscopic submucosal dissection,ESD),EUS组33例,对照组12例;14例行内镜下黏膜切除术(endoscopic mucosal resection,EMR),EUS组7例,对照组7例。患者均于术后6个月,1、2、3、5年随访检查。
1.3 微探头内镜超声检查操作过程检查前使用50%硫酸镁溶液充分清洁肠道;内镜插入直肠病灶部位,经内镜活检孔道置入微探头,同时经内镜注水系统将脱气水注入直肠肠腔内,将探头浸泡在水中对直肠病灶部位进行扫查。
1.4 测量指标收集患者临床资料,包括内镜下诊断、微探头内镜超声诊断以及病理诊断结果。通过内镜、微探头内镜超声和病理测量EUS组病灶大小和浸润深度;通过内镜、病理测量对照组病灶大小。内镜下病灶大小的测量根据活检钳大小作为尺度来判定[4]。病理学评估病灶大小、核分裂像、CK、SY、CD56、CgA、Ki-67指数、有无脉管侵犯及切缘情况,肿瘤分级采用欧洲神经内分泌肿瘤学会分级标准[5-6]。
1.5 统计学分析采用SPSS 18.0统计软件进行分析。计量资料采用x±s,组间比较采用t检验;计数资料采用率(%)表示,组间比较采用配对资料t检验,P < 0.05为差异有统计学意义。
2 结果55例(93.2%)患者病理分级为G1,没有脉管浸润;4例(6.8%)患者为G2,其中1例有直肠周围淋巴结微转移,接受了外科手术治疗;1例因切缘阳性且脉管有浸润,追加内镜下ESD术后创面活检,活检显示病灶残余阴性。患者术中均无出血、穿孔,术后均无迟发性出血及穿孔。随访过程中均未见复发。随访时间180~2 675 d,中位随访时间567 d。
2.1 2组临床指标比较结果显示,2组各项临床指标比较差异没有统计学意义(均P > 0.05)。见表 1。
| 项目 | EUS组(n = 40) | 对照组(n = 19) |
| 肿瘤大小(mm) | ||
| 内镜 | 5.74±1.75 | 5.11±1.99 |
| 内镜超声 | 5.64±1.76 | - |
| 病理 | 5.62±1.85 | 4.92±1.55 |
| 肿瘤形态[n(%)] | ||
| 扁平或轻度隆起 | 32(80.0) | 16(84.2) |
| 不规则 | 8(20.0) | 3(15.8) |
| 手术方式[n(%)] | ||
| ESD | 33(82.5) | 12(63.2) |
| EMR | 7(17.5) | 7(36.8) |
| 病理分级[n(%)] | ||
| G1 | 37(92.5) | 18(94.7) |
| G2 | 3(7.5) | 1(5.3) |
| G3 | 0 | 0 |
| 脉管浸润[n(%)] | ||
| 有 | 2(5) | 0 |
| 无 | 38(95) | 19(100) |
| ESD,内镜下黏膜剥离术;EMR,内镜下黏膜切除术. | ||
2.2 病灶内镜、微探头内镜超声检查及测量结果
结果显示,内镜检查48例(81.4%)表现为略微隆起或者扁平病灶,色泽略黄或稍苍白(图 1);11例(18.6%)表现为隆起不规则病灶。微探头内镜超声检查病灶均表现为低回声团块,位于直肠壁第2层或第3层内(图 2)。
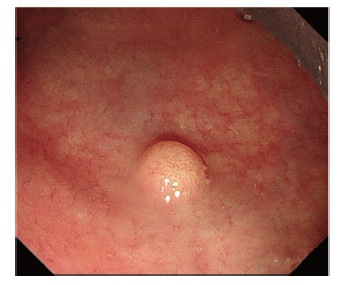
|
| 图 1 内镜下距肛门口6 cm直肠处见淡黄色结节样隆起 |
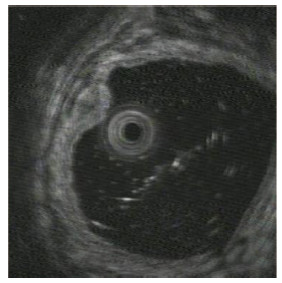
|
| 图 2 微探头内镜超声检查见低回声肿块起源于肠壁第2层 |
对照组内镜和病理测量病灶大小差别无统计学意义(P > 0.05)。EUS组内镜、微探头内镜超声和病理测量的病灶大小也无统计学差异(P > 0.05)。见表 1。说明内镜下借助测量工具能准确估算病灶大小。
2.3 微探头内镜超声检查与术后病理的肿瘤浸润深度比较术后病理结果显示,11例(18.6%)病灶来源于直肠壁第2层,48例(81.4%)来源于直肠壁第3层。所有病灶均没有累及固有肌层。EUS组中,内镜超声结果显示病灶来源于直肠壁第2层6例(15.0%),第3层34例(85.0%);术后病理证实病灶来源于直肠壁第2层5例(12.5%),第3层35例(87.5%)。微探头判断准确度为97.5%。
3 讨论小的直肠神经内分泌瘤是一种相对惰性的肿瘤,极少会发生肠周淋巴结转移和远处转移,经内镜局部切除病灶是治疗的首选。对于直径≤1 cm且没有脉管浸润的直肠神经内分泌瘤,内镜微创治疗可以达到临床治愈,但前提条件是没有发生转移。因此,术前评估直肠神经内分泌瘤是否存在转移至关重要。直肠神经内分泌瘤转移的危险因素包括肿瘤大小、固有肌层侵犯、病理分级(Ki-67指数和核分裂像)、脉管浸润以及不典型的内镜表现[7-8]。肿瘤直径 > 1 cm且有淋巴管浸润表现与淋巴结转移强相关;如具有其中一个表现淋巴结转移概率为16%[8],如果二者同时出现淋巴结转移概率为77%[9]。有研究[10]报道小的直肠神经内分泌瘤发生肠周淋巴转移的概率为9.7%,远处转移概率为2%~8%[11-12]。本研究中,病理分级为G2患者中只有1例(1.7%)发现肠周淋巴结转移,较JIANG等[13]研究结果概率小,可能是本研究样本较小所致。为了确定术前有无淋巴结转移,所有患者均接受术前CT或MRI检查。内镜超声检查能够确定直肠神经内分泌瘤病灶大小及分期,这对治疗方案的选择非常重要[14-15]。本研究结果显示,内镜、微探头内镜超声检查、病理测量的病灶大小没有统计学差异(P > 0.05),可见内镜可以准确测量病灶大小,对于小的直肠神经内分泌瘤,微探头内镜超声检查价值可能有限。分析其原因可能为:(1)小的直肠神经内分泌瘤病灶小,界限清晰,侵犯固有肌层可能性很低,内镜下可准确估计病灶大小;(2)微探头视野较小,穿透力差,往往不能探及肠周淋巴结;(3)微探头内镜超声检查无法判断病灶的病理分级和脉管浸润情况,病灶分期有限。因此,直肠神经内分泌瘤淋巴结转移风险应结合术后病理分级和CT或MRI来判断。
之前有研究[16-17]指出内镜测量病灶大小不准确。本研究结果表明,对于小的直肠神经内分泌瘤,内镜、超声内镜均可准确测量病灶大小。本研究中所有病灶均没有侵犯直肠固有肌层,因此认为小的直肠神经内分泌瘤术前微探头内镜超声检查评估并不是必须的,与PARK等[18]研究结果一致。
综上所述,对于直径≤1 cm的直肠神经内分泌瘤内镜治疗前未行微探头内镜超声检查不会影响患者的后续诊疗。本研究存在的不足之处:(1)本研究是回顾性研究,数据可能存在选择性偏倚;(2)病灶大小因内镜医师不同而出现偏倚;(3)样本较小,尚需多中心、前瞻性的临床对照研究来进一步论证。
| [1] |
KIM J, KIM JH, LEE JY, et al. Clinical outcomes of endoscopic mucosal resection for rectal neuroendocrine tumor[J]. BMC Gastroenterology, 2018, 18(1): 77. DOI:10.1186/s12876-018-0806-y |
| [2] |
XU G, WANG P, XIAO Y, et al. Local resection of rectal neuroendocrine tumor with first clinical manifestation of giant liver metastasis by transanal endoscopic microsurgery:a case report[J]. Medicine, 2017, 96(50): e9153. DOI:10.1097/MD.0000000000009153 |
| [3] |
CHABLANEY S, ZATOR ZA, KUMTA NA. Diagnosis and management of rectal neuroendocrine tumors[J]. Clin Endosc, 2017, 50(6): 530-536. DOI:10.5946/ce.2017.134 |
| [4] |
HWANG JH, SAUNDERS MD, RULYAK SJ, et al. A prospective study comparing endoscopy and EUS in the evaluation of GI subepithelial masses[J]. Gastrointest Endosc, 2005, 62(2): 202-208. DOI:10.1016/s0016-5107(05)01567-1 |
| [5] |
KIM GU, YOO SH, HAN S, et al. Sa1762 usefulness of precut endoscopic mucosal resection for treatment of rectal neuroendocrine tumors[J]. Gastrointest Endosc, 2016, 83(5): AB290. DOI:10.1016/j.gie.2016.03.457 |
| [6] |
ANDRÉ TR, BRITO M, FREIRE JG, et al. Rectal and anal canal neuroendocrine tumours[J]. J Gastrointest Oncol, 2018, 9(2): 354-357. DOI:10.21037/jgo.2017.10.01 |
| [7] |
CAPLIN M, SUNDIN A, NILLSON O, et al. ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms:colorectal neuroendocrine neoplasms[J]. Neuroendocrinology, 2012, 95(2): 88-97. DOI:10.1159/000335594 |
| [8] |
DE MESTIER L, BRIXI H, GINCUL R, et al. Updating the management of patients with rectal neuroendocrine tumors[J]. Endoscopy, 2013, 45(12): 1039-1046. DOI:10.1055/s-0033-1344794 |
| [9] |
HE B, JI T, ZHANG H, et al. MRI-based radiomics signature for tumor grading of rectal carcinoma using random forest model[J]. J Cell Physiol, 2019, 234(11): 20501-20509. DOI:10.1002/jcp.28650 |
| [10] |
TAKATSU Y, FUKUNAGA Y, NAGASAKI T, et al. Short-and long-term outcomes of laparoscopic total mesenteric excision for neuroendocrine tumors of the rectum[J]. Dis Colon Rectum, 2017, 60(3): 284-289. DOI:10.1097/DCR.0000000000000745 |
| [11] |
MODLIN IM, LYE KD, KIDD M. A 5-decade analysis of 13, 715 carcinoid tumors[J]. Cancer, 2003, 97(4): 934-959. DOI:10.1002/cncr.11105 |
| [12] |
MCDERMOTT FD, HEENEY A, COURTNEY D, et al. Rectal carcinoids:a systematic review[J]. Surg Endosc, 2014, 28(7): 2020-2026. DOI:10.1007/s00464-014-3430-0 |
| [13] |
JIANG MJ, TAN YN, LI XF, et al. Clinicopathological features and prognostic factors of colorectal neuroendocrine neoplasms[J]. Gastroenterol Res Pract, 2017, 2017: 4206172. DOI:10.1155/2017/4206172 |
| [14] |
ISHII N, HORIKI N, ITOH T, et al. Endoscopic submucosal dissection and preoperative assessment with endoscopic ultrasonography for the treatment of rectal carcinoid tumors[J]. Surg Endosc, 2010, 24(6): 1413-1419. DOI:10.1007/s00464-009-0791-x |
| [15] |
ZHOU FR, HUANG LY, WU CR. Endoscopic mucosal resection for rectal carcinoids under micro-probe ultrasound guidance[J]. World J Gastroenterol, 2013, 19(16): 2555-2559. DOI:10.3748/wjg.v19.i16.2555 |
| [16] |
NAM SJ, CHAE GB, LEE S, et al. A small, well-differentiated rectal neuroendocrine tumor with multiple lymph node metastases:a case report[J]. Oncol Lett, 2018, 15(5): 7139-7143. DOI:10.3892/ol.2018.8257 |
| [17] |
MASUOKA Y, FURUKAWA D, YAZAWA N, et al. Rectal neuroendocrine tumor with synchronous pancreatic metastasis:a case report[J]. Tokai J Exp Clin Med, 2018, 43(2): 38-44. |
| [18] |
PARK SB, KIM DJ, KIM HW, et al. Is endoscopic ultrasonography essential for endoscopic resection of small rectal neuroendocrine tumors?[J]. World J Gastroenterol, 2017, 23(11): 2037-2043. DOI:10.3748/wjg.v23.i11.2037 |
 2020, Vol. 49
2020, Vol. 49




