文章信息
- 佟菲, 王传合, 韩苏, 李影, 李志超, 孙志军
- TONG Fei, WANG Chuanhe, HAN Su, LI Ying, LI Zhichao, SUN Zhijun
- D-二聚体与慢性心力衰竭院内死亡的相关性
- Association between D-dimer levels and in-hospital mortality in patients with chronic heart failure
- 中国医科大学学报, 2020, 49(8): 737-742
- Journal of China Medical University, 2020, 49(8): 737-742
-
文章历史
- 收稿日期:2020-03-17
- 网络出版时间:2020-07-28 17:29
心力衰竭(简称心衰)是心血管疾病中最常见的、有潜在致命风险的综合征,是多数心血管疾病晚期的临床状态。心衰时伴凝血功能异常并有栓塞风险[1],栓塞源自血液淤积、神经内分泌系统和炎症免疫系统改变以及内皮损伤[2]。D-二聚体(D-dimer)是纤维蛋白的降解产物,是凝血功能异常和有血栓栓塞风险的标志物[3]。心衰发生时可伴随D-dimer升高[4]。研究[5]发现,D-dimer升高与慢性心衰的长期预后不良有关,但关于D-dimer与慢性心衰院内死亡的相关性研究较少。本研究旨在通过对慢性心衰患者的D-dimer和相关临床资料进行大样本回顾性分析,探索D-dimer与慢性心衰院内死亡之间的相关性,以提高对慢性心衰时D-dimer的临床认识。
1 材料与方法 1.1 研究对象回顾性分析中国医科大学附属盛京医院心内科2013年1月至2018年12月因慢性心衰住院的患者3 753例。纳入标准:(1)心功能分级符合美国纽约心脏病协会(NYHA)Ⅰ~Ⅳ级的缺血性心肌病、扩张性心肌病、高血压性心肌病、心动过速性心肌病;(2)N末端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP) > 125 ng/L;(3)入院后完善D-dimer检查。排除标准:(1)急性心肌梗死;(2)严重肝肾功能不全,丙氨酸转氨酶或天冬氨酸转氨酶 > 参考值上限的3倍,估算肾小球滤过率 < 30 mL·min-1·1.73 m-2;(3)心脏瓣膜病及肺源性心脏病;(4)入院前1个月内口服抗凝药物;(5)恶性肿瘤;(6)主动脉夹层;(7)深静脉血栓;(8)肺栓塞;(9)近1个月内有外科手术或外伤史;(10)严重感染。最终纳入本研究患者2 840例,其中男性1 596例,平均年龄(64.33±14.04)岁;女性1 244例,平均年龄(70.51±12.34)岁。心衰病因:缺血性心肌病1 341例(47.2%),扩张性心肌病338例(11.9%),高血压性心肌病521例(18.3%),心动过速性心肌病640例(22.6%)。所有患者均签署知情同意书,本研究通过中国医科大学附属盛京医院科研项目伦理审批。
1.2 检测项目与方法 1.2.1 血液指标测定所有患者在入院后24 h内抽取外周静脉血。D-dimer应用ACL TOP700自动分析仪器和HemosIL RecombiPlasTin2G试剂盒(美国Instrumentation Laboratory公司),采用免疫比浊法测定。测定的血液指标包括淋巴细胞计数、单核细胞计数、血红蛋白、血小板计数、脑钠肽(brain natriuretic peptide,BNP)、白蛋白、血肌酐、血钾、血钠。
1.2.2 超声心动图检查患者行心脏超声检查,以Simpson法测量左心室射血分数(left ventricular ejection fraction,LVEF)。
1.3 统计学分析采用SPSS 24.0软件进行统计学分析。计量资料进行正态性检验,符合正态分布者用x±s表示,组间比较用独立样本t检验;不符合正态分布者用M(P25~P75)表示,组间比较用Mann-Whitney U检验;计数资料用率(%)表示,组间比较用χ2检验。采用Spearman相关分析和多元逐步回归分析D-dimer与其他因素的相关性。利用受试者操作特征(receiver operating characteristic,ROC)曲线的约登指数确定D-dimer预测院内死亡发生的最佳界值。采用多因素逐步二元logistic回归模型,针对各项可能影响院内死亡发生的因素行单因素和多因素分析,单因素分析有统计学意义的指标纳入多因素回归分析。使用MedCalc 15.0绘制各独立危险因素预测发生院内死亡的ROC曲线,根据各指标曲线下面积(area under curve,AUC),比较各独立危险因素对院内死亡发生的预测价值。P < 0.05为差异有统计学意义。
2 结果 2.1 患者基线临床资料的比较生存组和院内死亡组比较,男性比例、年龄、糖尿病发病率、血小板计数、LVEF的差异均无统计学意义(P > 0.05)。与生存组相比,院内死亡组高血压发病率、淋巴细胞计数、单核细胞计数以及血红蛋白、白蛋白、血钠水平显著降低,差异均有统计学意义(P < 0.05),NYHA Ⅲ/Ⅳ分级、BNP、血肌酐、血钾、D-dimer水平显著升高,差异均有统计学意义(P < 0.05)。见表 1。
| Item | Survivor group(n = 2 794) | In-hospital death group(n = 46) | P |
| Male [n(%)] | 1 570(56.2) | 26(56.5) | 0.960 |
| Age(year) | 67.04±13.55 | 66.48±19.77 | 0.848 |
| Hypertension [n(%)] | 1 663(59.5) | 20(43.5) | 0.028 |
| Diabetes [n(%)] | 840(30.1) | 14(30.4) | 0.957 |
| NYHA Ⅲ/Ⅳ [n(%)] | 1 991(71.3) | 42(91.3) | 0.010 |
| BNP(pg/mL) | 338.3(128.9-1 034.8) | 1 317.2(748.0-2 517.7) | < 0.001 |
| Lymphocyte(×109/L) | 1.4(1.1-1.9) | 1.1(0.5-1.4) | < 0.001 |
| Monocyte(×109/L) | 0.5(0.4-0.6) | 0.6(0.4-0.7) | 0.031 |
| Hemoglobin(g/L) | 133.13±20.81 | 116.65±30.54 | < 0.001 |
| Platelet(×109/L) | 184(150-225) | 177(121-288) | 0.969 |
| Albumin(g/L) | 37.83±4.43 | 33.70±5.54 | < 0.001 |
| Creatinine(μmol/L) | 78.0(65.1-95.8) | 97.5(69.7-140.5) | 0.002 |
| Serum potassium(mmol/L) | 4.05±0.46 | 4.23±0.61 | 0.049 |
| Serum sodium(mmol/L) | 138.81±3.67 | 136.65±6.45 | 0.028 |
| D-dimer(μg/L) | 212(120-420) | 788(342-1 418) | < 0.001 |
| LVEF(%) | 50.25±13.10 | 45.39±13.54 | 0.090 |
2.2 不同NYHA分级中BNP和D-dimer水平的变化
2 840例患者中,不同NYHA分级中BNP和D-dimer的水平以中位数(95% CI)表示。不同NYHA分级间BNP和D-dimer的比较采用Mann-Whitney U检验,结果显示,随着NYHA分级的增加,BNP和D-dimer水平逐级升高,各分级间的差异有统计学意义(P < 0.01)。见表 2。
| NHYA | n | BNP(pg/mL) | D-dimer(μg/L) |
| Ⅰ | 172 | 30.8(28.8-35.4) | 109(90.5-117.0) |
| Ⅱ | 635 | 145.5(133.9-160.0) | 134(126.0-150.0) |
| Ⅲ | 1 200 | 454.2(388.9-524.5) | 224(209.5-238.0) |
| Ⅳ | 833 | 896.6(826.8-997.5) | 362(339.0-390.0) |
2.3 D-dimer与其他因素的Spearman相关分析和多元逐步回归分析
在2 840例患者中,将D-dimer与各因素分别行Spearman相关分析,结果显示,D-dimer与年龄(r = 0.208,P < 0.001)、单核细胞计数(r = 0.142,P < 0.001)、BNP(r = 0.435,P < 0.001)、血肌酐(r = 0.184,P < 0.001)、血钾(r = 0.038,P = 0.043)呈正相关;D-dimer与LVEF(r = -0.234,P < 0.001)、淋巴细胞计数(r = -0.213,P < 0.001)、血红蛋白(r = -0.217,P < 0.001)、血小板计数(r = -0.049,P = 0.01)、白蛋白(r = -0.415,P < 0.001)、血钠(r = -0.157,P < 0.001)呈负相关。
将Spearman相关分析中具有相关性的指标为自变量,以D-dimer为因变量,进行多元逐步回归分析,结果显示,D-dimer与BNP呈正相关(P = 0.031),与白蛋白、血钠、淋巴细胞计数呈负相关(分别为P < 0.001,P < 0.001,P = 0.021)。见表 3。
| Variable | B | SE | β | t | 95% CI | P |
| BNP | 0.059 | 0.027 | 0.049 | 2.159 | 0.005 to 0.112 | 0.031 |
| Albumin | -35.861 | 6.422 | -0.128 | -5.584 | -48.455 to -23.266 | < 0.001 |
| Serum sodium | -32.715 | 7.476 | -0.098 | -4.376 | -47.375 to -18.054 | < 0.001 |
| Lymphocyte | -98.508 | 42.628 | -0.051 | -2.311 | -182.107 to -14.909 | 0.021 |
2.4 单因素和多因素logistic回归分析慢性心衰患者发生院内死亡的危险因素
利用ROC曲线的约登指数确定D-dimer预测院内死亡发生的最佳界值,D-dimer界值为614 μg/L,敏感度为67.4%,特异度为84.4%(AUCD-dimer = 0.815,95% CI:0.800~0.830)。按照D-dimer > 614 μg/L和D-dimer≤614 μg/L分组。logistic单因素回归分析结果显示,单核细胞计数、BNP、血肌酐、血钾、D-dimer是慢性心衰患者院内死亡的危险因素(P < 0.05),血红蛋白、白蛋白、血钠是院内死亡的保护因素(P < 0.05)。将单因素分析有意义因素纳入多因素逐步二元logistic回归模型,最终得出D-dimer、BNP、血肌酐升高和血红蛋白降低是慢性心衰发生院内死亡的独立危险因素(P < 0.05)。D-dimer > 614 μg/L组发生院内死亡的风险是D-dimer≤614 μg/L组的5.69倍。见表 4。
| Item | Univariate analysis | Multivariate analysis | ||
| OR(95% CI) | P | OR (95% CI) | P | |
| Male | 0.987(0.548-1.776) | 0.964 | ||
| Age | 0.997(0.976-1.018) | 0.781 | ||
| Hypertension | 0.523(0.291-0.942) | 0.031 | 0.134 | |
| Diabetes | 1.018(0.540-1.917) | 0.957 | ||
| Lymphocyte | 0.286(0.154-0.531) | < 0.001 | 0.182 | |
| Monocyte | 1.894(1.010-3.552) | 0.046 | 0.582 | |
| Hemoglobin | 0.970(0.958-0.981) | < 0.001 | 0.977(0.964-0.989) | < 0.001 |
| Platelet | 1.001(0.997-1.005) | 0.508 | ||
| BNP | 1.005(1.003-1.007) | < 0.001 | 1.003(1.000-1.005) | 0.045 |
| Albumin | 0.843(0.798-0.892) | < 0.001 | 0.113 | |
| Creatinine | 1.021(1.013-1.029) | < 0.001 | 1.013(1.003-1.023) | 0.011 |
| Serum potassium | 2.148(1.223-3.774) | 0.008 | 0.644 | |
| Serum sodium | 0.893(0.844-0.945) | < 0.001 | 0.120 | |
| D-dimer > 614 μg/L | 11.147(5.967-20.822) | < 0.001 | 5.691(2.750-11.778) | < 0.001 |
| Log D-dimer | 1.250(1.182-1.321) | < 0.001 | 1.188(1.107-1.276) | < 0.001 |
| LVEF | 0.973(0.943-1.005) | 0.094 | ||
2.5 ROC曲线比较D-dimer、BNP、血红蛋白、血肌酐对慢性心衰患者发生院内死亡的预测价值
各因素预测院内死亡的AUC分别为AUCD-dimer = 0.815(SE=0.027 4,95% CI:0.800~0.830),AUCBNP = 0.729(SE=0.038 2,95% CI:0.711~0.746),AUC血红蛋白=0.679(SE=0.052 1,95% CI:0.660~0.697),AUC血肌酐=0.621(SE=0.059 3,95% CI:0.601~0.640)。AUCD-dimer与AUCBNP比较,差异无统计学意义(SE=0.047 9,Z = 1.816,P = 0.0694,95% CI:-0.007~0.181),AUCD-dimer与AUC血红蛋白比较,差异有统计学意义(SE=0.056 2,Z = 2.437,P = 0.014 8,95% CI:-0.027~0.247),AUCD-dimer与AUC血肌酐比较,差异有统计学意义(SE=0.066 2,Z = 2.943,P = 0.003 2,95% CI:-0.066~0.325)。结果显示,在慢性心衰患者发生院内死亡的独立危险因素中,D-dimer的预测价值高于血红蛋白和血肌酐,但与BNP无差异。见图 1。
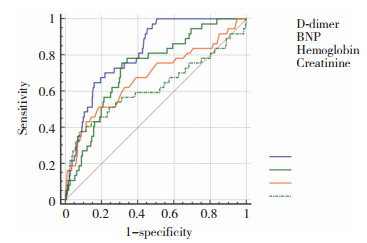
|
| 图 1 D-dimer、BNP、血红蛋白、血肌酐对慢性心衰发生院内死亡的预测价值的ROC曲线比较 Fig.1 ROC curve comparison of the predictive value of D-dimer, BNP, hemoglobin, and creatinine levels for the in-hospital mortality of patients with chronic heart failure |
3 讨论
心衰时D-dimer升高可归纳为4个方面的因素:(1)心脏收缩舒张功能障碍,心室张力升高,BNP升高,心腔内血液流速降低,增加心腔内血栓形成风险[6];(2)神经内分泌系统过度激活,交感神经系统和肾素-血管紧张素-醛固酮系统同时激活凝血和纤溶系统,两个系统作用相互抵消,净作用可致高凝状态[7];(3)心衰时可伴随免疫系统改变,中性粒细胞和单核细胞升高,淋巴细胞减少[8],导致外周血管的炎症反应,血管内皮损伤,降低对血小板聚集的抑制以及单核细胞与内皮细胞黏附作用的抑制,促进血管壁血栓形成[9];(4)心衰患者活动能力受限,外周血管血流减慢,血液淤滞,增加外周血栓形成风险。循环系统中微小血栓的形成和分解是由于血液淤滞和血管内皮功能障碍,已在犬心衰模型中得到证实[5]。本研究中,Spearman相关分析和多元逐步回归分析结果显示,慢性心衰患者的D-dimer与BNP呈正相关(P = 0.017),与淋巴细胞计数呈负相关(P = 0.021),符合上述关于心衰时D-dimer升高的机制分析。同时本研究发现,D-dimer与白蛋白、血钠呈负相关(P < 0.001),考虑白蛋白和血钠降低时,外周血管内血液渗透压下降,液体向组织细胞转移,外周血管内液体充盈不足导致的高凝状态,D-dimer相应升高。临床治疗中,低分子肝素可降低D-dimer,而本研究结果提示,纠正低白蛋白血症及低钠血症改善外周血管内血液充盈状态,亦可能降低D-dimer水平。
既往的研究[4]已证实,D-dimer与慢性心衰患者的长期预后有关。但D-dimer与慢性心衰患者院内死亡之间关系的研究较少,MINAMI等[10]发现,D-dimer与急性失代偿心衰的院内全因死亡有关,但有学者[11]对于MINAMI的研究提出质疑,认为该研究样本量较少,仅180例,结论可能存在较大偏倚。本研究纳入慢性心衰患者2 840例,logistic回归分析显示,D-dimer是慢性心衰患者发生院内死亡的独立危险因素,且D-dimer > 614 μg/L组院内死亡发生风险是D-dimer≤614 μg/L组的5.69倍。既往研究已证实,心衰患者中D-dimer升高与短期缺血性脑卒中有关[12]。抗凝治疗可降低D-dimer,降低栓塞事件发生率,但目前国际心衰治疗指南对未合并房颤的心衰患者,暂未推荐常规抗凝治疗(推荐级别Ⅲ,证据水平B)[13],临床试验中这类患者的抗凝治疗未见整体获益。这也提示,D-dimer虽与慢性心衰患者的院内死亡和远期预后有关,但仅通过抗凝治疗降低D-dimer未能改善心衰的最终治疗效果,从机制上导致D-dimer升高的各因素综合作用才是心衰患者死亡率增加的原因,因此心衰应强调综合治疗。
本研究发现的慢性心衰院内死亡的独立危险因素中,D-dimer的预测价值高于血红蛋白和血肌酐,但与BNP无差异。通过上述归纳的心衰时D-dimer升高的机制来看,D-dimer反映心衰时众多复杂的病理生理过程,既包括血液动力学因素,也包括神经内分泌和免疫炎症反应因素。因此,D-dimer是机体综合状态的一种反馈,这可能是D-dimer预测院内死亡优于其他因素的原因。既往研究证实BNP升高是心衰患者院内死亡的独立危险因素,而本研究发现D-dimer的预测价值与BNP无差异,并且D-dimer与BNP呈正相关。本研究发现,作为慢性心衰发生院内死亡的独立危险因素,可根据D-dimer、BNP、血红蛋白和血肌酐水平的高低,为慢性心衰患者的危险分层提供依据,以早期识别高危患者,给予及时有效的治疗。
本研究具有一定局限性,属于单中心回顾性研究,死亡样本量有限,期待以后能有更大样本量的多中心前瞻性研究,进一步验证D-dimer与慢性心衰患者院内死亡的关系。本研究未纳入合并严重肝肾功能不全的慢性心衰患者,本研究所用的数据库缺乏患者入院后的用药记录,因此不能反映慢性心衰整体人群的情况以及药物对于慢性心衰患者预后的影响。
| [1] |
NG TM, TSAI F, KHATRI N, et al. Venous thromboembolism in hospitalized patients with heart failure:incidence, prognosis, and prevention[J]. Circ Heart Fail, 2010, 3(1): 165-173. DOI:10.1161/circheartfailure.109.892349 |
| [2] |
ZANNAD F, STOUGH WG, REGNAULT V, et al. Is thrombosis a contributor to heart failure pathophysiology? Possible mechanisms, therapeutic opportunities, and clinical investigation challenges[J]. Int J Cardiol, 2013, 167(5): 1772-1782. DOI:10.1016/j.ijcard.2012.12.018 |
| [3] |
WEITZ JI, FREDENBURGH JC, EIKELBOOM JW. A test in context:D-dimer[J]. J Am Coll Cardiol, 2017, 70(19): 2411-2420. DOI:10.1016/j.jacc.2017.09.024 |
| [4] |
TARNOW I, FALK T, TIDHOLM A, et al. Hemostatic biomarkers in dogs with chronic congestive heart failure[J]. J Vet Intern Med, 2007, 21(3): 451-457. DOI:10.1892/0891-6640(2007)21[451:hbidwc]2.0.co;2 |
| [5] |
YAN W, LIU JX, LIU HY, et al. Elevated D-dimer levels predict adverse outcomes in hospitalised elderly patients with chronic heart failure[J]. Intern Med J, 2019, 49(10): 1299-1306. DOI:10.1111/imj.14322 |
| [6] |
AISPURU GR, CLAVIER MM, CARDONE AJ, et al. Thrombotic biomarkers and left ventricle characteristics as short-term predictors of thrombotic events in patients hospitalized for acute decompensated heart failure[J]. Eur J Intern Med, 2012, 23(6): 545-551. DOI:10.1016/j.ejim.2012.04.002 |
| [7] |
WANNAMETHEE SG, WHINCUP PH, PAPACOSTA O, et al. Associations between blood coagulation markers, NT-proBNP and risk of incident heart failure in older men:The British Regional Heart Study[J]. Int J Cardiol, 2017, 230: 567-571. DOI:10.1016/j.ijcard.2016.12.056 |
| [8] |
WANG XQ, FAN XD, JI SF, et al. Prognostic value of neutrophil to lymphocyte ratio in heart failure patients[J]. Clin Chim Acta, 2018, 485: 44-49. DOI:10.1016/j.cca.2018.06.021 |
| [9] |
CHUNG I, CHOUDHURY A, LIP GY. Platelet activation in acute, decompensated congestive heart failure[J]. Thromb Res, 2007, 120(5): 709-713. DOI:10.1016/j.thromres.2007.01.003 |
| [10] |
MINAMI Y, HARUKI S, JUJO K, et al. Elevated D-dimer levels predict an adverse outcome in hospitalized patients with acute decompensated heart failure[J]. Int J Cardiol, 2016, 204: 42-44. DOI:10.1016/j.ijcard.2015.11.156 |
| [11] |
FENG YX, YANG LJ, LI T, et al. Association between elevated D-dimer levels and adverse outcome in patients with acute heart failure[J]. Int J Cardiol, 2016, 214: 415-416. DOI:10.1016/j.ijcard.2016.03.218 |
| [12] |
HAMATANI Y, NAGAI T, NAKAI M, et al. Elevated plasma D-dimer level is associated with short-term risk of ischemic stroke in patients with acute heart failure[J]. Stroke, 2018, 49(7): 1737-1740. DOI:10.1161/STROKEAHA.118.021899 |
| [13] |
YANCY CW, JESSUP M, BOZKURT B, et al. 2013 ACCF/Aha guideline for the management of heart failure:executive summary:a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines[J]. Circulation, 2013, 128(16): 1810-1852. DOI:10.1161/CIR.0b013e31829e8807 |
 2020, Vol. 49
2020, Vol. 49




