文章信息
- 张迪, 刘倩倩, 彭瑾瑾, 刘志, 刘晓伟, 刘伟
- ZHANG Di, LIU Qianqian, PENG Jinjin, LIU Zhi, LIU Xiaowei, LIU Wei
- 肌腱蛋白C在百草枯中毒肺损伤中的作用
- Tenascin-C participates in the process of paraquat-induced lung injury
- 中国医科大学学报, 2020, 49(8): 711-715
- Journal of China Medical University, 2020, 49(8): 711-715
-
文章历史
- 收稿日期:2019-12-18
- 网络出版时间:2020-07-29 8:41
百草枯(paraquat,PQ)是一种高毒性的有机杂环类除草剂,由于其低成本和高效的除草性能,在发展中国家广泛应用[1]。PQ中毒的死亡率高达60%~80%。肺脏是PQ中毒后损伤的主要靶器官,早期为明显肺水肿、肺出血等急性肺损伤表现,后期发展为不可逆的肺间质纤维化而导致死亡[2]。目前PQ中毒肺损伤机制并不完全清楚。在肺损伤的病理过程中,细胞外基质发挥维持肺泡结构及组织损伤修复等重要的生物学作用[3]。肌腱蛋白C(tenascin-C,TNC)作为一种细胞外基质成分,当氧化损伤、组织修复以及炎症介质刺激时,其表达明显升高[4-5]。此外,在前期研究[6]中发现,PQ中毒患者血清TNC表达明显升高,而且是中毒预后的独立危险因素。目前,关于TNC在PQ引起的肺损伤中的表达规律及机制分析国内外尚无报道。本研究中将利用PQ中毒小鼠模型,探讨TNC在PQ中毒肺损伤小鼠模型中的表达规律,这将有助于对PQ中毒肺损伤机制的进一步理解,并为诊治提供新的思路。
1 材料与方法 1.1 材料C57BL/6雄性小鼠购自中国医科大学实验动物部。RIPA裂解液,SDS-PAGE凝胶配制试剂盒,BCA蛋白定量试剂盒,蛋白标准品(碧云天生物技术研究所),SDS-PAGE上样缓冲液(康为世纪),蛋白Marker(美国Thermo Fisher Scientific公司),ECL发光液底物(美国Bio-rad公司),PQ(美国Sigma公司),TNC、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、转化生长因子-β1(transforming growth factor-β1,TGF-β1)、核因子-κB p65(nuclear factor-κB p65,NF-κB p65)抗体(英国Abcam公司),GAPDH抗体、辣根过氧化物酶羊抗鼠IgG抗体、辣根过氧化物酶羊抗兔IgG抗体(美国Proteintech公司),TRIzol试剂(美国Life Technologies公司),PrimeScript RT Master Mix,TB Premix Ex TaqⅡ(日本Takara公司),免疫组化试剂盒(北京中杉金桥生物技术有限公司)。
1.2 方法 1.2.1 PQ小鼠模型建立C57BL/6雄鼠(70只),6~8周,体质量18~22 g,标准饮食,生活环境清洁且12 h明/暗交替,室温(23± 0.5)℃,湿度50%±5%。实验组小鼠经腹腔注射30 mg/kg的溶解于无菌生理盐水的PQ,对照组同样方式给予相同体积无菌生理盐水。在造模后2 d、7 d、14 d和28 d,每个时间点5只小鼠经戊巴比妥麻醉(60 mg/kg)后,腹主动脉放血处死,取整个肺组织用于后续检测。左肺经10%中性甲醛固定后包埋于石蜡中用于HE,Masson三色染色和免疫组织化学(immunohistochemistry,IHC)检测;右肺分为2部分,分别用于mRNA和蛋白提取。所有动物实验均获得中国医科大学伦理机构委员会批准。
1.2.2 蛋白检测右上肺加入RIPA裂解液缓冲液,经超声破碎后,裂解液用BCA蛋白定量试剂盒检测总蛋白浓度。等体积等蛋白量的样品(20 μL,100 μg)经SDS-PAGE凝胶电泳分离并转膜到聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),一抗TNC(1:1 000),α-SMA(1:1 000),TGF-β1(1:1 000),NF-κB p65(1:1 000),GAPDH(1:5 000),4 ℃过夜孵育后,带辣根过氧化物酶的二抗室温孵育2 h,在化学发光试剂作用下发光显影检测蛋白条带,并用Image J图像分析软件进行灰度分析。
1.2.3 基因检测右下肺经TRizol试剂裂解后,用异丙醇沉淀法提取总RNA。定量后,cDNA反转录试剂盒将mRNA反转录,SYBR PCR定量试剂盒检测TNC基因表达量。管家基因为GAPDH,对照组TNC表达量为标准。引物序列见表 1。
| Primer | Sequence |
| Mouse-TNC-F | 5’-TTTGCCCTCACTCCCGAAG-3’ |
| Mouse-TNC-R | 5’-AGGGTCATGTTTAGCCCACTC-3’ |
| Mouse-GAPDH-F | 5’-GGTTGTCTCCTGCGACTTCA-3’ |
| Mouse-GAPDH-R | 5’-TGGTCCAGGGTTTCTTACTCC-3’ |
1.2.4 病理学检测
左肺的石蜡包埋切成5 μm厚的切片,进行HE和Masson三色染色。烤片、脱蜡水化、清洗、苏木素伊红染色、脱水透明及封片,进行HE染色。Masson染色,烤片、脱蜡水化同HE染色,酸性高锰酸钾5 min,1%草酸漂白2 min,自来水冲洗15 min,蒸馏水冲洗,Masson染色液中浸泡5 min,0.2%冰醋酸快速冲洗,1%磷钨酸浸泡分化5 min,0.2%冰醋酸快速冲洗,2%苯胺兰冰醋酸浸泡5 min,0.2%冰醋酸快速冲洗至褪色,迅速在95%的乙醇分化,迅速无水乙醇脱水,60 ℃恒温箱过夜,中性树胶封片,显微镜观察,拍照。IHC中,切片脱蜡,水化,柠檬酸修复液中煮沸5 min进行抗原修复,TNC一抗稀释浓度为1:50,其余步骤根据免疫组化试剂盒说明书操作进行TNC抗原的组织化学染色。
1.3 统计学分析采用SPSS 22.0进行统计分析,组间数据比较用两样本t检验,P < 0.05为差异有统计学意义。所有实验结果至少重复3次。
2 结果 2.1 PQ中毒模型成功建立腹腔注射PQ是小鼠造模的经典方法[7]。肺组织的HE结果(图 1)可见对照组肺泡结构正常,肺泡间隔不厚,肺泡壁完整,呈现渔网状。PQ作用2 d后,肺泡间隔增厚,结构尚完整,少量炎症细胞浸润,肺泡腔出血。7 d肺泡结构严重损害,肺泡上皮细胞受损,大量炎症细胞渗出。14 d肺泡间隔明显增厚,渗出吸收,浸润细胞明显增多,在损伤的肺泡间隔可见一些基质纤维胶原成分。28 d肺泡结构整体完整,浸润细胞不多,但部分肺泡依然可见略厚的肺泡间隔。Masson染色可见,对照组肺泡区几乎无染色。PQ注射后,7 d蓝染增多,主要集中在血管周围损伤严重的肺泡区。14 d在增厚的肺间质区明显蓝染,其余时间点不明显,见图 1。HE和胶原染色结果提示PQ中毒肺损伤小鼠模型的成功建立,早期(7 d)呈现急性炎症损伤表现,后期为纤维化改变为主。
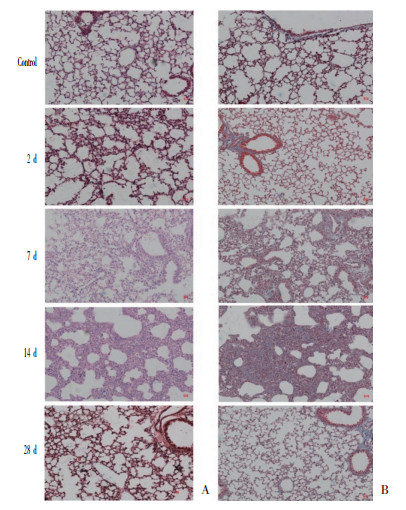
|
| A, HE staining of mouse lung tissue; B, Masson staining of mouse lung tissue. 图 1 PQ中毒小鼠模型肺组织病理染色及胶原染色 ×100 Fig.1 Pathological staining and collagen deposition in lung tissues of PQ mice model ×100 |
2.2 PQ中毒模型中相关炎症和纤维化介质表达情况
Western blotting检测结果(图 2)显示,NF-κB p65表达水平与对照组相比在2 d(1.466±0.147 7 vs 0.835±0.094 4,P < 0.05)和7 d(1.284±0.034 0 vs 0.835±0.094 4,P < 0.01)明显升高,有统计学意义,并且在2 d达高峰。在2 d之后的表达开始下降,在14 d(0.853±0.064 3 vs 0.835±0.094 4,P > 0.05)和28 d(0.792±0.063 0 vs 0.835±0.094 4,P > 0.05)后与对照组持平,回归正常水平。α-SMA在造模后的28 d内表达呈现逐渐升高的趋势,在早期无明显升高,分别为2 d(1.315±0.453 vs 0.900±0.208 2,P > 0.05),7 d(1.467±0.524 6 vs 0.900±0.208 2,P > 0.05),均无统计学意义。14 d(2.804±0.467 7 vs 0.900±0.208 2,P < 0.05)和28 d(3.296±0.735 0 vs 0.900±0.208 2,P < 0.05)呈现有统计学意义的高表达。TGF-β1与对照组相比,从2 d(2.694±0.194 5 vs 1.000±0.152 8,P < 0.01),7 d(1.849±0.088 8 vs 1.000±0.152 8,P < 0.01),14 d(1.944±0.098 4 vs 1.000±0.152 8,P < 0.01),并一直持续到28 d(2.467±0.260 3 vs 1.000±0.152 8,P < 0.01),均为有统计学意义的高表达。

|
| 1, control; 2, 2 d; 3, 7 d; 4, 14 d; 5, 28 d. 图 2 PQ中毒小鼠模型肺组织中相关炎症纤维化指标的蛋白检测结果 Fig.2 Relative protein expression levels of cytokines in mouse lung tissue post PQ administration |
2.3 TNC在PQ中毒肺组织中高表达
对照组中TNC仅微量表达。但是PQ中毒小鼠肺组织中TNC在基因和蛋白水平均明显高表达,见图 3。基因的表达高峰早于蛋白表达,在2 d达高峰。TNC基因表达量与对照组相比各组结果如下:2 d(5.038±0.421 8 vs 1.212±0.427 7,P < 0.01),7 d(3.508±0.640 5 vs 1.212±0.427 7,P < 0.05),14 d(2.177±0.915 8 vs 1.212±0.427 7,P > 0.05),28 d(1.351±0.201 2 vs 1.212±0.427 7,P > 0.05),2 d和7 d时差异有统计学意义,其余无统计学意义。TNC蛋白从2 d(2.575±0.435 1 vs 1.000±0.471 5,P < 0.05)开始升高,7 d(5.525±0.256 0 vs 1.000±0.471 5,P < 0.01)达高峰,之后表达降低。在14 d(2.511±0.568 9 vs 1.000±0.471 5,P > 0.05)和28 d(1.790±0.178 9 vs 1.000±0.471 5,P > 0.05)与对照组比较,蛋白表达量无统计学差异。IHC结果可见,对照组几乎无黄染,PQ作用后的各个时间点均可见一定程度的黄染,7 d黄染最为明显,并且主要分布于损伤的肺间质区。
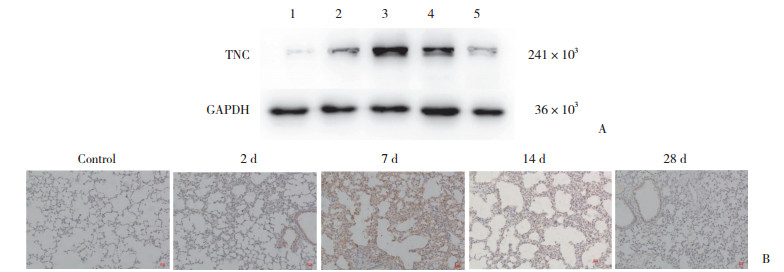
|
| A, TNC protein expression levels in mouse lung tissue post PQ administration; B, IHC staining of TNC in mouse lung tissue post PQ administration×100. 1, control; 2, 2 d; 3, 7 d; 4, 14 d; 5, 28 d. 图 3 PQ中毒小鼠模型中TNC的表达及分布 Fig.3 TNC expression in lung tissues of mouse model |
3 讨论
本研究通过病理染色和胶原染色,证实了小鼠PQ中毒肺损伤模型建立成功。NF-κB p65作为炎症过程启动和激活的关键因子[8],在PQ中毒后2 d,肺组织中出现表达高峰,7 d后逐渐下降,这与PQ通过细胞氧化应激损伤导致上皮细胞坏死和早期炎症的病理改变相一致。提示急性炎症反应是PQ中毒肺损伤的始动因素,早期合理干预(48 h之内)可能是减少肺脏进一步损伤和改善预后的关键。
在14 d和28 d,α-SMA作为代表着成纤维细胞向肌成纤维细胞分化的标志物,表达开始升高,反应了PQ中毒后期的损伤开始从炎症向纤维化、基质沉积、组织修复转化[9]。TGF-β1在早期炎症阶段诱导细胞外基质表达,刺激成纤维细胞增殖并分化为肌成纤维细胞[10],从而分泌大量胶原蛋白,造成肺泡间质增厚,过量的表达可能会使组织修复失衡,出现肺纤维化的病理改变。本研究结果也证实TGF-β1在PQ中毒诱导肺损伤过程中于早期(2 d)表达开始升高,并且持续高表达至染毒后28 d,提示TGF-β1参与了炎症和纤维化整个病理过程。
TNC作为一种细胞外大分子基质蛋白,主要分布在组织的细胞外基质区,与基质蛋白、膜信号传导蛋白和小分子的细胞因子相互结合,并启动一些信号通路和调节细胞增殖、迁移、黏附和分化[4]。尽管已经有研究[11-12]表明,TNC参与多个疾病纤维化过程,但在PQ中毒肺损伤及纤维化过程中还未被关注。本研究结果表明,PQ中毒后7 d TNC达到表达峰值,并且主要分布在损伤严重区域的肺泡上皮下。同时比较TNC与其他3个重要炎症纤维化相关因子的时间表达趋势,发现TNC与NF-κB p65和TGF-β1表达趋势具有一定相似性。另外有研究[13]证实NF-κB和TGF-β1是参与TNC基因表达调控的启动因子,因而TNC升高是对早期炎症损伤后的反应性升高。此外,在TNC敲除小鼠的博来霉素模型中,TGF-β1的表达是降低的[14]。结合既往研究和本研究结果,推测在PQ中毒肺损伤过程中,TNC与TGF-β1之间存在着相互促进作用,TNC贯穿PQ诱导的肺损伤的炎症和纤维化2个阶段,存在着被激活以及调控其他相关因子表达的双重作用。但是本研究发现TNC与TGF-β1的表达峰值时间并不完全一致,在14 d后TNC表达明显下降,并趋于正常,但是TGF-β1的表达仍持续高表达,这表明两者之间还存在其他因子的作用,并非为单一相互促进作用。TNC高表达主要发生在肺脏从炎症损伤向纤维化转变的关键时间点(7 d),高度提示TNC可能对PQ中毒肺损伤中早期炎症损伤能否转变为后期高致死率的肺纤维化发挥着调控作用。但是TNC在这一过程中的具体作用机制还需要进一步的深入研究。
综上,本研究首次证明TNC在PQ中毒肺损伤小鼠模型中高表达,参与了PQ中毒肺损伤的过程,并展示了TNC在PQ中毒肺损伤过程中的表达规律,推测TNC在此过程中的作用和TGF-β1密切相关。TNC在PQ中毒肺损伤中的作用或许可以成为临床治疗的关键靶点。
| [1] |
ZYOUD SH. Investigating global trends in paraquat intoxication research from 1962 to 2015 using bibliometric analysis[J]. Am J Ind Med, 2018, 61(6): 462-470. DOI:10.1002/ajim.22835 |
| [2] |
SUN B, CHEN YG. Advances in the mechanism of paraquat-induced pulmonary injury[J]. Eur Rev Med Pharmacol Sci, 2016, 20(8): 1597-1602. |
| [3] |
BLAAUBOER ME, BOEIJEN FR, EMSON CL, et al. Extracellular matrix proteins:a positive feedback loop in lung fibrosis?[J]. Matrix Biol, 2014, 34: 170-178. DOI:10.1016/j.matbio.2013.11.002 |
| [4] |
MIDWOOD KS, CHIQUET M, TUCKER RP, et al. Tenascin-C at a glance[J]. J Cell Sci, 2016, 129(23): 4321-4327. DOI:10.1242/jcs.190546 |
| [5] |
MIDWOOD KS, OREND G. The role of tenascin-C in tissue injury and tumorigenesis[J]. J Cell Commun Signal, 2009, 3(3/4): 287-310. DOI:10.1007/s12079-009-0075-1 |
| [6] |
刘倩倩, 刘晓伟, 张迪, 等. 血清肌腱蛋白C评估急性百草枯中毒患者肺损伤[J]. 中华急诊医学杂志, 2019, 28(3): 292-297. DOI:10.3760/cma.j.issn.1671-0282.2019.03.004 |
| [7] |
BLANCO-AYALA T, ANDÉRICA-ROMERO AC, PEDRAZA-CHAVERRI J. New insights into antioxidant strategies against paraquat toxicity[J]. Free Radic Res, 2014, 48(6): 623-640. DOI:10.3109/10715762.2014.899694 |
| [8] |
LI QT, VERMA IM. NF-κB regulation in the immune system[J]. Nat Rev Immunol, 2002, 2(10): 725-734. DOI:10.1038/nri968 |
| [9] |
DU J, ZHU Y, MENG XX, et al. Atorvastatin attenuates paraquat poisoning-induced epithelial-mesenchymal transition via downregulating hypoxia-inducible factor-1 alpha[J]. Life Sci, 2018, 213: 126-133. DOI:10.1016/j.lfs.2018.10.026 |
| [10] |
KIM KK, SHEPPARD D, CHAPMAN HA. TGF-β1 signaling and tissue fibrosis[J]. Cold Spring Harb Perspect Biol, 2018, 10(4): 22293. DOI:10.1101/cshperspect.a022293 |
| [11] |
HASEGAWA M, YOSHIDA T, SUDO A. Role of tenascin-C in articular cartilage[J]. Mod Rheumatol, 2018, 28(2): 215-220. DOI:10.1080/14397595.2017.1349560 |
| [12] |
FU HY, TIAN Y, ZHOU LL, et al. Tenascin-C is a major component of the fibrogenic niche in kidney fibrosis[J]. J Am Soc Nephrol, 2017, 28(3): 785-801. DOI:10.1681/asn.2016020165 |
| [13] |
GIBLIN SP, MIDWOOD KS. Tenascin-C:form versus function[J]. Cell Adhesion Migr, 2015, 9(1/2): 48-82. DOI:10.4161/19336918.2014.987587 |
| [14] |
CAREY WA, TAYLOR GD, DEAN WB, et al. Tenascin-C deficiency attenuates TGF-β-mediated fibrosis following murine lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2010, 299(6): L785-L793. DOI:10.1152/ajplung.00385.2009 |
 2020, Vol. 49
2020, Vol. 49




