文章信息
- 张海涛, 韦薇, 齐弘炜, 袁彪, 汤楚中
- ZHANG Haitao, WEI Wei, QI Hongwei, YUAN Biao, TANG Chuzhong
- microRNA-486对低氧导致的原代大鼠心肌细胞损伤和凋亡的改善作用
- microRNA-486 improves hypoxia-induced injury and apoptosis of primary cardiomyocytes in rats
- 中国医科大学学报, 2020, 49(6): 500-504
- Journal of China Medical University, 2020, 49(6): 500-504
-
文章历史
- 收稿日期:2019-09-10
- 网络出版时间:2020-05-18 15:00
2. 承德医学院附属医院血液检验室, 河北 承德 067000;
3. 首都医科大学附属北京同仁医院心脏外科, 北京 100730;
4. 中国人民解放军总医院第六医学中心心脏外科, 北京 100048
2. Department of Hematology Laboratory, Affiliated Hospital of Chengde Medical College, Chengde 067000, China;
3. Cardiovascular Center, Beijing Tongren Hospital, Capital Medical University, Beijing 100730, China;
4. Department of Cardiac Surgery, The Sixth Medical Center of PLA General Hospital, Beijing 100048, China
缺血性心脏病是最严重的心血管疾病之一,其病理生理机制以及心肌细胞缺血适应机制尚未完全阐明。有证据表明,微小RNA(microRNA,miRNA)可能在缺血性心脏病中发挥关键作用[1-2]。miRNA是一类在转录后基因调控中发挥功能的非编码小RNA,miRNA在缺血性心脏病发病机制和进展的过程中起关键的调节作用[3-4]。miR-486是心脏高丰度表达的重要miRNA之一,有研究[5]表明,miR-486在携带MRTF-A重组腺病毒转染的新生大鼠心肌细胞表达的多种miRNA中最为突出。而MRTF-A在心肌缺血期间,是调控心肌细胞纤维化的重要转录因子。因此,miR-486的表达调控与心肌缺血和预后有明显相关性,但是miR-486在心肌细胞中的作用目前尚不清楚。因此,本研究拟利用腺病毒介导的基因高表达和沉默技术,初步研究miR-486在心肌细胞缺氧损伤中的作用。
1 材料与方法 1.1 实验动物1~2日龄的清洁级SD大鼠乳鼠15只,购于北京科宇动物养殖中心。
1.2 主要试剂和仪器miRNA提取试剂盒、miRNA反转录试剂盒、miRNA-486荧光探针、实时荧光定量PCR仪(美国应用生物系统公司),腺病毒ad-miR-486、腺病毒ad-miR-486-antago(上海汉恒生物公司),乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒(南京建成生物工程研究所有限公司),CCK-8试剂盒(中国东仁化学科技有限公司),AnnexinⅤ/PI试剂盒(武汉博士德生物工程有限公司),细胞培养箱、紫外分光光度计(美国赛默飞世尔科技有限公司),低氧培养箱(英国Ruskinn公司),酶标仪(美国分子仪器公司),流式细胞仪(美国BD公司)。
1.3 乳鼠心肌细胞的分离培养取出生1~2 d的SD大鼠乳鼠15只,消毒后在无菌条件下取出乳鼠心脏,除去心包等多余组织,将心室剪成约1 mm3均匀大小的组织块,并用0.125%胰蛋白酶在37 ℃水浴锅中重复消化4次(每次约10 min)。吸取后3次消化的细胞悬液于离心管内,添加含有10%胎牛血清的DMEM培养基终止消化。离心后去上清液,将细胞悬液重新悬浮到含10%胎牛血清的DMEM培养基,均匀接种于75 mL的培养瓶中,于37 ℃培养箱(含5% CO2和95% O2)中培养,差速贴壁法去除成纤维细胞,调整细胞浓度后接种于培养板上,于37 ℃细胞培养箱(含5% CO2和95%空气)中继续培养,孵育36 h后进行实验。
1.4 实时荧光定量PCR检测细胞miR-486水平制备单细胞悬液接种于6孔板,1×105/孔。当细胞生长达到80%融合时,将细胞分成6组,分别为常氧培养对照组、低氧培养6 h组、低氧培养12 h组、低氧培养24 h组、低氧培养36 h组、低氧培养48 h组,取各组细胞,吸弃培养基后,按照ABI miRNA分离试剂盒说明书操作,提取miRNA,紫外分光光度计测定miRNA浓度和纯度,采用U6作为内参,用特异性miR-486反转录引物和U6内参反转录引物进行反转录获取cDNA。用ABI公司的miR-486探针对原代心肌细胞中miR-486的表达进行测定。使用实时荧光定量PCR仪(ABI 7900,美国应用生物系统公司)进行实验,获得Ct值后,应用2-ΔΔCt法计算目的基因的相对表达水平。
1.5 细胞活力、损伤和凋亡程度的测定将1.4中达到80%融合度的心肌细胞按照转染Ad-miR-486和Ad-miR-486-antago,分成6组,分别为常氧培养组(C+N组)、转染ad-miR-486+常氧培养组(M+N组)、转染ad-miR-486-antago+常氧培养组(I+N组)、低氧培养组(C+H组)、转染ad-miR-486+低氧培养组(M+H组)、转染ad-miR-486-antago+低氧培养组(I+H组),用无血清不含抗生素的DMEM培养液分别稀释待转染的ad-miR-486和ad-miR-486-antago。将脂质体Lipofectamine 2000与待转染试剂混匀,室温静置20 min后,加入相对应的各组细胞中。C+N组、M+N组、I+N组置于常氧培养箱(37 ℃,含5% CO2和95%空气)中孵育;C+H组、M+H组、I+H组置于低氧培养箱(37 ℃,含1% O2、94% N2和5% CO2)中孵育。48 h后,收集各组细胞进行下列指标的检测。
1.5.1 CCK-8法测定心肌细胞活性随机选取各组心肌细胞,每孔培养基按照10:1的比例避光加入CCK-8试剂,37 ℃下在培养箱内避光培养3 h,应用酶标仪于450 nm波长处测定光密度(optical density,OD)值,间接反映心肌细胞活力。计算细胞活力,细胞活力(%)=(OD实验孔-OD调零孔)/(OD常氧培养孔-OD调零孔)×100。
1.5.2 培养液LDH活性的测定吸取各组细胞上清液,按照LDH活性检测试剂盒说明,用酶标仪测定各组还原型辅酶Ⅰ在反应过程中340 nm处OD值,计算细胞培养液LDH活性。
1.5.3 流式细胞术检测心肌细胞凋亡吸净各组细胞培养液,加入不含EDTA的0.25%胰酶消化至细胞形态为圆形时,轻轻吹打使细胞脱落,加入DMEM培养液终止消化后收集细胞,1 000 r/min离心5 min,PBS漂洗2次后,用300 μL的1×Binding buffer重悬,调整细胞浓度约1×105/mL,加入5 μL AnnexinⅤ-FITC和5 μL碘化丙啶,混匀后避光孵育10 min,用流式细胞仪测定细胞凋亡率。
1.6 统计学分析采用SPSS 22.0软件进行统计分析,计量资料用x±s表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2 结果 2.1 低氧培养心肌细胞miR-486表达水平的变化从SD大鼠乳鼠中分离心肌细胞并培养扩增,依次于低氧培养箱(37 ℃,1% O2、94% N2、5% CO2)中培养6、12、24、36、48 h后收取,抽提细胞RNA,利用实时荧光定量PCR测定miR-486表达变化。常氧培养对照组、低氧培养6 h组、低氧培养12 h组、低氧培养24 h组、低氧培养36 h组、低氧培养48 h组中,miR-486的表达水平分别为1.03±0.27、1.16±0.22、1.65±0.31、2.52±0.72、1.66±0.24、1.45±0.04。随着低氧培养时间的延长,miR-486的表达逐渐上升,至24 h达到峰值后逐渐下降,低氧培养12、24、36 h组miR-486表达量明显高于常氧培养对照组,差异有统计学意义(P < 0.05)。
2.2 心肌细胞培养液LDH活性的比较6组比较,心肌细胞培养液LDH活性的差异有统计学意义(F = 72.759,P < 0.01)。心肌细胞在常氧环境中培养,转染ad-miR-486和ad-miR-486-antago可略增加LDH释放量,但M+N组、I+N组与C+N组比较无统计学差异(P > 0.05)。低氧环境中培养的心肌细胞(C+H组、M+H组、I+H组)较常氧环境中心肌细胞(C+N组、M+N组、I+N组)LDH释放量明显增加(P < 0.05)。在低氧环境中转染了ad-miR-486的M+H组较C+H组、I+H组LDH释放量明显下降(P < 0.05),且转染了ad-miR-486-antago的I+H组LDH释放量高于C+H组,差异有统计学意义(P < 0.05),见表 1。
| Group | LDH activity(U/L) | Cell viability(%) | Rate of apoptosis(%) |
| C+N | 4.13±2.72 | 20.78±1.93 | 4.11±1.07 |
| M+N | 8.47±4.43 | 20.78±1.71 | 3.25±1.44 |
| I+N | 7.53±2.49 | 20.60±2.31 | 3.06±1.25 |
| C+H | 89.55±14.841),2),3) | 12.81±2.301),2),3) | 11.90±1.061),2),3) |
| M+H | 32.37±13.561),2),3),4) | 17.87±2.284) | 9.13±1.101),2),3),4) |
| I+H | 128.77±15.221),2),3),4),5) | 7.75±1.111),2),3),4),5) | 21.33±2.051),2),3),4),5) |
| 1)P < 0.05 vs C+N group;2)P < 0.05 vs M+N group;3)P < 0.05 vs I+N group;4)P < 0.05 vs C+H group;5)P < 0.05 vs M+H group. | |||
2.3 心肌细胞活力的比较
6组比较,心肌细胞活力的差异有统计学意义(F = 29.384,P < 0.01)。低氧环境中C+H组和I+H组较其他4组心肌细胞活力明显降低(P < 0.05),且转染了ad-miR-486的M+H组较C+H组、I+H组心肌细胞活力明显升高(P < 0.05),转染了ad-miR-486-antago的I+H组较C+H组心肌细胞活力明显下降(P < 0.05)。见表 1。
2.4 各组心肌细胞凋亡率的比较6组比较,心肌细胞凋亡率的差异有统计学意义(F = 80.302,P < 0.01)。常氧环境中转染ad-miR-486和ad-miR-486-antago可略增加心肌细胞的凋亡率,但M+N组、I+N组与C+N组相比,差异无统计学意义(P > 0.05)。低氧环境中培养的心肌细胞(C+H组、M+H组、I+H组)较在常氧环境中心肌细胞(C+N组、M+N组、I+N组)凋亡率明显升高(P < 0.05)。在低氧环境中转染了ad-miR-486-antago的I+H组心肌细胞凋亡率明显高于C+H组和M+H组(P < 0.05),且转染了ad-miR-486的M+H组细胞凋亡率明显小于C+H组(P < 0.05)。见表 1、图 1。
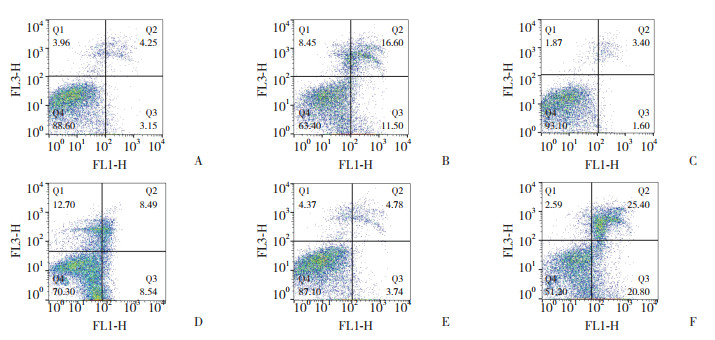
|
| A, C+N group; B, C+H group; C, M+N group; D, M+H group; E, I+N group; F, I+H group. 图 1 流式细胞仪测定心肌细胞凋亡率 Fig.1 Determination of the rate of apoptosis of the cardiomyocytes using flow cytometry |
3 讨论
缺血性心脏病的主要病理过程是由于血管病变导致心脏血供障碍,进一步导致心肌细胞缺血、损伤和凋亡,最终导致心脏功能受损。而miRNA在这个过程中起重要作用,miRNA失调与缺血性心脏病的发生和发病机制有关[6-8]。研究[9]表明,通过提高大鼠心肌中miR-486的表达水平,可以改善大鼠心肌梗死后心脏功能。本研究通过对大鼠原代心肌细胞低氧培养,模拟了心肌急性缺氧损伤的过程,利用腺病毒介导的基因高表达和沉默技术,提高和降低了心肌细胞中miR-486的表达水平,并通过一系列实验证实低氧条件下miR-486能够降低LDH活性、增强心肌细胞活力、降低细胞凋亡率,从而改善低氧导致的心肌细胞损伤和凋亡。
本研究证实miR-486是心肌细胞中缺氧诱导的miRNA,通过实时荧光定量PCR证实在低氧状态下心肌细胞内miR-486表达显著提高,但其对心肌细胞低氧损伤过程的保护机制尚不明确。利用TargetScan网络生物信息学数据库分析,预测miR-486的靶基因可能含有PTEN、FoxO1、Sirt1。其中,PTEN作为H2O2诱导的大鼠心肌细胞凋亡的负调节因子[10],miR-486-5p可通过靶向抑制PTEN并激活PI3K/AKT信号通路来保护心肌细胞免于凋亡[11]。FoxO家族参与调节多种细胞功能,FoxO1通过转录控制丙酮酸脱氢酶激酶4的表达,调节心肌葡萄糖氧化速率[12],其抑制作用也显著抑制成肌细胞增殖和减少成肌细胞凋亡[13]。Sirt1失活在缺血再灌注诱导的细胞凋亡中起关键作用[14]。因此,这些靶基因的抑制可能涉及miR-486对心肌细胞低氧损伤的保护作用。这在本研究中也得到了证实,低氧环境中,与C+H组比较,M+H组LDH释放和细胞凋亡率明显下降,细胞活力明显上升;而I+H组LDH释放明显增多,细胞凋亡率明显上升,细胞活力明显降低。可见,miR-486对低氧导致的心肌细胞损伤和凋亡的改善是有效的。
综上,本研究表明,miR-486对原代心肌细胞低氧状态下的损伤和凋亡有显著改善作用。miR-486可能为缺血性心脏病的基因治疗提供新的思路和实验依据。
| [1] |
SALA V, BERGERONE S, GATTI S, et al. MicroRNAs in myocardial ischemia:identifying new targets and tools for treating heart disease. New frontiers for miR-medicine[J]. Cell Mol Life Sci, 2014, 71(8): 1439-1452. DOI:10.1007/s00018-013-1504-0 |
| [2] |
CANFRÁN-DUQUE A, LIN CS, GOEDEKE L, et al. Micro-RNAs and high-density lipoprotein metabolism[J]. Arterioscler Thromb Vasc Biol, 2016, 36(6): 1076-1084. DOI:10.1161/ATVBAHA.116.307028 |
| [3] |
FEINBERG MW, MOORE KJ. MicroRNA regulation of atherosclerosis[J]. Circ Res, 2016, 118(4): 703-720. DOI:10.1161/CIRCRESAHA.115.306300 |
| [4] |
KANE NM, THRASHER AJ, ANGELINI GD, et al. Concise review:microRNAs as modulators of stem cells and angiogenesis[J]. Stem Cells, 2014, 32(5): 1059-1066. DOI:10.1002/stem.1629 |
| [5] |
SMALL EM, O'ROURKE JR, MORESI V, et al. Regulation of PI3-kinase/Akt signaling by muscle-enriched microRNA-486[J]. Proc Natl Acad Sci U S A, 2010, 107(9): 4218-4223. DOI:10.1073/pnas.1000300107 |
| [6] |
OYAMA Y, BARTMAN CM, GILE J, et al. Circadian microRNAs in cardioprotection[J]. Curr Pharm Des, 2017, 23(25): 3723-3730. DOI:10.2174/1381612823666170707165319 |
| [7] |
WOJCIECHOWSKA A, BRANIEWSKA A, KOZAR-KAMINSKA K. MicroRNA in cardiovascular biology and disease[J]. Adv Clin Exp Med, 2017, 26(5): 865-874. DOI:10.17219/acem/62915 |
| [8] |
SUN T, DONG YH, DU W, et al. The role of microRNAs in myocardial infarction:from molecular mechanism to clinical application[J]. Int J Mol Sci, 2017, 18(4): E745. DOI:10.3390/ijms18040745 |
| [9] |
刘鹏飞, 张海涛, 齐弘炜, 等. 过表达microRNA-486对大鼠心肌梗死后心脏功能损伤的改善[J]. 中国医科大学学报, 2017, 46(7): 595-599. DOI:10.12007/j.issn.0258-4646.2017.07.005 |
| [10] |
XU J, TANG Y, BEI Y, et al. miR-19b attenuates H2O2-induced apoptosis in rat H9C2 cardiomyocytes via targeting PTEN[J]. Oncotarget, 2016, 7(10): 10870-10878. DOI:10.18632/oncotarget.7678 |
| [11] |
ZHU HH, WANG XT, SUN YH, et al. MicroRNA-486-5p targeting PTEN protects against coronary microembolization-induced cardiomyocyte apoptosis in rats by activating the PI3K/AKT pathway[J]. Eur J Pharmacol, 2019, 855: 244-251. DOI:10.1016/j.ejphar.2019.03.045 |
| [12] |
GOPAL K, SALEME B, AL BATRAN R, et al. FoxO1 regulates myocardial glucose oxidation rates via transcriptional control of pyruvate dehydrogenase kinase 4 expression[J]. Am J Physiol Heart Circ Physiol, 2017, 313(3): H479-H490. DOI:10.1152/ajpheart.00191.2017 |
| [13] |
JIA X, OUYANG H, ABDALLA BA, et al. miR-16 controls myoblast proliferation and apoptosis through directly suppressing Bcl2 and FOXO1 activities[J]. Biochim Biophys Acta Gene Regul Mech, 2017, 1860(6): 674-684. DOI:10.1016/j.bbagrm.2017.02.010 |
| [14] |
CATTELAN A, CEOLOTTO G, BOVA S, et al. NAD+-dependent SIRT1 deactivation has a key role on ischemia-reperfusion-induced apoptosis[J]. Vascul Pharmacol, 2015, 70: 35-44. DOI:10.1016/j.vph.2015.02.004 |
 2020, Vol. 49
2020, Vol. 49




