文章信息
- 李立杰, 葛华, 陈曦, 鲁伟, 王月, 陈克研
- LI Lijie, GE Hua, CHEN Xi, LU Wei, WANG Yue, CHEN Keyan
- 麝香通心滴丸对高血压大鼠血管内皮功能及Rho/ROCK信号通路的影响
- Effect of musk tongxin dropping pills on vascular endothelial function and the Rho/ROCK signaling pathway in hypertensive rats
- 中国医科大学学报, 2020, 49(6): 485-489, 504
- Journal of China Medical University, 2020, 49(6): 485-489, 504
-
文章历史
- 收稿日期:2019-05-07
- 网络出版时间:2020-05-18 14:11
2. 中国医科大学实验动物部, 沈阳 110122
2. Department of Laboratory Animal science, China Medical University, Shenyang 110122, China
内皮细胞主要以旁分泌的形式分泌血管内皮衍生舒张因子(endothelium derived relaxing factor,EDRF)和内皮源血管收缩因子(endothelium derived contracting factor,EDCF),两者共同调节血管张力。正常情况下,EDRF与EDCF处于平衡状态,但是在高血压病理情况下,血管压力增加,打破了EDRF与EDCF的平衡,造成内皮细胞形态结构改变和功能的失调,加速高血压的发生与发展,因此,血管内皮损伤既是高血压的病理结果,也是高血压的致病因素[1-2]。近年来减轻血管内皮损伤,改善血管内皮功能已经成为治疗高血压的研究热点[3]。麝香通心滴丸是目前国内应用于冠状动脉粥样硬化性心脏病(简称冠心病)治疗的中药复方药物,由麝香、人参、茎叶总皂苷、蟾酥、丹参、熊胆粉、人工牛黄及冰片组成,具有芳香益气通脉,活血化瘀止痛之效[4-5]。临床研究[6]表明,麝香通心滴丸具有保护血管内皮作用,但具体分子机制尚不明确。
RhoA/ROCK信号通路是心血管系统领域的热点通路,RhoA GTP酶及其下游ROCK与血管平滑肌收缩、应力纤维形成、细胞迁移及血压调节等过程有关[7]。因此,RhoA/ROCK信号通路对高血压、动脉粥样硬化及中风等心血管系统疾病具有重要的调节作用。本研究建立高血压大鼠模型,给予麝香通心滴丸干预治疗,探讨麝香通心滴丸对高血压大鼠血管内皮的作用及可能的机制。
1 材料与方法 1.1 实验动物及分组SPF级雄性自发性高血压大鼠20只及同类正常血压大鼠10只,体质量200~220 g,购自上海高血压病研究所实验动物中心。大鼠分笼饲养,室温20~25 ℃,湿度50%,每天光照12 h。适应性饲养1周后,采用随机数字表法将自发性高血压大鼠分为模型组(SHR组)及麝香通心滴丸组(STX组),每组10只;正常血压大鼠作为对照组。
1.2 麝香通心滴丸剂量和配制方法根据人体与动物药物等效剂量换算公式[8]:B种动物的剂量(g)=A种动物剂量(g/kg)×W(折算系数)×B种动物的体质量(kg)。人与大鼠的折算系数为6。因此,麝香通心滴丸的大鼠给药剂量约为4.2 mg/kg,将麝香通心滴丸利用无菌蒸馏水配制成420 mg/mL药液,灌胃给药,1次/d,连续治疗2周,每周测量1次体质量,并根据体质量变化调整给药剂量,对照组和SHR组给予等体积蒸馏水。
1.3 大鼠收缩压测定分别于给药前,给药1周、2周后,进行大鼠尾动脉血压测量,在恒温安静的环境下,上午8:00至12:00进行大鼠动脉血压测量,每次每只大鼠重复测量3次,血压以波动不超过10 mmHg为宜,取3次平均值。
1.4 动物处死及取材给药2周后大鼠禁食12 h,然后戊巴比妥钠(50 mg/kg)腹腔注射麻醉,于腹主动脉采血8 mL,10 000 r/min离心10 min分离血清,-20 ℃冰箱中保存备用。4%多聚甲醛灌注血管,随后生理盐水冲洗5 min,暴露胸主动脉,每只大鼠取胸主动脉(约4.0 cm),液氮冷冻后置于-80 ℃深冻冰箱保存。
1.5 血管组织一氧化氮(nitric oxide,NO)、丙二醛(malondialdehyde,MDA)含量及超氧化物歧化酶(superoxide diasmutase,SOD)活性测定分别采用硝酸还原酶法测定各组大鼠血管内皮NO含量、TBA法测定大鼠血管内皮MDA含量、采用羟胺法测定大鼠血管内皮SOD活性(南京建成生物技术有限公司)。将各组大鼠胸主动脉,用1 mL预冷的PBS缓冲液匀浆,4 ℃ 10 000 r/min离心10 min,吸取上清液至新的离心管中,采用考马斯亮蓝检测组织匀浆液中蛋白含量。大鼠胸主动脉NO、MDA含量及SOD活性检测实验步骤严格按照试剂盒说明书进行。
1.6 大鼠血清中内皮素-1(endothelin-1,ET-1)及血管内皮生长因子(vascular endothelil growth factor,VEGF)含量测定酶联免疫吸附实验(enzyme-linked immunosorbent assay,ELISA)检测各组大鼠血清中ET-1及VEGF含量,步骤严格按照试剂盒说明书进行操作。酶标仪在450 nm波长下检测吸光度值,根据梯度浓度标准品的OD值绘制标准曲线,得到回归方程,根据回归方程计算样品中ET-1及VEGF含量。
1.7 血管组织 ET-1及VEGF mRNA表达测定利用TRIzol法提取组织中总RNA,取各组大鼠胸主动脉加入1 mL TRIzol进行匀浆,匀浆液置于1.5 mL离心管中备用;每管加入0.2 mL氯仿,盖紧盖子后剧烈震摇15 s,冰浴5 min。4 ℃ 12 000 r/min离心10 min;取上层水相,加入0.5 mL异丙醇,轻轻颠倒,冰浴10 min。4 ℃ 12 000 r/min离心10 min;弃上清,加入1 mL用DEPC处理的水配置的75%乙醇,洗涤沉淀。4 ℃ 7 500 r/min离心5 min;弃上清,自然吹干后用0.01% DEPC溶解沉淀,待用。按照试剂盒说明书合成cDNA。取2 μL cDNA为模板,按照实时PCR说明书进行体外扩增,以β-actin作为内参,引物序列如下:β-actin,上游5’-GGGAAATCGTGCGTGACAT-3’,下游5’-TCAGGAGGAGCAATGATCTTG-3’;ET-1,上游5’-AGGCGATCAGAGCAACCAG -3’,下游5’-CCATCAAGGAGGAGCAGGA-3’;VEGF,上游5’-ACGTCGGAGAGCAACGTCAC-3’,下游5’-ACCGGGATTTCTTGCGCTTTCGT-3’。结果使用2-△△Ct法计算基因相对表达变化。反应体系50 μL,反应条件如下:在95 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 60 s,循环30次;72 ℃ 1 min。
1.8 Western blotting检测将大鼠胸主动脉剪碎,提取总蛋白,4 ℃ 12 000 r/min离心20 min,使用BCA蛋白定量试剂盒对蛋白进行定量,进行SDS-聚丙烯酸胺凝胶电泳,使用PVDF膜转膜2 h,5%脱脂奶粉封闭液封闭1 h,TBST洗膜,分别加入RhoA、ROCK、MLC及β-actin一抗(1:1 000),TBST洗膜加入相应HRP标记二抗稀释浓度为1:1 000,室温孵育1 h。TBST洗膜,ECL发光试剂盒发光,凝胶成像系统成像,Image J软件计算灰度值,采用目的条带与内参蛋白条带光密度比值作为结果。
1.9 统计学分析采用SPSS 20.0软件进行统计学分析。数据采用x±s表示,多组间比较采用单因素方差分析,2组间比较采用LSD-t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 麝香通心滴丸对大鼠收缩压的影响在给予麝香通心滴丸治疗前,SHR组及STX组大鼠收缩压与对照组比较明显升高,差异具有统计学意义(P < 0.05),而SHR组与STX组大鼠收缩压差异没有统计学意义(P > 0.05);在给药1周及2周后结果显示,与SHR组比较,STX组大鼠尾动脉收缩压明显降低,差异有统计学意义(P < 0.05),见表 1。
| Group | n | Before administration | 1 week after administration | 2 weeks after administration |
| Control | 10 | 112.93±11.05 | 109.28±11.46 | 110.26±9.32 |
| SHR | 10 | 189.58±13.671) | 192.38±5.92 | 195.37±5.57 |
| STX | 10 | 187.41±9.021) | 165.73±6.782) | 152.39±3.962) |
| 1)P < 0.05 vs control group;2)P < 0.05 vs SHR group. | ||||
2.2 麝香通心滴丸对大鼠血管组织NO、MDA含量及SOD活性的影响
与对照组比较,SHR组大鼠血管组织中NO含量及SOD活性明显降低,而MDA含量却显著增加,差异有统计学意义(均P < 0.05);给予麝香通心滴丸治疗后,与SHR组比较,STX组大鼠血管组织中NO含量及SOD活性明显增加,而MDA含量显著降低(均P < 0.05),见表 2。麝香通心滴丸能够明显增加高血压大鼠血管内皮NO含量并减轻氧化应激水平。
| Group | n | NO(μmol/g) | SOD(U/mg) | MDA(nmol/mg) |
| Control | 10 | 158.76±4.67 | 86.85±10.03 | 6.94±0.86 |
| SHR | 10 | 90.51±5.631) | 47.79±7.381) | 18.15±2.051) |
| STX | 10 | 123.85±5.322) | 71.82±11.012) | 13.57±2.382) |
| 1)P < 0.05 vs control group;2)P < 0.05 vs SHR group. | ||||
2.3 麝香通心滴丸对大鼠血清中ET-1及VEGF含量的影响
如表 3所示,与对照组比较,SHR组大鼠血清中ET-1及VEGF含量明显升高(P < 0.05);给予麝香通心滴丸治疗后,与SHR组比较,STX组大鼠血清中ET-1及VEGF含量显著降低(P < 0.05)。麝香通心滴丸能够调节高血压大鼠体内血管活性物质的水平。
| Group | ET-1(μg/L) | VEGF(pg/mL) | ET-1 mRNA | VEGF mRNA |
| Control | 28.75±5.13 | 14.97±4.18 | 1.05±0.12 | 1.03±0.14 |
| SHR | 52.86±9.121) | 38.57±5.691) | 2.15±1.011) | 2.86±1.081) |
| STX | 34.51±6.792) | 27.18±5.492) | 1.45±0.972) | 1.85±1.052) |
| 1)P < 0.05 vs control group;2)P < 0.05 vs SHR group. | ||||
2.4 麝香通心滴丸对大鼠血管组织中ET-1及VEGF mRNA表达的影响
与对照组比较,模型组大鼠血管组织中ET-1及VEGF mRNA明显升高(P < 0.05);给予麝香通心滴丸治疗后,与SHR组比较,大鼠血管组织中ET-1及VEGF mRNA显著降低(均P < 0.05),见表 3,与血清ELISA结果一致。
2.5 麝香通心滴丸对大鼠血管组织RhoA/ROCK信号通路的影响结果显示,与对照组比较,SHR组大鼠RhoA、ROCK及MLC蛋白表达量明显升高(均P < 0.05);给予麝香通心滴丸治疗后,与SHR组比较,STX组大鼠血管组织中RhoA、ROCK及MLC蛋白表达明显降低(均P < 0.05),见图 1、表 4。麝香通心滴丸发挥对高血压大鼠血管内皮的保护作用,可能与抑制RhoA/ROCK信号通路有关。
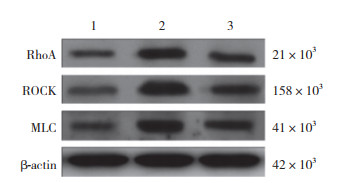
|
| 图 1 各组大鼠RhoA、ROCK及MLC蛋白表达 Fig.1 RhoA, ROCK, and MLC protein expression in each group |
| Group | n | RhoA protein | ROCK protein | MLC protein |
| Control | 10 | 0.11±0.02 | 0.19±0.09 | 0.15±0.06 |
| SHR | 10 | 0.65±0.11 | 0.99±0.111) | 0.78±0.311) |
| STX | 10 | 0.23±0.07 | 0.51±0.172) | 0.58±0.142) |
| 1)P < 0.05 vs control group;2)P < 0.05 vs SHR group. | ||||
3 讨论
血管内皮细胞是循环血液与血管内皮组织之间的单层细胞,是机体血液与组织之间的代谢交换屏障,也是机体分泌多种活性物质的内分泌腺,具有调节血管收缩及舒张的能力。血管内皮是调节血管张力、细胞生长以及白细胞、血小板和血管壁之间相互作用的组织,血管内皮功能不良与高血压的发生发展密切相关[9]。内皮功能障碍可增加全身血管阻力,从而导致高血压的发展[10]。中医药治疗血管性病变主要以活血化瘀为主,降脂、抗凝,从而起到调节血管内皮功能的作用。麝香通心滴丸主要成分麝香具有抗血栓、抗血小板聚集的作用,并能抑制心肌耗氧量,对冠心病患者的血管内皮具有一定的保护作用;人参主要成分人参皂苷具有较强的抗氧化作用,对心肌缺血再灌注损伤、肝损伤及高血压、高血脂等大鼠模型均能够发挥清除氧自由基、抑制氧化应激的作用;蟾酥具有调节血压、扩张冠状动脉作用,同时还能够抑制炎症、调节免疫;丹参及熊胆粉具有降脂溶栓的作用[11-12]。因此,麝香通心滴丸能够多方面纠正血管内皮功能紊乱,保护血管内皮功能。
NO在心血管系统疾病发病机制及治疗中具有重要作用,NO能抑制血小板的聚集,防止血栓形成,抑制炎症浸润,增强免疫调节,降低血压和调节血管张力[13]。NO通过激活鸟苷酸环化酶以增加环磷酸鸟苷水平,环磷酸鸟苷能减少大量钙依赖性细胞内钙的含量,从而抑制钙介导的磷酸化,达到扩张血管目的。NO还能够通过调节血管张力抑制血管紧张素Ⅱ对近曲小管Na+的重吸收,影响胞内环磷酸腺苷对肾脏水钠盐滤过、重吸收,从而调节血压[14]。在病理状态下,NO释放受到抑制,造成血管舒张功能障碍或血管内皮收缩因子生成增加,导致血压升高,血压升高加重对内皮细胞的损害,进一步抑制NO的释放,造成恶性循环[15]。本研究STX组给予麝香通心滴丸后大鼠体内NO水平明显增加,说明其具有逆转高血压造成的NO合成及释放量降低的作用。
ET-1是由血管内皮分泌的细胞因子,具有强烈的缩血管作用。ET-1与NO是相互制约的血管活性物质,NO水平降低,ET-1水平则会增加,造成血管收缩。ET-1还能够通过激活钙通道,增加钙内流,促进血管平滑肌收缩和增生,增加外周血管阻力,引起血压升高[16]。VEGF是重要的促进血管生成的细胞因子。有研究[17]表明,高血压发生后VEGF表达升高,进而抑制血管内皮细胞凋亡促进增殖,导致血管通透性增加,可能与激活PI3K/AKT信号通路有关。本研究发现麝香通心滴丸治疗后,大鼠血清中ET-1及VEGF含量及胸主动脉ET-1及VEGF mRNA的表达明显降低,发挥了对高血压大鼠血管内皮的保护作用。
研究[18]显示高血压可导致机体SOD活性降低及MDA含量增加,从而发生氧化应激反应,导致血管内皮细胞功能受损。本研究中,高血压大鼠血管内皮中SOD活性明显降低,而MDA含量明显增加(均P < 0.05);麝香通心滴丸治疗能够增加SOD活性,降低MDA含量,改善高血压大鼠氧化应激水平,从而改善血管内皮损伤。
有研究[6, 19]表明,RhoA/ROCK信号通路参与高血压的发生与发展,在不同高血压大鼠模型血管内皮中均可以检测出RhoA、ROCK的大量激活。给予ROCK抑制剂可不同程度降低血压,因此推测RhoA/ROCK信号通路有可能成为高血压治疗的有效靶点[20]。RhoA是Rho GTP酶家族中研究最广泛的成员之一,RhoA介导应力纤维的形成。ROCK为Rho激酶,是RhoA最直接的下游靶基因,具有调节细胞收缩、迁移和增殖等多种功能。血管内皮收缩与舒张的平衡对于维持血压稳定至关重要,RhoA/ROCK信号通路可以诱导机体对钙离子的敏感性增加,抑制MLC蛋白活性导致血管内皮收缩;同时,RhoA/ROCK信号通路激活后还能够促进MLC磷酸化,诱导血管内皮收缩,使血压升高[21-22]。本研究结果发现,麝香通心滴丸可以抑制高血压大鼠血管组织中RhoA、ROCK及MLC蛋白的表达,从而抑制RhoA/ROCK信号通路活性,抑制血管收缩,降低血管通透性,改善高血压大鼠血管内皮损伤。
综上所述,麝香通心滴丸能够增加高血压大鼠NO合成及释放,抑制血管活性物质ET-1及VEGF的含量,改善氧化应激,发挥降压和保护血管内皮的作用,其机制可能与抑制RhoA/ROCK信号通路有关。
| [1] |
SITOHY B, CHANG S, SCIUTO TE, et al. Early actions of anti-vascular endothelial growth factor/vascular endothelial growth factor receptor drugs on angiogenic blood vessels[J]. Am J Pathol, 2017, 187(10): 2337-2347. DOI:10.1016/j.ajpath.2017.06.010 |
| [2] |
GOTO K, OHTSUBO T, KITAZONO T. Endothelium-dependent hyperpolarization (EDH) in hypertension:the role of endothelial Ion channels[J]. Int J Mol Sci, 2018, 19(1): E315. DOI:10.3390/ijms19010315 |
| [3] |
CHI LY, HU XJ, ZHANG WT, et al. Adipokine CTRP6 improves PPARγ activation to alleviate angiotensin II-induced hypertension and vascular endothelial dysfunction in spontaneously hypertensive rats[J]. Biochem Biophys Res Commun, 2017, 482(4): 727-734. DOI:10.1016/j.bbrc.2016.11.102 |
| [4] |
万会防. 麝香通心滴丸对冠心病患者血管内皮功能改善作用的研究[J]. 中国当代医药, 2017, 24(22): 27-29. DOI:10.3969/j.issn.1674-4721.2017.22.009 |
| [5] |
杨杰, 张邢炜, 邓亚萍, 等. 麝香通心滴丸对冠心病患者血管内皮功能改善作用的研究[J]. 中华中医药学刊, 2016, 34(9): 2188-2190. DOI:10.13193/j.issn.1673-7717.2016.09.040 |
| [6] |
黄县立, 饶玲璋, 熊慧, 等. 麝香通心滴丸在冠心病PCI术后患者中应用的临床研究[J]. 中国心血管病研究, 2018, 16(1): 73-75. DOI:10.3969/j.issn.1672-5301.2018.01.019 |
| [7] |
LI QY, WO D, HUANG Y, et al. Alkaloids from Nelumbinis Plumula (AFNP) ameliorate aortic remodeling via RhoA/ROCK pathway[J]. Biomedecine Pharmacother, 2019, 112: 108651. DOI:10.1016/j.biopha.2019.108651 |
| [8] |
LOPEZ NC, EBENSPERGER G, HERRERA EA, et al. Role of the RhoA/ROCK pathway in high-altitude associated neonatal pulmonary hypertension in lambs[J]. Am J Physiol Regul Integr Comp Physiol, 2016, 310(11): R1053-R1063. DOI:10.1152/ajpregu.00177.2015 |
| [9] |
黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004, 9: 1069-1072. DOI:10.3969/j.issn.1009-2501.2004.09.026 |
| [10] |
周福亮, 贾大林. 内皮细胞特异分子-1在心血管疾病中的研究进展[J]. 解剖科学进展, 2018, 24(5): 554-557. DOI:10.16695/j.cnki.1006-2947.2018.05.028 |
| [11] |
雷莹, 于晓玲, 陈杭, 等. 高血压病患者脉压指数与血管内皮功能相关性分析[J]. 中国医科大学学报, 2011, 40(3): 255-258, 261. |
| [12] |
吴琪, 俞军海, 曹盛盛, 等. 麝香通心滴丸对高血压患者肾素-血管紧张素-醛固酮系统的影响[J]. 中华中医药学刊, 2016, 34(6): 1351-1353. DOI:10.13193/j.issn.1673-7717.2016.06.019 |
| [13] |
林珊.基于PI3K/Akt信号转导通路探讨麝香通心滴丸抗心肌缺血的物质基础和作用机制[D].福州: 福建中医药大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10393-1017099711.htm
|
| [14] |
YANG H, BAI WW, GAO LH, et al. Mangiferin alleviates hypertension induced by hyperuricemia via increasing nitric oxide releases[J]. J Pharmacol Sci, 2018, 137(2): 154-161. DOI:10.1016/j.jphs.2018.05.008 |
| [15] |
YU BL, FERRARI M, SCHLEIFER G, et al. Development of a portable mini-generator to safely produce nitric oxide for the treatment of infants with pulmonary hypertension[J]. Nitric Oxide, 2018, 75: 70-76. DOI:10.1016/j.niox.2018.02.006 |
| [16] |
PINHEIRO LC, TANUS-SANTOS JE, CASTRO MM. The potential of stimulating nitric oxide formation in the treatment of hypertension[J]. Expert Opin Ther Targets, 2017, 21(5): 543-556. DOI:10.1080/14728222.2017.1310840 |
| [17] |
XU M, LU YP, HASAN AA, et al. Plasma ET-1 concentrations are elevated in patients with hypertension-meta-analysis of clinical studies[J]. Kidney Blood Press Res, 2017, 42(2): 304-313. DOI:10.1159/000477572 |
| [18] |
HAMNVIK OP, CHOUEIRI TK, TURCHIN A, et al. Clinical risk factors for the development of hypertension in patients treated with inhibitors of the VEGF signaling pathway[J]. Cancer, 2015, 121(2): 311-319. DOI:10.1002/cncr.28972 |
| [19] |
CALO LA, RAVAROTTO V, SIMIONI F, et al. Pathophysiology of post transplant hypertension in kidney transplant:focus on calcineurin inhibitors induced oxidative stress and renal sodium retention and implications with RhoA/Rho kinase pathway[J]. Kidney Blood Press Res, 2017, 42(4): 676-685. DOI:10.1159/000483023 |
| [20] |
CAO X, LUO T, LUO X, et al. Resveratrol prevents AngⅡ-induced hypertension via AMPK activation and RhoA/ROCK suppression in mice[J]. Hypertens Res, 2014, 37(9): 803-810. DOI:10.1038/hr.2014.90 |
| [21] |
CANTONI S, CAVALLI S, PASTORE F, et al. Pharmacological characterization of a highly selective Rho kinase (ROCK) inhibitor and its therapeutic effects in experimental pulmonary hypertension[J]. Eur J Pharmacol, 2019, 850: 126-134. DOI:10.1016/j.ejphar.2019.02.009 |
| [22] |
ZHANG CG, ZHANG B, DENG WS, et al. Role of estrogen receptor β selective agonist in ameliorating portal hypertension in rats with CCl4-induced liver cirrhosis[J]. World J Gastroenterol, 2016, 22(18): 4484-4500. DOI:10.3748/wjg.v22.i18.4484 |
 2020, Vol. 49
2020, Vol. 49




