文章信息
- 孙骏, 肖亮, 宋健博
- SUN Jun, XIAO Liang, SONG Jianbo
- 急诊经肝动脉栓塞治疗肝细胞癌自发性破裂出血的临床疗效及预后的影响因素
- Clinical efficacy and prognostic factors of emergency transhepatic arterial embolization in the treatment of spontaneous rupture and bleeding of hepatocellular carcinoma
- 中国医科大学学报, 2020, 49(6): 481-484
- Journal of China Medical University, 2020, 49(6): 481-484
-
文章历史
- 收稿日期:2019-12-13
- 网络出版时间:2020-05-18 14:22
肝细胞癌(hepatocellular carcinoma,HCC)自发性破裂出血是罕见且危及生命的并发症,亚洲国家发生率约为2.3%~26%,西方国家发生率不足3%[1]。由于失血性休克、肝功能衰竭等原因,患者住院死亡率达25%~75%[2]。HCC自发性破裂出血的治疗既往多以内科止血及外科手术为主,近年来随着经肝动脉栓塞(transhepatic arterial embolization,TAE)治疗的发展,因其具有微创、安全有效等优势成为治疗的首选方式。但目前在选择最佳治疗方式来降低死亡率及提高患者长期生存率方面还没有统一标准[3-4]。本研究回顾性分析急诊48例HCC自发性破裂出血并TAE治疗患者的临床资料,探讨其临床疗效及影响预后的因素。
1 材料与方法 1.1 临床资料收集2015年1月至2019年6月我院急诊HCC自发破裂出血TAE治疗的48例患者的临床资料,其中男35例,女13例;年龄28~88岁,平均(63.33±13.02)岁。肝功能A级18例、B级21例、C级9例;临床表现主要为突发的右上腹剧痛、腹胀及出现不同程度休克前期症状(面色苍白、出冷汗等),所有患者行腹部CT平扫或增强显示肝内占位性病变伴腹腔积血;21例诊断性腹腔穿刺抽出不凝血。纳入标准:(1)患者均经临床综合诊断为HCC自发性破裂出血;(2)具有完整临床资料。排除标准:(1)HCC经内科或外科治疗;(2)原发性肿瘤远处转移者。
1.2 治疗方法休克患者需给予抗休克、补液等治疗,同时行急诊TAE手术。手术全程监测患者血压、血氧饱和度等情况。常规消毒、铺巾、2%利多卡因局部麻醉后,采用改良Seldinger技术穿刺股动脉,5F肝动脉导管插管至腹腔干造影,了解肝内肿瘤发生的部位、大小及供血动脉情况(图 1),同时观察有无伴有肝动静脉、门静脉瘘等情况。腹腔干造影时肝脏出现供血缺损区则需同时行肠系膜上动脉造影,仍有缺损区则继续寻找肝外供血动脉,动脉造影确诊后在肝左、右动脉或肝外供血动脉内使用微导管超选择性插管至肿瘤各支供血动脉。肝动脉造影显示造影剂外溢时,首先快速向靶血管内注射少量明胶海绵颗粒,以减少血流量,然后用碘油和明胶海绵颗粒或PVA颗粒进行超选择性栓塞。如有肝动脉门静脉瘘时,首先用明胶海绵颗粒封堵瘘口后再行栓塞,即使是多发性肿瘤患者总碘油量也要控制在10 mL以下,腹胀严重者行经皮腹腔穿刺引流治疗。
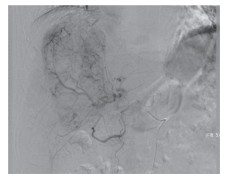
|
| 图 1 TAE术前造影可见肿瘤染色,未见造影剂外溢 Fig.1 TAE preoperative angiography showed tumor staining and no contrast agent spillage |
破裂肿瘤的靶血管内实现完全血流停滞和保留周围正常肝实质供血为止血成功(图 2)。在停止输血或不输血等支持性治疗后,通过稳定的生命体征和血红蛋白量来判定患者TAE临床成功。
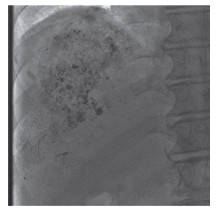
|
| 图 2 TAE术后肿瘤染色大部分消失,可见碘油沉积 Fig.2 Most tumor staining disappeared after TAE, and lipiodol deposition was visible |
1.3 随访
患者出院后1个月门诊随访,行肝肾功能、AFP测定、肝脏增强CT或MRI、胸部CT平扫检查,监测复发和转移情况。根据肿瘤进展情况安排下一步治疗,包括肝叶切除、射频消融或微波消融、经皮肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)、放射治疗、索拉非尼或最佳支持治疗。之后每2个月门诊随访1次。
1.4 统计学分析采用SPSS 23.0软件进行统计学分析。计量资料采用x±s表示。采用Kaplan-Meier法统计患者生存率,采用Cox回归分析预后的影响因素,P < 0.05为差异有统计学意义。
2 结果 2.1 疗效分析48例均止血成功。术后30 d内5例死亡(3例死于肝功能衰竭,1例死于肝肾综合征,1例死于肿瘤破裂再出血)。43例患者接受了进一步治疗,其中37例患者贯续行TACE,4例行射频消融或微波消融,2例行肝叶切除。随访期间内死亡27例(17例死于肿瘤进展,8例死于肝衰竭,2例死于肿瘤破裂出血)。所有患者经TAE治疗后6个月、1年和2年总生存率分别为63.0%,45.3%,20.4%,见图 3。
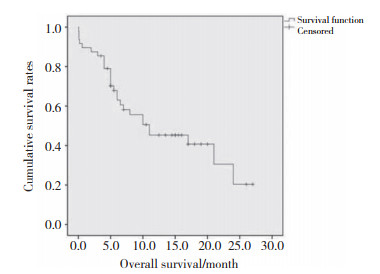
|
| 图 3 患者TAE术后累计生存率 Fig.3 Cumulative survival rate of patients after TAE treatment |
2.2 TAE术后不良反应情况
21例患者出现栓塞后综合征,主要表现为发热、轻度-中度上腹疼痛、恶心等。所有患者症状均在1周内通过保守治疗缓解。严重腹胀者9例,均行腹腔穿刺引流术。
2.3 预后的影响因素分析单因素分析结果显示,肿瘤大小、有无门静脉癌栓、入院时有无休克、肝功能分级均与患者预后相关(均P < 0.05)。见表 1。将单因素分析有统计学意义变量进一步进行多因素分析,结果显示,肿瘤最大直径≥10 cm、有门静脉癌栓、入院时有休克、肝功能C级与预后不良相关(均P < 0.05)。见表 2。
| Variable | Data | HR(95% CI) | P |
| Age(year) | 63.00±13.02 | 0.997(0.959-1.037) | 0.898 |
| Gender(male/female) | 8/13 | 0.794(0.347-0.817) | 0.586 |
| Etiology(HBV/others) | 26/22 | 1.109(0.422-2.917) | 0.933 |
| Tumor number(single/multiple) | 31/17 | 1.931(0.870-4.283) | 0.106 |
| AST(U/L) | 133.99±162.35 | 1.002(0.996-1.009) | 0.442 |
| ALT(U/L) | 127.22±95.59 | 1.005(0.999-1.011) | 0.083 |
| Platelet count(×109/L) | 188.50±46.46 | 1.008(0.998-1.109) | 0.108 |
| Albumin(g/L) | 33.14±4.28 | 0.948(0.871-1.031) | 0.211 |
| Hemoglobin(g/L) | 106.02±17.59 | 0.972(0.933-1.102) | 0.163 |
| Total bilirubin(μmol/L) | 23.27±9.66 | 1.104(0.973-1.056) | 0.511 |
| PT(s) | 14.31±3.30 | 0.837(0.605-1.159) | 0.285 |
| Portal vein thrombus(no/yes) | 43/5 | 4.571(1.470-14.210) | 0.009 |
| Tumor diameter(<10 cm /≥10 cm) | 39/9 | 5.768(2.466-13.491) | < 0.001 |
| Shock on admission(absence/presence) | 35/13 | 3.981(1.828-8.669) | 0.001 |
| Child-Pugh class(A/B/C) | 18/21/9 | 3.706(1.791-7.668) | < 0.001 |
| Factor | β | HR | P | 95% CI |
| Portal vein thrombus | 3.620 | 16.833 | 0.002 | (2.907-97.464) |
| Tumor diameter | 2.240 | 13.063 | < 0.001 | (4.088-41.738) |
| Shock on admission | 0.873 | 5.946 | 0.002 | (1.937-18.253) |
| Child-Pugh class | 2.330 | 5.824 | 0.001 | (1.999-16.971) |
3 讨论
目前HCC是我国第4位常见恶性肿瘤[5],自发性破裂出血是最严重并发症之一,其发病急且预后差[2],确切作用机制仍不清楚。有学者[1, 6]认为肿瘤细胞阻塞肝静脉导致瘤内压力增加,肿瘤生长过快和坏死,包膜下肿瘤和肿瘤体积大,肿瘤血管脆性增加、凝血障碍,外伤,门静脉高压等是引起自发性破裂出血的危险因素。临床上HCC破裂出血治疗主要分为2步骤:在出血早期,以止血和稳定生命体征为主;在稳定期,对患者肝脏储备及肿瘤状态进行进一步评估,以肿瘤治疗为主[7]。因此,如何降低HCC破裂出血患者早期死亡率,为患者下一步治疗及远期生存提供可能成为亟待解决的临床问题。研究[2]显示20世纪60年代至20世纪80年代首选外科手术止血治疗。然而HCC破裂出血患者往往伴有肝硬化,且病情危重,无法耐受急诊手术治疗[8]。亦有研究[9]表明急诊HCC切除是破裂出血患者在院死亡的独立高危因素。MATSUMOTO等[10]研究发现急诊TAE可以明显改善肝癌破裂出血患者近期预后,急诊TAE控制出血有效率为86.4%。TAE与外科手术比较,操作简便,创伤小,术后并发症少,止血效果明显,应作为肝癌破裂出血急诊止血的首选[11-12]。本研究48例患者行TAE治疗后止血成功率100%,与以往研究结果一致。有研究[3]结果显示,如果入院时患者存在休克,表明患者肿瘤破裂出血严重,进一步损坏了肝功能,与早期死亡率明显相关。本研究中13例患者入院时出现低血容量性休克,其中4例30 d内死亡,与以往研究结果一致。此外,本研究发现肿瘤直径≥10 cm、肝功能C级、门静脉癌栓是患者预后不良的影响因素(均P < 0.05),与既往研究一致[13]。因此临床上积极纠正休克、合理减轻肿瘤负荷对预后具有重要意义[14]。此外,急诊TAE术后积极保护患者肝功能至关重要。
综上所述,急诊TAE治疗HCC自发性破裂出血安全有效,可作为首选治疗方法。肿瘤大小≥10 cm、Child-Pugh分级C级、入院时休克、门静脉癌栓与预后不良相关。本研究存在的不足之处:(1)样本相对较少;(2)急诊TAE后结合不同的后续治疗(手术切除,局部射频消融、TACE等)未能进一步分析;(3)没有与其他的治疗方式进行比较。
| [1] |
YOSHIDA H, MAMADA Y, TANIAI N, et al. Spontaneous ruptured hepatocellular carcinoma[J]. Hepatol Res, 2016, 46(1): 13-21. DOI:10.1111/hepr.12498 |
| [2] |
LAI EC, LAU WY. Spontaneous rupture of hepatocellular carcinoma:a systematic review[J]. Arch Surg, 2006, 141(2): 191-198. DOI:10.1001/archsurg.141.2.191 |
| [3] |
HSUEH KC, FAN HL, CHEN TW, et al. Management of spontaneously ruptured hepatocellular carcinoma and hemoperitoneum manifested as acute abdomen in the emergency room[J]. World J Surg, 2012, 36(11): 2670-2676. DOI:10.1007/s00268-012-1734-6 |
| [4] |
ZHANG W, ZHANG ZW, ZHANG BX, et al. Outcomes and prognostic factors of spontaneously ruptured hepatocellular carcinoma[J]. J Gastrointest Surg, 2019, 23(9): 1788-1800. DOI:10.1007/s11605-018-3930-7 |
| [5] |
CHEN WQ, ZHENG RS, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [6] |
UCHIYAMA H, MINAGAWA R, ITOH S, et al. Favorable outcomes of hepatectomy for ruptured hepatocellular carcinoma:retrospective analysis of primary R0-hepatectomized patients[J]. Anticancer Res, 2016, 36(1): 379-385. |
| [7] |
YANG T, SUN YF, ZHANG J, et al. Partial hepatectomy for ruptured hepatocellular carcinoma[J]. Br J Surg, 2013, 100(8): 1071-1079. DOI:10.1002/bjs.9167 |
| [8] |
LI J, HUANG L, LIU CF, et al. Risk factors and surgical outcomes for spontaneous rupture of BCLC stages A and B hepatocellular carcinoma:a case-control study[J]. World J Gastroenterol, 2014, 20(27): 9121-9127. DOI:10.3748/wjg.v20.i27.9121 |
| [9] |
TANAKA S, KAIBORI M, UENO M, et al. Surgical outcomes for the ruptured hepatocellular carcinoma:multicenter analysis with a case-controlled study[J]. J Gastrointest Surg, 2016, 20(12): 2021-2034. DOI:10.1007/s11605-016-3280-2 |
| [10] |
MATSUMOTO T, CHUNG H, SUGINOSHITA Y, et al. Outcomes and prognostic factors in patients with spontaneously ruptured hepatocellular carcinoma[J]. Hepatogastroenterology, 2015, 62(140): 942-946. |
| [11] |
ZHOU C, ZU QQ, WANG B, et al. Efficacy and prognostic factors of transarterial embolization as initial treatment for spontaneously ruptured hepatocellular carcinoma:a single-center retrospective analysis in 57 patients[J]. Jpn J Radiol, 2019, 37(3): 255-263. DOI:10.1007/s11604-018-0799-z |
| [12] |
徐爱兵, 张卫华, 田思源, 等. 急诊肝动脉化疗栓塞治疗原发性肝癌破裂出血诊治体会[J]. 肿瘤基础与临床, 2013, 26(5): 395-397. |
| [13] |
SHINMURA K, CHOI YH, SHIMOHIRA M, et al. Comparison of conservative treatment versus transcatheter arterial embolisation for the treatment of spontaneously ruptured hepatocellular carcinoma[J]. Pol J Radiol, 2018, 83: e311-e318. DOI:10.5114/pjr.2018.77024 |
| [14] |
汪建成, 梁彩云, 邹晓媚, 等. 原发性肝癌自发性破裂出血的介入动脉栓塞治疗[J]. 现代肿瘤医学, 2016, 24(5): 768-770. DOI:10.3969/j.issn.1672-4992.2016.05.025 |
 2020, Vol. 49
2020, Vol. 49




