文章信息
- 陈海英, 刘雨琪
- CHEN Haiying, LIU Yuqi
- 雌二醇和同型半胱氨酸对人脐静脉内皮细胞增殖和凋亡的影响
- Effect of estradiol and homocysteine on proliferation and apoptosis of human umbilical vein endothelial cells
- 中国医科大学学报, 2020, 49(5): 429-432, 436
- Journal of China Medical University, 2020, 49(5): 429-432, 436
-
文章历史
- 收稿日期:2019-06-13
- 网络出版时间:2020-05-07 9:45
深静脉血栓形成是由于血液在深静脉内不正常凝结导致的静脉回流障碍性疾病,常常在下肢发生[1]。血栓形成后,除少数能自行消融或局限于发生部位外,大部分会扩散至整个肢体的深静脉主干,若不及时诊断和处理,多数会演变为血栓,形成后遗症,长时间影响患者的生活质量。还有一些患者可能并发肺栓塞,造成极为严重的后果。妊娠期纤溶凝血系统特殊的生理性改变,可以减少分娩后胎盘剥离面出血和裂伤处出血,但同时也增加了动静脉血栓形成的机会[2]。妊娠期女性发生静脉血栓的风险是同龄女性的5倍,是导致孕产妇死亡的主要原因之一[3]。
很多研究[4]证实,高同型半胱氨酸血症(hyper- homocystinemia,HHcy)是动静脉血栓形成的独立危险因素,HHcy也与多种不良妊娠结局关系密切,如流产、子痫前期、胎儿宫内发育受限等,但HHcy是否与妊娠期静脉血栓形成有关却罕有报道。而且大量研究[5-6]证实了雌二醇(estradiol,E2)具有抑制血管内皮细胞凋亡和促进血管内皮细胞增殖的作用,对血管内皮细胞来说是保护性因子。E2是否与妊娠期静脉血栓形成有关未见报道。本课题组前期研究[7]发现,妊娠期静脉血栓患者血清E2水平下降而同型半胱氨酸(homocystinemia,Hcy)水平升高,推测E2和Hcy与妊娠期静脉血栓形成有关,但其具体机制仍需进一步研究[7]。WILMANNS等[8]发现,亚甲基四氢叶酸还原酶(5,10-methylenetetrahydrofolate reductase,MTHFR)的基因多态性与深静脉血栓患者血清Hcy水平相关,推测Hcy促进静脉血栓形成的原因可能与MTHFR有关。
本研究通过观察E2与Hcy对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)增殖和凋亡的影响,探讨E2与Hcy是否为妊娠期静脉血栓形成的保护因素与危险因素;通过检测Hcy代谢关键酶MTHFR的表达,探讨E2对Hcy的可能调控机制。
1 材料与方法 1.1 细胞与试剂HUVEC购自中国科学院上海生命科学研究院细胞资源中心,RPMI 1640培养基购自美国Hyclone公司,E2和Hcy购自美国Sigma公司,Annexin Ⅴ-FITC/PI双染凋亡试剂盒和CCK-8试剂盒购自中国凯基公司,RNA提取试剂盒、SYBR实时定量试剂盒和反转录试剂盒购自日本TaKaRa公司。
1.2 HUVEC的培养HUVEC培养基是含10%胎牛血清的RPMI 1640,培养条件为37 ℃、5% CO2,适时换液传代。
1.3 CCK-8法检测HUVEC增殖能力将细胞分为对照组、E2组(E2浓度分为1×10-9、1×10-8、1×10-7、1×10-6 μmol/L),Hcy组(Hcy浓度分为1×10-5、3×10-5、6×10-5、1×10-4 μmol/L)。调整HUVEC浓度为1×104/mL,接种于96孔板,每孔接种量是100 μl,加入相应处理因素至目标浓度。CCK-8法检测时间点分别是24、48、72 h,加入10 μl CCK-8,继续培养4 h后应用酶标仪490 nm波长检测光密度值。选取E2和Hcy作用的最适浓度,分为对照组、E2组、Hcy组和E2+Hcy组,再次应用CCK-8法检测培养24、48和72 h细胞的增殖能力。
1.4 AnnexinⅤ-FITC/PI双染流式细胞术检测HUVEC凋亡应用E2和Hcy培养各组细胞72 h(与1.3中的分组和最适浓度相同),收集细胞,调整细胞浓度为1×106/mL。应用冷PBS吹打后,离心细胞2遍,应用缓冲液重新悬置细胞。取出细胞悬液500 μL,分别加入5 μL AnnexinⅤ-FITC和5 μL碘化丙啶,于4 ℃中避光孵育细胞30 min,最后应用流式细胞仪检测细胞凋亡率。
1.5 实时定量PCR检测HUVEC中MTHFR mRNA表达应用E2和Hcy培养各组HUVEC 72 h(与1.3中的分组和最适浓度相同)。应用Traziol提取总mRNA。根据反转录试剂盒说明,RNA反转录合成cDNA的条件是37 ℃ 15 min;85 ℃ 5 s。反应体系为12.5 μL SYBR Premix EaqTMⅡ(2×)、1 μL PCR Forward Primer(10 μmol/L)、1 μL PCR Reverse Primer(10 μmol/L)、2 μL模板cDNA、dH2O(灭菌蒸馏水),反应总体积共25 μL。实时定量PCR扩增反应条件是95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 30 s,40个循环;95 ℃ 15 s,60 ℃ 30 s,1个循环。MTHFR上游引物:5’-TGAAGGAGAAGGTGTCTGCGGGA-3’,下游引物:5’-AGGACGGTGCGGTGAGAGTG-3’。
1.6 Western blotting检测HUVEC中MTHFR蛋白表达应用E2和Hcy培养各组HUVEC 72 h(与1.3中的分组和最适浓度相同)。细胞加细胞裂解缓冲液(cat#P0013,中国Beyotime公司)破碎后提取蛋白,应用BCA蛋白质测定法(中国Beyotime公司)检测蛋白质浓度。取30 μg蛋白,使用10% Tris-甘氨酸凝胶的SDS-PAGE分离。将分离的蛋白质转移到聚偏二氟乙烯膜(美国Millipore公司)上,在室温下用5%脱脂牛奶封闭。应用鼠抗人MTHFR(1:2 000,美国Abcam公司)一抗4 ℃过夜,用HRP标记的抗鼠二抗(1:10 000,中国Vazyme公司)和增强化学发光(美国Millipore公司)显色。使用ImageJ软件进行光密度分析。应用GAPDH(1:5 000,美国Abcam公司)做对照,进行半定量分析。
1.7 统计学分析应用SPSS 13.0软件对所有数据进行统计分析,计量资料用x±s表示,采用t检验进行比较,计数资料采用方差分析进行比较,P < 0.05为差异有统计学意义。
2 结果 2.1 HUVEC的增殖能力E2可以促进HUVEC增殖,在1×10-8 μmol/L浓度下作用72 h时效果最明显,与对照组及24 h比较差异均有统计学意义(P < 0.05)。Hcy能使HUVEC增殖减慢,在1×10-4 μmol/L浓度下作用72 h时抑制增殖作用最明显,与对照组及24 h比较差异均有统计学意义(P < 0.05)。见表 1。
| Group | 24 h | 48 h | 72 h |
| Control | 0.54±0.04 | 0.63±0.05 | 0.78±0.052) |
| E2(μmol/L) | |||
| 1×10-9 | 0.59±0.09 | 0.65±0.09 | 0.98±0.072) |
| 1×10-8 | 0.63±0.021) | 0.99±0.071),2) | 1.12±0.061),2) |
| 1×10-7 | 0.59±0.03 | 0.78±0.06 | 0.99±0.021),2) |
| 1×10-6 | 0.56±0.01 | 0.76±0.06 | 0.87±0.012) |
| Hcy(μmol/L) | |||
| 1×10-5 | 0.57±0.03 | 0.66±0.02 | 0.74±0.042) |
| 3×10-5 | 0.56±0.02 | 0.65±0.02 | 0.70±0.011) |
| 6×10-5 | 0.54±0.01 | 0.61±0.01 | 0.71±0.032) |
| 1×10-4 | 0.47±0.011) | 0.53±0.011) | 0.62±0.031),2) |
| 1) P < 0.05 vs control group at the same time point; 2) P < 0.05 vs 24 h within group. | |||
将E2与Hcy以最适浓度共同加入到细胞中,分为对照组、E2(1×10-8 μmol/L)组、Hcy(1×10-4 μmol/L)组和E2(1×10-8 μmol/L)+Hcy(1×10-4 μmol/L)组。结果发现,E2+Hcy组与Hcy组相比,24、48、72 h时细胞增殖明显增多,差异有统计学意义(P < 0.05)。见表 2。
| Group | 24 h | 48 h | 72 h |
| Control | 0.511 1±0.033 23 | 0.626 7±0.045 09 | 0.766 7±0.041 63 |
| E2 | 0.603 3±0.030 551) | 0.690 0±0.045 09 | 1.076 7±0.051 321) |
| Hcy | 0.473 3±0.047 66 | 0.510 0±0.020 051) | 0.621 1±0.026 461) |
| E2+Hcy | 0.580 0±0.040 102) | 0.650 0±0.020 042) | 0.726 7±0.035 122) |
| 1) P < 0.05 vs control group at the same time point; 2) P < 0.05 vs Hey group at the same time point. | |||
2.2 各组细胞凋亡率
流式细胞术检测各组细胞凋亡情况,凋亡率对照组为(1.59±0.07)%,1×10-9 μmol/L E2组为(1.67±0.23)%,1×10-8 μmol/L E2组为(0.98±0.03)%,1×10-7 μmol/L E2组为(1.23±0.05)%,3×10-5 μmol/LHcy组为(6.22±0.40)%,6×10-5 μmol/L Hcy组为(10.64±0.78)%,1×10-4 μmol/L Hcy组为(16.79±1.01)%。E2组与对照组相比HUVEC凋亡受到抑制,1×10-8 μmol/L E2组凋亡率明显低于对照组(P < 0.05)。Hcy组与对照组相比明显促进HUVEC凋亡,1×10-4 μmol/L Hcy组凋亡率明显高于对照组(P < 0.05)。最适浓度E2(1×10-8 μmol/L)和Hcy(1×10-4 μmol/L)共同作用于HUVEC,凋亡率为(1.06±0.06)%,与Hcy组相比,能够抑制Hcy诱导的HUVEC凋亡。见图 1。
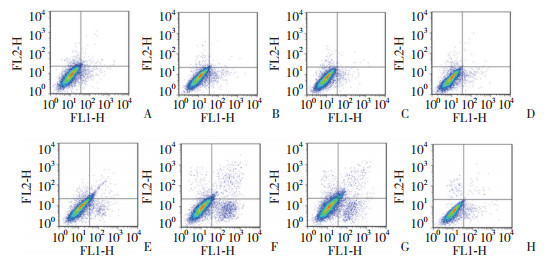
|
| A,control group;B,1×10-9 μmol/L E2 group;C,1×10-8 μmol/L E2 group;D,1×10-7 μmol/L E2 group;E,3×10-5 μmol/L Hcy group;F,6×10-5 μmol/L Hcy group;G,1×10-4 μmol/L Hcy group;H,1×10-8 μmol/L E2+1×10-4 μmol/L Hcy group. 图 1 流式细胞术检测各组细胞凋亡率 Fig.1 Apoptosis rate detected by flow cytometry |
2.3 HUVEC中MTHFR mRNA表达
与对照组相比,E2组、Hcy组、E2+Hcy组MTHFR mRNA的相对表达分别为1.85±0.045、1.01±0.011、1.76±0.023,E2组、E2+Hcy组表达明显升高(P < 0.05),Hcy组无明显变化。
2.4 HUVEC中MTHFR蛋白表达Western blotting结果显示,与对照组相比,E2组、Hcy组、E2+Hcy组MTHFR的相对表达分别为1.43±0.023、1.03±0.012、1.42±0.018,E2组、E2+Hcy组表达明显升高(P < 0.05),Hcy组无明显变化。见图 2。
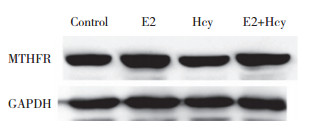
|
| 图 2 Western blotting检测HUVEC中MTHFR蛋白的表达 Fig.2 Expression of MTHFR protein in HUVECs detected by Westem blotting |
3 讨论
血管内皮细胞为衬覆于血管内腔面的单层扁平细胞,增殖和凋亡平衡是其保持自身正常结构和功能的基础。内皮细胞的凋亡过度或增殖不足,导致血管壁受损,可以促进血小板的黏附和血栓的形成,这是引起血栓的一个重要原因。妊娠期血流停滞、血液高凝状态和血管壁损伤是妊娠期深静脉血栓形成的主要原因,所以研究血管内皮细胞增殖和凋亡的平衡,有助于揭示妊娠期静脉血栓形成的原因,进而提供有效防治妊娠期静脉血栓靶点的理论依据。
Hcy是在蛋氨酸代谢过程中产生的含硫氨基酸。已在多种疾病中观察到Hcy水平升高,如心血管疾病、动脉粥样硬化、心肌梗死、中风、最小认知障碍、痴呆、帕金森病、多发性硬化、癫痫和子痫。HHcy对血管和神经系统都有直接的毒性作用。近年来大量的研究已经证实,Hcy代谢异常是血液高凝状态形成的重要原因之一,是动静脉栓塞性疾病的独立危险因素。HHcy导致血栓形成的具体致病机制尚不完全清楚,目前医学界比较公认的几个机制是:破坏血管内皮,激活血小板,活化凝血因子,抑制抗凝系统,破坏纤溶系统。欧三桃等[9]发现,S-腺苷Hcy可以抑制大鼠主动脉内皮细胞的增殖并促进其凋亡,进而导致内皮细胞功能异常。本课题组前期研究[7]也证实,妊娠期静脉血栓的患者血液中Hcy水平明显高于正常孕妇,推测HHcy通过促进血管内皮细胞凋亡抑制增殖,达到促进妊娠期静脉血栓形成的作用。本研究证实了高Hcy能够促进HUVEC凋亡,并抑制其增殖。
在生理条件下,Hcy浓度在正常妊娠期间下降[10]。妊娠期雌激素水平升高,推测作为血管保护因子,雌激素可能通过某种机制参与调控妊娠期血浆中Hcy的水平,防止妊娠期处于血栓前状态,进一步发展形成血栓。本研究发现,E2能够促进血管内皮细胞增殖,抑制血管内皮细胞凋亡。E2与Hcy共同作用于HUVEC与单独Hcy作用相比,可以明显促进细胞的增殖、抑制细胞的凋亡,说明E2可以有效抑制Hcy破坏血管内皮细胞功能的作用,达到防治深静脉血栓形成的目的。
MTHFR是体内叶酸代谢和Hcy甲基化的关键酶。本研究通过实时定量PCR检测各组细胞中MTHFR基因的表达情况。结果显示,E2可以上调HUVEC中MTHFR的表达,Hcy不增加MTHFR的表达,E2与Hcy共同作用同样使MTHFR的表达上调。因而推测,E2可能通过调节MTHFR的表达来发挥内皮细胞保护功能,抑制Hcy对脐静脉内皮细胞的促凋亡功能,但其具体机制还需进行深入研究。
| [1] |
邓华亚, 徐新, 张社兵. 深静脉血栓形成诊断研究进展[J]. 中国心血管病研究杂志, 2016, 14(8): 678-681. |
| [2] |
JAMES A, COMMITTEE ON PRACTICE BULLETINS-OBSTETRICS. Practice bulletin no. 123:thromboembolism in pregnancy[J]. Obstet Gynecol,, 2011, 118(3): 718-729. DOI:10.1097/AOG.0b013e3182310c4c |
| [3] |
DU XL, ZHUANG H, HONG L, et al. Long-term outcome of catheterdirected thrombolysis in pregnancy-related venous thrombosis[J]. Med Sci Monit, 2019, 25: 3771-3777. DOI:10.12659/MSM.914592 |
| [4] |
陈杰莹, 黄江佼, 阳海金, 等. 高同型半胱氨酸与深静脉血栓形成的相关研究[J]. 医学综述, 2010, 16(20): 3096-3098. |
| [5] |
王晶, 林国生, 李庚山. 雌激素与内皮细胞凋亡的关系[J]. 湖北医科大学学报, 2000, 21(4): 296-298. DOI:10.14188/j.1671-8852.2000.04.011 |
| [6] |
付晓东, 谈智, 李永勇, 等. 17β-雌二醇对血管内皮细胞增殖的影响[J]. 中山大学学报(医学科学版), 2003, 24(5): 417-420. |
| [7] |
陈海英, 孟涛. 妊娠期静脉血栓患者血清同型半胱氨酸和雌孕激素的测定及意义[J]. 解放军预防医学杂志, 2017, 35(6): 578-580. |
| [8] |
WILMANNS C, CASEY A, SCHINZEL H, et al. Superficial thrombophlebitis in varicose vein disease:the particular role of methylenetetrahydrofolate reductase[J]. Phlebology, 2011, 26(4): 135-139. DOI:10.1258/phleb.2009.009075 |
| [9] |
欧三桃, 柳飞, 刘琦, 等. S-腺苷同型半胱氨酸对大鼠主动脉内皮细胞增殖及凋亡的影响[J]. 基础医学与临床, 2010, 30(10): 1037-1040. |
| [10] |
ANSARI R, MAHTA A, MALLACK E, et al. Hyperhomocysteinemia and neurologic disorders:a review[J]. J Clin Neurol, 2014, 10(4): 281-288. DOI:10.3988/jcn.2014.10.4.281 |
 2020, Vol. 49
2020, Vol. 49