文章信息
- 侯阿娜, 曲双双, 富建华
- HOU Ana, QU Shuangshuang, FU Jianhua
- 缺氧缺血致脑室周围白质软化新生大鼠连接蛋白47表达及其对少突胶质细胞髓鞘化的影响
- Expression of connexin 47 and its effects on the myelination of oligodendrocytes in hypoxia-ischemia-induced periventricular leukomalacia in newborn rats
- 中国医科大学学报, 2020, 49(4): 306-312
- Journal of China Medical University, 2020, 49(4): 306-312
-
文章历史
- 收稿日期:2019-02-28
- 网络出版时间:2020-04-16 9:56
2. 北部战区总医院儿科, 沈阳 110016
2. Department of Pediatrics, General Hospital of Northern Theater Command, Shenyang 110016, China
近年来,极低和超低出生体质量婴儿的存活率明显提高,但随之而来的脑室周围白质软化(periventricular leukomalacia,PVL)发病率居高不下[1]。PVL作为早产儿脑白质损伤的最严重形式,已成为影响低出生体质量婴儿日后生存质量的主要疾病。我国研究[2]结果显示早产儿PVL发生率为8%~26%,在极低出生体质量婴儿中PVL发生率为5%~17%,其中74.2%以上发生脑瘫。PVL的病因较为复杂,目前研究[3-6]认为与缺氧缺血(hypoxia ischemia,HI)、全身感染和炎症反应、小胶质细胞活化、兴奋性毒性、自由基损害以及大脑白质少突胶质细胞(oligodendrocytes,OLs)自身的发育易损性等有关。而HI始终被认为是其发病的主要原因,其病理学基础为OLs弥漫性损伤伴髓鞘形成障碍[7-8]。
连接蛋白47(connexin 47,Cx47)是缝隙连接蛋白家族的一员,可通过缝隙连接通道直接介导细胞间缝隙连接通道(gap junctional intercellular communication,GJIC),参与并影响细胞死亡过程[9]。Cx47被证实可形成Cx47/Cx47和Cx47/Cx43等功能性缝隙连接,促使细胞间营养物质、离子、第二信使及小分子(约1×103)等通过,在中枢神经系统髓鞘的形成和损伤修复中起到关键的作用[10]。Cx47缺乏可引起遗传性脱髓鞘疾病[11-13]。PARENTI等[12]通过实验证实Cx47广泛存在于OLs和髓鞘当中,既在髓鞘形成早期的发展过程中,也参与新髓鞘的形成,且在脱髓鞘后髓鞘再生的恢复阶段表达被上调。由于PVL的晚期病理结局主要为OLs弥漫性损伤伴髓鞘形成障碍,Cx47是否参与此阶段的髓鞘损伤及修复,目前尚不清楚。因此,本研究在建立HI致PVL模型的基础上,动态监测Cx47的表达变化,旨在阐明Cx47是否与PVL髓鞘的损伤及修复相关。
1 材料与方法 1.1 实验动物及模型制备健康清洁级3日龄SD大鼠120只(中国医科大学附属盛京医院实验中心提供),随机均分为HI组(n = 60)、对照组(n = 60),雌雄不限。按本课题组以往PVL动物模型建立方法[14],将3日龄SD大鼠吸入性乙醚麻醉,仰卧位显微镜下固定,碘伏消毒后,在颈部紧贴气管右侧切纵形切口(0.5~1.0 cm),分离并用7/0一次性缝合线结扎右侧颈总动脉,在结扎的两端之间将动脉剪断,防止结扎线脱落缺血不彻底,缝合切口,表皮用生理盐水清洗干净(手术时间 < 5 min),术后将新生鼠放入恒温低氧箱2 h(92%氮气和8%氧气混合气体);然后返回母鼠身边饲养。对照组仅分离右侧颈总动脉,不结扎也不暴露于低氧中。
1.2 标本采集及制备2组分别于术后1、3、7、14 d处死大鼠,每个时间分别处死15只。乙醚吸入麻醉后,0.9%生理盐水左心室灌注,4%多聚甲醛溶液固定,断头取脑,以视交叉为中心前后2 mm取脑组织。分别用于HE染色、透射电镜分析、免疫组化和免疫荧光观察、Western blotting和实时PCR检测。
1.3 实验方法 1.3.1 HE染色观察脑组织形态取各时间点脑组织后,4%多聚甲醛固定、梯度乙醇脱水、浸蜡、包埋,连续冠状切片,片厚4.5 μm。二甲苯、乙醇梯度脱蜡后进行HE染色,每组各时间点随机抽取6张,每张切片光镜下(×400)随机选取5个脑室周围脑白质视野观察病理改变。
1.3.2 透射电镜观察OLs间缝隙连接超微结构对照组及HI组大鼠各2只,10%水合氯醛腹腔注射麻醉(3 mL/kg)后迅速断头取脑,选取脑组织右侧白质(1 mm3),置于2.5%戊二醛4 ℃保存。1%锇酸4 ℃下固定24 h后,用30%~100%浓度丙酮梯度脱水,环氧树脂包埋,超薄切片机切片(片厚约50 μm)。切片用醋酸双氧铀及硝酸铅双重染色后,在JEM-1200Ex透射电镜(日本Hitachi Electronic公司)下识别具有特殊超微结构特征的OLs及其缝隙连接,观察OLs间缝隙连接状态的超微结构。
1.3.3 免疫组化检测Cx47、髓鞘碱性蛋白(myelin basic protein,MBP)表达及定位脑组织石蜡切片常规脱蜡后,3%过氧化氢溶液室温处理20 min;标准柠檬酸缓冲液进行微波修复;山羊血清室温封闭30 min;滴加一抗(Cx47 1:200,兔抗大鼠抗体购自美国Santa Cruz公司;MBP 1:300稀释,兔抗大鼠抗体购自美国Abcam公司)4 ℃过夜;阴性对照以PBS替代一抗。0.01 mol/L PBS洗涤,滴加生物素标记的羊抗兔IgG(免疫组化试剂盒购自北京中杉金桥生物技术有限公司),37 ℃30 min;辣根过氧化物酶标记的链霉卵白素37 ℃30 min;DAB显色(北京中杉金桥生物技术公司),苏木精复染,乙醇脱水,二甲苯透明,中性树胶封片。利用美国Universal Imaging Porporation图像分析系统,应用MetaMorph软件,测定平均光强度以表示阳性产物的强度。同时采用连续切片方法双标Cx47及MBP,进而实现Cx47及MBP的共定位。
1.3.4 Western blotting测定Cx47、MBP蛋白表达水平按照文献[15]方法,取右侧脑组织50~80 mg,提取蛋白,并采用BCA法测定蛋白浓度。加入细胞裂解液及缓冲液,加热变性。各标本蛋白(20 μL)上样,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS -PAGE),转印,Tris盐酸缓冲液(TBST)漂洗,脱脂奶粉封闭2 h,TBST清洗3次,每次10 min,加一抗Cx47(1:800)、MBP(1:1 000),4 ℃过夜,阴性对照加TBST代替一抗。TBST洗3次,每次10 min,二抗(山羊抗兔1:2 000;山羊抗小鼠1:2 000购自北京中山金桥生物技术有限公司)工作浓度1:2 000室温孵育2 h,TBST洗膜3次,每次10 min,GAPDH做内参各组进行对比。最后进行化学发光(ECL kit;Santa Cruz Biotechnology)显色。结果用凝胶图像分析系统(Chemi Imager 5500 V2.03软件)进行吸光度扫描分析,并用图像分析系统(Fluor Chen 2.0软件)对扫描图像进行分析。脑组织内的蛋白用平均灰度值表示,蛋白灰度值越高表示蛋白含量越高。
1.3.5 实时PCR方法测定Cx47、MBP基因表达应用Trizol-丙酮沉淀法提取RNA,按TaKaRa反转录试剂盒说明反转录合成cDNA[15]。引物由上海生工公司设计并合成,见表 1。采用TaKaRa实时-染料法(20 μL体系)进行定量PCR扩增。Cx47 mRNA的相对表达量应用2-ΔΔCt法进行计算。
| Gene | Forward primer | Reverse primer |
| Cx47 | TGTACTGGTGGTCTTCCGCAT | CGTGTTGCAGGTGAACTTGG |
| MBP | AATCGGCTCACAAGGGATTCA | TCCTCCCAGCTTAAAGATTTTGG |
| β-actin | CCGTAAAGACCTCTATGCCAACA | GCTAGGAGCCAGGGCAGTAATC |
1.4 统计学分析
采用SPSS 17.0统计软件进行统计分析,数据采用x±s表示。2组比较采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 一般状态及行为改变对照组大鼠一般状态反应良好,吃奶好,肤色红润,生长发育迅速。而HI组逐渐出现状态反应差、周身循环不良、皮肤发绀、苍白等表现,随着低氧时间延长皮肤苍白逐渐加重,继而出现烦躁不安,激惹,有时可见四肢抽搐,最终出现嗜睡、大小便失禁等表现,恢复喂养后症状缓解。但随生长发育时间的延长,HI组出现明显活动减少、运动不协调、睁眼障碍及生长发育延迟等表现。
2.2 形态学变化光镜下,对照组脑组织形态结构正常,细胞分布均匀、排列紧密有序,细胞结构完整,核圆形、淡染,染色清晰,随着大鼠日龄的增加细胞逐渐成熟变大,细胞形态更加完整清晰(图 1A、1B、1C、1D)。HI组1 d脑白质内胶质细胞间隙增宽,细胞变形,排列紊乱,少量细胞出现核固缩(图 1E),手术后3 d胶质细胞大量坏死,并伴有脑白质广泛结构疏松、紊乱,可呈筛网状坏死,形成空洞等(图 1F)。与手术后3 d比较,手术后7、14 d溶解坏死细胞逐渐修复,脑白质病变及坏死区域明显减轻,筛网状损伤基本消失,取而代之的是条索状、点状及囊性坏死,最终形成软化灶(图 1G、1H)。
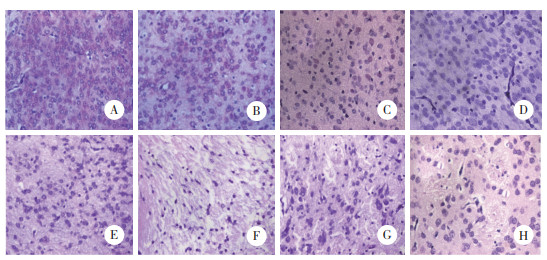
|
| A-D, control group 1 d, 3 d, 7 d, 14 d; E-H, HI group 1 d, 3 d, 7 d, 14 d. 图 1 各组脑组织形态学改变HE× 400 Fig.1 Morphological changes in brain tissue in each group HE× 400 |
2.3 脑组织缝隙连接超微结构变化
对照组可见到OLs形态结构完整,细胞膜及核膜明显,胞核大而清晰,核内染色质丰富且分布均匀。OLs通过致密的缝隙连接直接相连(图 2A)。与对照组比较,HI组OLs形态极其不规则,结构明显异常,随损伤加重大量细胞溶解坏死,细胞核结构甚至消失,核染色质浓缩、异染,细胞间缝隙连接断裂不连续(图 2B)。

|
| A, control group; B, HI group. The arrow shows the intercellular gap junctions. 图 2 透射电镜下观察HI对少突胶质细胞间缝隙连接通道的影响× 8 000 Fig.2 The effect of HI on oligodendrocyte gap junctions observed under a transmission electron microscope × 8 000 |
2.4 免疫组化检测脑组织内蛋白的表达 2.4.1 免疫组化检测脑组织内Cx47的表达
对照组手术后1 d Cx47在脑组织中即有表达,并随日龄增加染色呈大量棕黄色(图 3A、3B、3C、3D),随着日龄增加Cx47表达量也增加;HI组手术后1、3、7、14 d脑组织中Cx47表达虽呈上升趋势,但相同时间点的表达均较对照组明显减少。手术后3、7 d Cx47的表达减少尤为明显(图 3F、3G);而在14 d 2组Cx47表达差异开始缩小(图 3H)。

|
| A-D, control group 1 d, 3 d, 7 d, 14 d; E-H, HI group 1 d, 3 d, 7 d, 14 d. 图 3 免疫组化检测脑组织内Cx47的表达× 200 Fig.3 Immunohistochemical analysis of Cx47 expression in brain tissue × 200 |
2.4.2 免疫组化MBP的定位及表达
对照组及HI组手术后1 d脑室周围白质MBP阳性细胞表达较少,随着日龄的增加其表达升高。14 d时MBP广泛表达于OLs胞质及轴突突起上,半定量结果显示HI组MBP的表达较对照组降低,差异具有统计学意义(P < 0.05)。对照组手术后1、14 d脑组织MBP表达随着日龄增加而增加,由1 d的胞质表达到14 d的广泛细胞间隙突起的表达。HI组MBP的表达趋势与对照组相同,但相同时间点较对照组表达降低,HI组细胞突起明显减少。见图 4。
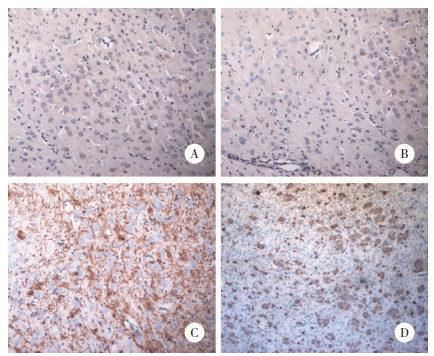
|
| A, control group 1 d; B, HI group 1 d; C, control group 14 d; D, HI group14 d. 图 4 免疫组化定位MBP的表达× 200 Fig.4 Immunohistochemical detection of MBP expression × 200 |
2.5 新生大鼠脑组织中Cx47蛋白表达(表 2、图 5)
通过Western blotting检测脑组织中Cx47的蛋白表达水平,发现Cx47蛋白表达在对照组及HI组均随着日龄的增长逐步增加(P < 0.01)。但2组间比较,HI组手术后3、7、14 dCx47蛋白水平较对照组明显减少(P < 0.01)。
| Group | Cx 47 protein expression after surgery | Cx 47 mRNA expression after surgery | ||||||
| 1 d | 3 d | 7 d | 14 d | 1 d | 3 d | 7 d | 14 d | |
| Control | 1.65±0.43 | 4.18±0.51 | 10.02±0.41 | 15.25±0.51 | 0.36±0.05 | 0.52±0.11 | 0.82±0.17 | 0.98±0.19 |
| HI | 1.09±0.311) | 1.96±0.442) | 4.62±0.592) | 11.79±0.352) | 0.27±0.021) | 0.34±0.042) | 0.47±0.042) | 0.72±0.092) |
| 1) P < 0.05 vs control group; 2) P < 0.01 vs control group. | ||||||||
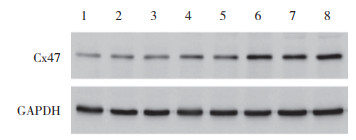
|
| 1, 3, 5, 7, 1 d, 3 d, 7 d, 14 d after operation in HI group; 2, 4, 6, 8, 1 d, 3 d, 7 d, 14 d after operation in control group. 图 5 各组手术后脑组织Cx47蛋白表达 Fig.5 Expression of Cx47 protein in brain tissue after surgery |
2.6 脑组织Cx47基因表达水平
实时PCR检测脑组织Cx47 mRNA表达水平,发现对照组和HI组在术后第1天即出现Cx47 mRNA表达,并随着日龄增加Cx47 mRNA水平逐渐增加(P < 0.01)。对照组Cx47 mRNA出现高表达先快后慢,直到术后14 d达到高峰(P < 0.01)。2组间比较,HI组Cx47 mRNA的表达水平在1、3、7、14 d均较对照组明显降低(均P < 0.01)。见表 2。
3 讨论OLs的主要功能是包绕轴突、形成绝缘的髓鞘结构、协助神经电信号的跳跃式高效传递,维持和保护神经元的正常功能。而PVL的主要病理改变就是OLs的弥漫性损伤伴髓鞘形成障碍[12],OLs对HI高度敏感,HI时未成熟OLs易受到氧化应激等损伤,导致其坏死以及成熟分化障碍。损伤后的OLs不能包裹轴突形成髓鞘,进而导致PVL的发生[7, 17]。
缝隙连接可以直接连接相互耦联细胞的胞质,参与细胞间物质、能量交换和信息传递[12, 18]。近几年来CJIC作为新兴的膜蛋白通道被广泛关注,在脊椎动物中几乎所有分化细胞都是通过缝隙连接来交流的,包括血红细胞、精子、成人骨骼肌、心肌、平滑肌细胞、胃肠道上皮细胞、脑神经细胞等[19]。中枢神经系统的多种疾病(脱髓鞘疾病、癫痫、胶质瘤、脑缺血缺氧性损伤等)均证实与GJIC有关[20]。缝隙连接蛋白是由多基因家族编码的一大类膜蛋白,在哺乳动物中发现有15种。其中Cx47表达于少突胶质细胞的髓鞘,Cx47基因突变会引起MBP的表达降低,从而导致脑白质异常损伤的脱髓鞘疾病[13, 21]。
本研究结果表明,新生大鼠受到HI损伤后会出现行为、运动、发育等方面的异常表现。大脑组织病理显示随着损伤的加重脑组织出现细胞凋亡坏死,脑组织筛网状及空洞形成,进而形成软化。在透射电镜下看到正常脑组织OLs间缝隙连接呈现连续致密的连接,细胞间通道关闭状态,而受到HI损伤后OLs间呈间断不连续的缝隙连接。与对照组比较,HI组脑组织中Cx47表达从术后1 d开始较对照组减少,2组间差异随HI时间延长而更加明显。同时免疫组化检测发现HI组脑组织中MDP表达也较对照组减少。Cx47广泛存在于OLs和髓鞘中,在髓鞘形成早期的发展过程中参与新髓鞘的形成[12],HI后脑组织中Cx47表达下降与OLs及髓鞘损伤一致,甚至比髓鞘损伤出现更早,这表明在HI致新生大鼠PVL中Cx47的表达下调可能引起OLs的损伤及髓鞘化障碍,从而导致髓鞘的发育延迟。
综上所述,HI条件下新生大鼠髓鞘发育成熟障碍,OLs间缝隙连接开放,脑组织中Cx47表达减少,提示Cx47可能对GJIC功能起到调控作用,并影响髓鞘发育。其具体作用机制有待进一步探索,并可能成为PVL治疗的新靶点。
| [1] |
ROMERO-GUZMAN GJ, LOPEZ-MUNOZ F. Prevalence and risk factors for periventricular leukomalacia in preterm infants. A systematic review[J]. Rev Neurol, 2017, 65(2): 57-62. |
| [2] |
WANG LW, LIN YC, TU YF, et al. Isolated cystic periventricular leukomalacia differs from cystic periventricular leukomalacia with intraventricular hemorrhage in prevalence, risk factors and outcomes in preterm infants[J]. Neonatology, 2017, 111(1): 86-92. DOI:10.1159/000448615 |
| [3] |
HUANG JC, ZHANG L, KANG BY, et al. Association between perinatal hypoxic-ischemia and periventricular leukomalacia in preterm infants:A systematic review and meta-analysis[J]. PLoS One, 2017, 12(9): e0184993. DOI:10.1371/journal.pone.0184993 |
| [4] |
JUNG EY, PARK KH, HAN BR, et al. Amniotic fluid infection, cytokine levels, and mortality and adverse pulmonary, intestinal, and neurologic outcomes in infants at 32 weeks' gestation or less[J]. J Korean Med Sci, 2017, 32(3): 480-487. DOI:10.3346/jkms.2017.32.3.480 |
| [5] |
TSIMIS ME, JOHNSON CT, RAGHUNATHAN RS, et al. Risk factors for periventricular white matter injury in very low birthweight neonates[J]. Am J Obstet Gynecol, 2016, 214(3): 380. DOI:10.1016/j.ajog.2015.09.108 |
| [6] |
BARATEIRO A, BRITES D, FERNANDES A. Oligodendrocyte development and myelination in neurodevelopment:molecular mechanisms in health and disease[J]. Curr Pharm Des, 2016, 22(6): 656-679. DOI:10.2174/1381612822666151204000636 |
| [7] |
VAN TILBORG E, DE THEIJE CGM, VAN HAL M, et al. Origin and dynamics of oligodendrocytes in the developing brain:Implications for perinatal white matter injury[J]. Glia, 2018, 66(2): 221-238. DOI:10.1002/glia.23256 |
| [8] |
FALAHATI S, BREU M, WAICKMAN AT, et al. Ischemia-induced neuroinflammation is associated with disrupted development of oligodendrocyte progenitors in a model of periventricular leukomalacia[J]. Dev Neurosci, 2013, 35(2/3): 182-196. DOI:10.1159/000346682 |
| [9] |
GILLERON J, CARETTE D, SEGRETAIN D, et al. Multiple and complex influences of connexins and pannexins on cell death[J]. Biochim Biophys Acta Biomembr, 2018, 1860(1): 182-191. DOI:10.1016/j.bbamem.2017.06.004 |
| [10] |
KIM TK, PARK D, BAN YH, et al. Improvement by human oligodendrocyte progenitor cells of neurobehavioral disorders in an experimental model of neonatal periventricular leukomalacia[J]. Cell Transplant, 2018, 27(7): 1168-1177. DOI:10.1177/0963689718781330 |
| [11] |
DAVIDSON JO, DRURY PP, GREEN CR, et al. Connexin hemichannel blockade is neuroprotective after asphyxia in preterm fetal sheep[J]. PLoS One, 2014, 9(5): e96558. DOI:10.1371/journal.pone.0096558 |
| [12] |
PARENTI R, CICIRATA F, ZAPPALÀ A, et al. Dynamic expression of Cx47 in mouse brain development and in the cuprizone model of myelin plasticity[J]. Glia, 2010, 58(13): 1594-1609. DOI:10.1002/glia.21032 |
| [13] |
TRESS O, MAGLIONE M, ZLOMUZICA A, et al. Pathologic and phenotypic alterations in a mouse expressing a connexin 47 missense mutation that causes Pelizaeus-Merzbacher-like disease in humans[J]. PLoS Genet, 2011, 7(7): e1002146. DOI:10.1371/journal.pgen.1002146 |
| [14] |
MIZUNO K, HIDA H, MASUDA T, et al. Pretreatment with low doses of erythropoietin ameliorates brain damage in periventricular leukomalacia by targeting late oligodendrocyte progenitors:a rat model[J]. Neonatology, 2008, 94: 255-266. DOI:10.1159/000151644 |
| [15] |
HOU AN, FU JH, SHI YY, et al. Decreased ZONAB expression promotes excessive transdifferentiation of alveolar epithelial cells in hyperoxia-induced bronchopulmonary dysplasia[J]. Int J Mol Med, 2018, 41(4): 2339-2349. DOI:10.3892/ijmm.2018.3413 |
| [16] |
SATO Y, ISHIDA-NAKAJIMA W, KAWAMURA M, et al. Hypoxia-ischemia induces hypo-phosphorylation of collapsin response mediator protein 2 in a neonatal rat model of periventricular leukomalacia[J]. Brain Res, 2011, 1386: 165-174. DOI:10.1016/j.brainres.2011.02.027 |
| [17] |
GALINSKY R, LEAR CA, DEAN JM, et al. Complex interactions between hypoxia-ischemia and inflammation in preterm brain injury[J]. Dev Med Child Neurol, 2018, 60(2): 126-133. DOI:10.1111/dmcn.13629 |
| [18] |
KIM MS, GLOOR GB, BAI DL. The distribution and functional properties of pelizaeus-merzbacher-like disease-linked Cx47 mutations on Cx47/Cx47 homotypic and Cx47/Cx43 heterotypic gap junctions[J]. Biochem J, 2013, 452(2): 249-258. DOI:10.1042/BJ20121821 |
| [19] |
BEYER EC, BERTHOUD VM. Gap junction gene and protein families:connexins, innexins, and pannexins[J]. Biochim Biophys Acta Biomembr, 2018, 1860(1): 5-8. DOI:10.1016/j.bbamem.2017.05.016 |
| [20] |
TALHOUK RS, ZEINIEH MP, MIKATI MA, et al. Gap junctional intercellular communication in hypoxia-ischemia-induced neuronal injury[J]. Prog Neurobiol, 2008, 84(1): 57-76. DOI:10.1016/j.pneurobio.2007.10.001 |
| [21] |
MALLARD C, DAVIDSON JO, TAN S, et al. Astrocytes and microglia in acute cerebral injury underlying cerebral palsy associated with preterm birth[J]. Pediatr Res, 2014, 75(1/2): 234-240. DOI:10.1038/pr.2013.188 |
 2020, Vol. 49
2020, Vol. 49




