文章信息
- 武楠, 王晓晓, 费然, 饶慧瑛, 魏来, 刘峰
- WU Nan, WANG Xiaoxiao, FEI Ran, RAO Huiying, WEI Lai, LIU Feng
- 幼鼠非酒精性脂肪性肝炎模型的建立及其肝纤维化特征的研究
- Methionine- and choline-deficient diet-induced juvenile nonalcoholic steatohepatitis mouse models and associated liver fibrosis features
- 中国医科大学学报, 2020, 49(3): 209-214
- Journal of China Medical University, 2020, 49(3): 209-214
-
文章历史
- 收稿日期:2019-12-03
- 网络出版时间:2020-03-17 10:50
2. 清华大学附属北京长庚医院肝胆胰中心, 北京 102218
2. Department of Hepatobiliary and Pancreatic Center, Beijing Tsinghua Changgung Hospital, School of Clinical Medicine, Tsinghua University, Beijing 102218, China
近年来, 儿童非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)的发病率逐年升高, 已成为全球共同关注的公共卫生问题之一[1-5]。中国儿童疑似NAFLD患病率为9.03% [5]。儿童脂肪肝不仅本身是一种潜在的进展性疾病, 而且可以同时或者在成年后并发多种严重疾病, 特别是糖尿病及心血管疾病, 严重威胁其当前和成年后的健康甚至生命[6-8]。因此, 必须早防早治, 避免脂肪肝向恶性结局进展。NAFLD疾病谱包括非酒精性单纯性脂肪肝(nonalcoholic fatty liver, NAFL)和非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)及其相关肝纤维化和肝硬化。但目前儿童NAFLD的发病机制仍不明确, 故迄今为止没有有效的药物治疗方案[9-12]。因此, 建立合适的动物模型对于研究儿童NAFLD的发病机制、改善诊断以及有效地预防和研究各种药物的治疗作用意义重大。
NAFLD动物模型主要有饲料诱导模型(高脂饮食等)、基因修饰型模型(PTEN缺陷小鼠模型等)、复合性模型(联合饮食和基因诱发模型等) [13-14]。饲料诱导的脂肪肝模型操作方法简便, 价格低廉, 重复性好, 死亡率低, 是国内外最常用的造模方法。但是目前以上这些营养模型仅在成年动物身上重现(最常见的喂养开始时间为6~8周龄), 对于幼龄小鼠的研究报道较少, 因此, 建立合适的动物模型对于研究儿童NAFLD/NASH的发病机制和新药研发意义重大。故本研究拟开发表征能够与儿童NASH发展背景的一致的幼年动物模型, 以期为研究儿童NAFLD/NASH提供合适的动物模型。同时, 本研究拟利用二次谐波(second harmonic generation, SHG) /双光子激发荧光(two photon excited fluorescence, TPEF)显微成像技术自动化评估幼鼠模型肝纤维化进程中胶原的变化特点。
1 材料与方法 1.1 材料3周龄、4周龄、5周龄和6周龄雄性C57BL/6小鼠, SPF级, 购自北京维通利华公司。蛋氨酸胆碱缺乏饲料(methionine- and choline-deficient diet, MCD)购自江苏美迪森公司, 普通饲料购自北京维通利华公司。HE染色和天狼猩红染色试剂盒购自北京益利精细化学品有限公司。本研究方案经由北京大学人民医院动物伦理委员会审批(批号:2018PHC026), 符合实验动物管理与使用准则。
1.2 动物分组及模型制备将3、4、5、6周龄小鼠随机分为MCD诱导组和正常饮食对照组。分别在造模0周、4周、6周和8周时处死动物(每个时间点6只), 留取血清及肝组织标本。
1.3 血清生化指标检测采用全自动生化分析仪测定肝功能指标血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)和天冬氨酸氨基转移酶(aspartate transaminase, AST)。
1.4 肝组织病理学用4%多聚甲醛固定肝组织, 经脱水、透明、石蜡包埋, 制组织切片(厚度4 μm)。常规行HE染色和天狼猩红染色。光学显微镜下观察肝组织学变化, 参照NASH临床研究网络(Clinical Research Network, CRN)分期[15], 将肝组织纤维化分为4期(S0~S4)。
1.5 肝组织胶原量化分析将组织切片脱蜡后, 使用SHG/TPEF显微成像设备(Genesis, 新加坡Histoindex公司)成像后, 软件自动提取并分析100个胶原蛋白参数(包括胶原总定量和不同分区的胶原, 如汇管区、中央静脉区和肝小叶)。以造模后不同时间点和不同纤维化分期为标准, 进一步采用支持向量机(support vector machine, SVM)算法对样本数据进行分析。
1.6 统计学分析采用SPSS 10.0软件绘制生存时间Kaplan-Meier曲线, 比较采用log-rank检验。计量资料以x±s表示, 多组间均数比较采用One-Way ANOVA检验。P < 0.05为差异有统计学意义。
2 结果 2.1 不同周龄小鼠MCD诱导后的一般状况正常饮食对照组不同周龄小鼠体质量逐渐升高; 而MCD诱导组不同周龄的小鼠体质量逐渐下降, 见图 1。随着喂养时间延长, 正常饮食对照组不同周龄小鼠无死亡, 而MCD诱导组小鼠死亡数量增加, 各周龄小鼠8周存活率不同, 其中3周龄组最低(37.5%), 4、5、6周龄组分别为62.5%、87.5%和87.5%, 差异有统计学意义(P < 0.05), 见图 2。

|
| 图 1 不同周龄小鼠MCD饮食和普通饮食后0~8周的体质量 Fig.1 Changes in the body weight of mice of different ages after administration of methionine- and choline-deficient (MCD) and normal diet |

|
| 图 2 不同周龄小鼠MCD饮食和普通饮食后的生存曲线 Fig.2 The survival curve of mice of different ages after administration of MCD diet and normal diet |
2.2 不同周龄小鼠MCD建模后相关生化学指标
与正常饮食对照组相比, 随着MCD诱导时间的延长, 3、4、5、6周龄MCD诱导组的小鼠ALT和AST水平均逐渐升高, 差异有统计学意义(P < 0.05), 见图 3。

|
| *P < 0.05 vs control group. 图 3 MCD或普通饮食0~8周后不同周龄小鼠的ALT和AST水平 Fig.3 The ALT and AST level of mice of different ages after administration of MCD diet and normal diet for 0 to 8 weeks |
2.3 不同周龄小鼠MCD诱导后肝组织病理学表现
正常饮食对照组小鼠肝组织结构正常, 偶有脂肪变。不同周龄MCD诱导组模型小鼠在MCD饮食4周时即可见肝内脂肪变和散在的炎症, 其中以3周龄组脂肪变和炎症明显, 并且随着造模时间的延长, 各组肝小叶内脂肪变和炎症逐渐加重。同时可见肝内胶原量逐渐增多, 肝纤维化进展, 见图 4。提示3~6周龄各组小鼠在MCD诱导8周后均出现NASH的病理特征。

|
| 图 4 不同周龄小鼠MCD建模不同时间点HE和天狼猩红染色图像×200 Fig.4 The HE and sirus red staining image of mice of different ages after administration of MCD diet at different weeks ×200 |
2.4 不同周龄小鼠MCD诱导后胶原参数特征
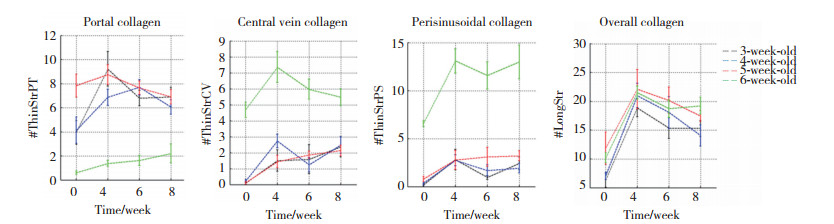
用SHG/TPEF显微成像技术分析肝组织内100个胶原参数, 包括16个胶原总特征、28个汇管区胶原特征、28个中央静脉区胶原特征、28个肝小叶内的肝窦周胶原特征。对MCD诱导后的不同时间点(0、4、6、8周)进行分析发现, 与6周龄组比较, 3、4、5周龄组小鼠肝脏胶原分布存在相似性, 汇管区胶原量明显高于6周龄组, 而中央静脉区和窦周胶原量明显低于6周龄组; 各组16个胶原总特征的指标无显著差异, 见图 5。
|
| 图 5 不同周龄小鼠MCD建模0、4、6、8周不同区域胶原分布特征 Fig.5 The collagen features of mice of different ages after administration of MCD diet for 0, 4, 6 and 8 weeks |
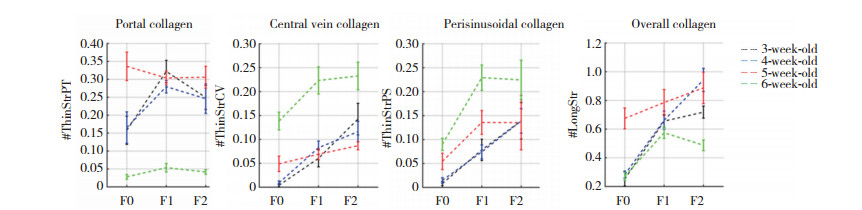
各组肝组织纤维化评分结果显示, 最大评分为2分, 3周龄组偶有3分, 同样, 随着纤维化分期加重, 3周龄、4周龄和5周龄组的胶原分布存在相似性, 汇管区的胶原量明显高于6周龄组, 而中央静脉区的胶原和窦周胶原量明显低于6周龄组; 各组16个胶原总特征的指标无显著差异, 见图 6。
|
| 图 6 不同周龄小鼠MCD建模不同纤维化分期的胶原分布特征 Fig.6 The collagen features of mice of different ages at different fibrosis stage after administration of MCD diet |
3 讨论
近年来, 儿童NAFLD患病率显著增高。建立合适的反映儿童NAFLD特征的动物模型, 对研究儿童NAFLD的发病机制、药物的筛选等有重要价值。MCD饮食所诱导的肝脏脂肪变性炎症及纤维化等组织病理特征与人类NASH相似, 是公认的NASH模型[11], 已广泛用于NASH发病机制的研究。本研究发现, 从离乳3周龄幼鼠到6周龄成鼠, MCD诱导后ALT和AST均升高, 肝损伤加重, 病理上均可观察到脂肪变、炎症和纤维化, 提示小鼠NASH模型建立成功。
研究[16-19]表明, SHG/TPEF显微成像技术可以对不同纤维化动物模型、慢性乙型肝炎、慢性丙型肝炎及NAFLD患者的肝脏组织内胶原成像和定量, 并可以对肝纤维化的胶原特征进行分析。本研究中进一步比较了MCD饮食诱导不同周龄小鼠NASH模型的纤维化情况, 发现3周龄、4周龄和5周龄幼鼠的MCD模型不同分期和不同时间点的肝纤维化变化有相似性, 其汇管区的胶原量明显高于6周龄组, 而中央静脉区的胶原和窦周胶原量明显低于6周龄组。SCHWIMMER等[20-23]将儿童NASH分为2种模式, 即1型(成人型)和2型(儿童型)。成人型NASH中, 脂肪变性、小叶炎症和窦周纤维化有关; 儿童型NASH中, 脂肪变性不局限于某一特定区域, 而是更广泛地分布, 且炎症和纤维化的主要部位在汇管区, 儿童型通常出现于儿童NASH患者。本研究中对3周龄、4周龄和5周龄幼鼠的纤维化分析结果与儿童型NASH纤维化类似, 以汇管区胶原改变为主; 6周龄小鼠的纤维化分析结果与成人NASH纤维化类似, 以窦周和中央静脉周纤维化为主。进一步从纤维化特征方面提示3周龄、4周龄和5周龄幼鼠适合建立儿童NASH模型。然而, 这些儿童和成人NASH的病理差异是否源于这2种类型发育过程中的特定机制尚不确定。
同时, 本研究中也观察到MCD饮食的的缺点是小鼠体质量下降, 3周龄组幼鼠MCD饮食至8周时, 存活率只有37.5%。提示如果要观察NASH进程及进行机制的分析, 需综合考虑存活率和病理特征。
综上所述, 本研究发现MCD诱导的3周龄、4周龄和5周龄幼鼠的病理特征与儿童型NASH类似, 可为儿童NAFLD的发病机制、诊疗和防治提供合适的动物模型。
致谢:感谢戴其尚和任亚运博士对文章的建设性的意见和指导。
| [1] |
YOUNOSSI Z, TACKE F, ARRESE M, et al. Global perspectives on nonalcoholic fatty liver disease and nonalcoholic steatohepatitis[J]. Hepatology, 2019, 69(6): 2672-2682. DOI:10.1002/hep.30251 |
| [2] |
NOBILI V, MANTOVANI A, CIANFARANI S, et al. Prevalence of prediabetes and diabetes in children and adolescents with biopsy-proven non-alcoholic fatty liver disease[J]. J Hepatol, 2019, 71(4): 802-810. DOI:10.1016/j.jhep.2019.06.023 |
| [3] |
BRAUN HA, FAASSE SA, VOS MB. Advances in pediatric fatty liver disease:pathogenesis, diagnosis, and treatment[J]. Gastroenterol Clin North Am, 2018, 47(4): 949-968. DOI:10.1016/j.gtc.2018.07.016 |
| [4] |
SMITH SK, PERITO ER. Nonalcoholic liver disease in children and adolescents[J]. Clin Liver Dis, 2018, 22(4): 723-733. DOI:10.1016/j.cld.2018.07.001 |
| [5] |
SONG PG, YU JY, WANG ML, et al. Prevalence and correlates of suspected nonalcoholic fatty liver disease in Chinese children[J]. Int J Environ Res Public Health, 2017, 14(5): E465. DOI:10.3390/ijerph14050465 |
| [6] |
KARJOO S. Is there an association of vascular disease and atherosclerosis in children and adolescents with obesity and non-alcoholic fatty liver disease?[J]. Front Pediatr, 2018, 6: 345. DOI:10.3389/fped.2018.00345 |
| [7] |
YAN YK, HOU DQ, ZHAO XY, et al. Childhood adiposity and nonalcoholic fatty liver disease in adulthood[J]. Pediatrics, 2017, 139(4): e20162738. DOI:10.1542/peds.2016-2738 |
| [8] |
NOBILI V, SOCHA P. Pediatric nonalcoholic fatty liver disease:current thinking[J]. J Pediatr Gastroenterol Nutr, 2018, 66(2): 188-192. DOI:10.1097/MPG.0000000000001823 |
| [9] |
FANG YL, CHEN H, WANG CL, et al. Pathogenesis of non-alcoholic fatty liver disease in children and adolescence:from "two hit theory" to "multiple hit model"[J]. World J Gastroenterol, 2018, 24(27): 2974-2983. DOI:10.3748/wjg.v24.i27.2974 |
| [10] |
NOBILI V, ALISI A, VALENTI L, et al. NAFLD in children:new genes, new diagnostic modalities and new drugs[J]. Nat Rev Gastroenterol Hepatol, 2019, 16(9): 517-530. DOI:10.1038/s41575-019-0169-z |
| [11] |
李婧, 戚伶俐, 吴捷. 儿童非酒精性脂肪性肝病的诊断进展[J]. 临床肝胆病杂志, 2017(10): 2025-2029. DOI:10.3969/j.issn.1001-5256.2017.10.038 |
| [12] |
李泽圣, 吴捷. 儿童非酒精性脂肪性肝病的治疗[J]. 临床肝胆病杂志, 2019, 35(4): 917-920. DOI:10.3969/j.issn.1001-5256.2019.04.047 |
| [13] |
黄海燕, 辛永宁, 姜曼, 等. 非酒精性脂肪性肝病动物实验模型研究进展[J]. 临床肝胆病杂志, 2014(9): 948-953. DOI:10.3969/j.issn.1001-5256.2014.09.028 |
| [14] |
IBRAHIM SH, HIRSOVA P, MALHI H, et al. Animal models of nonalcoholic steatohepatitis:eat, delete, and inflame[J]. Dig Dis Sci, 2016, 61(5): 1325-1336. DOI:10.1007/s10620-015-3977-1 |
| [15] |
KLEINER DE, BRUNT EM, VAN NATTA M, et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease[J]. Hepatology, 2005, 41(6): 1313-1321. DOI:10.1002/hep.20701 |
| [16] |
XU SY, WANG Y, TAI DCS, et al. QFibrosis:a fully-quantitative innovative method incorporating histological features to facilitate accurate fibrosis scoring in animal model and chronic hepatitis B patients[J]. J Hepatol, 2014, 61(2): 260-269. DOI:10.1016/j.jhep.2014.02.015 |
| [17] |
LIU F, CHEN L, RAO HY, et al. Automated evaluation of liver fibrosis in thioacetamide, carbon tetrachloride, and bile duct ligation rodent models using second-harmonic generation/two-photon excited fluorescence microscopy[J]. Lab Invest, 2017, 97(1): 84-92. DOI:10.1038/labinvest.2016.128 |
| [18] |
WANG Y, VINCENT R, YANG JL, et al. Dual-photon microscopy-based quantitation of fibrosis-related parameters(q-FP) to model disease progression in steatohepatitis[J]. Hepatology, 2017, 65(6): 1891-1903. DOI:10.1002/hep.29090 |
| [19] |
郑永见, 汪艳. 肝纤维化和肝硬化逆转的组织学评价[J]. 临床肝胆病杂志, 2019, 35(4): 709-713. DOI:10.3969/j.issn.1001-5256.2019.04.002 |
| [20] |
SCHWIMMER JB, BEHLING C, NEWBURY R, et al. Histopathology of pediatric nonalcoholic fatty liver disease[J]. Hepatology, 2005, 42(3): 641-649. DOI:10.1002/hep.20842 |
| [21] |
CRESPO M, LAPPE S, FELDSTEIN AE, et al. Similarities and differences between pediatric and adult nonalcoholic fatty liver disease[J]. Metabolism, 2016, 65(8): 1161-1171. DOI:10.1016/j.metabol.2016.01.008 |
| [22] |
李晓鹤, 魏来. 非酒精性脂肪性肝病的同质性和异质性[J]. 临床肝胆病杂志, 2018, 34(12): 2491-2494. DOI:10.3969/j.issn.1001-5256.2018.12.001 |
| [23] |
NOBILI V, ALISI A, NEWTON KP, et al. Comparison of the phenotype and approach to pediatric vs adult patients with nonalcoholic fatty liver disease[J]. Gastroenterology, 2016, 150(8): 1798-1810. DOI:10.1053/j.gastro.2016.03.009 |
 2020, Vol. 49
2020, Vol. 49