文章信息
- 李美璇, 董炳超, 王晓银, 程希, 赵传胜, 赵珊珊
- LI Meixuan, DONG Bingchao, WANG Xiaoyin, CHENG Xi, ZHAO Chuansheng, ZHAO Shanshan
- 强制性运动疗法对脑缺血大鼠认知功能的影响及其作用机制
- Effect of constraint-induced movement therapy on cognitive function in rats after cerebral ischemia and its mechanism of action
- 中国医科大学学报, 2020, 49(3): 203-208
- Journal of China Medical University, 2020, 49(3): 203-208
-
文章历史
- 收稿日期:2019-02-22
- 网络出版时间:2020-03-16 17:01
强制性运动疗法(constraint-induced movement therapy, CIMT)是在生活环境中一定程度上限制患者使用健侧的肢体, 从而强制其反复使用患肢的疗法。CIMT已被广泛地应用于康复领域, 并在临床试验中被证实能够有效地促进脑卒中后患者的肢体功能恢复[1-2]。前期脑缺血动物实验[3-6]发现, CIMT除了能够促进脑缺血后大鼠的运动功能恢复, 还能够显著地增加脑缺血后的神经再生与轴突再生, 并促进脑缺血后认知功能的恢复。目前对于CIMT改善脑缺血后大鼠认知功能的作用机制尚无相关研究报道。已有许多研究[7-10]表明, 沉默信息调节因子1 (silent information regulator 1, SIRT1)和脑源性神经营养因子(brain derived neurotrophic factor, BDNF)在改善脑缺血后认知功能方面具有重要的作用, 本研究通过检测CIMT对脑缺血后大鼠海马区域SIRT1及BDNF表达的影响来探讨其改善脑缺血后大鼠认知功能的作用机制。
1 材料与方法 1.1 实验动物、试剂及分组成年雄性Wistar大鼠(200~250 g)购自北京维通利华实验技术有限公司, 维持饲养环境室温25 ℃左右, 术前12 h禁食, 自由饮水。内皮素1 (endothelin-1, ET-1)购自美国Sigma公司; SIRT1以及BDNF抗体购自美国Abcam公司; Alexa 568、Alexa488免疫荧光二抗购自美国Invitrogen公司。将大鼠随机分为3组:假手术组(Sham组)、缺血组(ISC组)、缺血后给予CIMT组(ISC+CIMT组), 每组8只。
1.2 方法 1.2.1 大鼠局灶性脑缺血模型制备[5]参照大鼠脑解剖图谱, 使用立体定位仪将ET-1注射到大鼠大脑皮质运动区及纹状体区域以制作局灶性脑缺血模型。使用微量注射器将ET-1 (0.5 μL/min)注入以下3个位点[2 μL/点, 前囟为中心向侧方(mediolateral, ML)、前囟为中心向前方(anteroposterior, AP)、前囟为中心向下方(dorsoventral, DV)] [11], (1) AP=0.7 mm, ML=2.2 mm, DV= -2.0 mm; (2) AP=2.3 mm, ML=2.5 mm, DV= -2.3 mm; (3) AP=0.7 mm, ML=3.8 mm, DV= -5.8 mm。每个位点注射2次, 每次1 μL, 间隔1 min。每位点注射完毕将注射器针头在针道内停留3 min, 然后缓慢拔出。Sham组在相同的位点注射等量的生理盐水。注射ET-1大鼠清醒后, 若大鼠出现提尾倒悬时右上肢向胸前屈曲或行走时向右侧倾倒或者向右侧转圈, 且症状持续超过24 h, 则可判定为脑缺血模型制作成功。
1.2.2 大鼠脑缺血后CIMT模型:参照以往实验[5], 术后1周开始将大鼠上部躯干及梗死病灶同侧前肢紧靠胸骨置于自然回缩姿势, 采用石膏绷带进行固定, 以此来限制大鼠健侧前肢的活动, 建立CIMT模型, 持续3周。
1.2.3 免疫荧光染色采用免疫荧光染色方法检测海马齿状回(dentate gyrus, DG), CA1和CA3区SIRT1和BDNF的表达情况。冰冻切片(厚度10 μm)免疫荧光染色采用贴片法在室温下进行。切片先复温30 min, 后在丙酮内固定15 min, 固定结束在0.01 mol/L PBS浸洗后依次加入75%、85%、95%和100%乙醇各5 min水化。然后用0.01 mol/L PBS浸洗3次, 每次5 min。SIRT1冰冻切片在pH=6.0的柠檬酸盐修复液中高温高压修复2 min后冷却至室温。BDNF冰冻切片在pH9.0的Tris-EDTA修复液中加热, 直至修复液中出现气泡, 停止加热并计时5 min, 重复上述步骤3次。两种抗原修复后切片均在0.01 mol/L PBS浸洗3次, 每次5 min。之后用抗原封闭液(0.01 mol/L PBS, 0.4%Triton X-100和10%山羊血清)孵育50 min后加一抗(mouse anti-SIRT1抗体1:400;Rabbit anti-BDNF抗体1:400), 在抗体稀释液中4 ℃过夜。一抗过夜后0.01 mol/L PBS漂洗3次, 每次5 min, 荧光共轭二抗(Alexa Fluor 568 Goat anti-Mouse 1:200;Alexa Fluor 488 Goat anti-Rabbit 1:200)避光孵育2 h, 避光条件下用0.01 mol/L PBS漂洗3次, 每次5 min。DAPI孵育5 min后再用PBS避光漂洗3次, 每次5 min。最后使用抗荧光淬灭封片剂封片。
1.2.4 图像处理与分析采用激光共聚焦显微镜及其成像系统(日本Olympus, FV-1000)观测ISC组及ISC+CIMT组大鼠缺血侧以及Sham组大鼠注水侧的海马DG、CA1及CA3区SIRT1和BDNF的表达。同时对每只大鼠海马DG区、CA3区、CA1区随机选取的3个部位进行激光薄层扫描, 然后对Z轴系列图层进行三维重建。用NIH ImageJ软件对目标染色进行光密度值统计, 其光密度值代表SIRT1和BDNF的表达水平。
1.2.5 水迷宫实验[6]大鼠脑缺血术后31 d, 采用Morris水迷宫(淮北正华生物仪器设备有限公司)及图像分析系统(美国HVS Image公司)对大鼠进行认知功能测试。定位航行实验即分别从水迷宫4个象限的池壁中点将大鼠面向池壁放入水中, 记录大鼠在120 s内从入水到登上平台所需时间(逃避潜伏期)。每次任务的起点都要改变, 而且平台的位置每天都被更换, 连续进行3 d, 逃避潜伏期和大鼠找到平台前游泳的距离被用来评价水迷宫的成绩。最后1 d定位航行实验结束后将平台撤离进行空间探索实验, 记录目标象限60 s内大鼠穿越原来平台所在位置的次数及游泳轨迹。
1.3 统计学分析采用SPSS 23.0软件进行统计分析。计量资料采用x±s表示, 多组间比较采用单因素方差分析, 水迷宫逃避潜伏期采用重复测量方差分析, 两组间比较采用Post Hoc检验中LSD法, P < 0.05为差异有统计学意义。
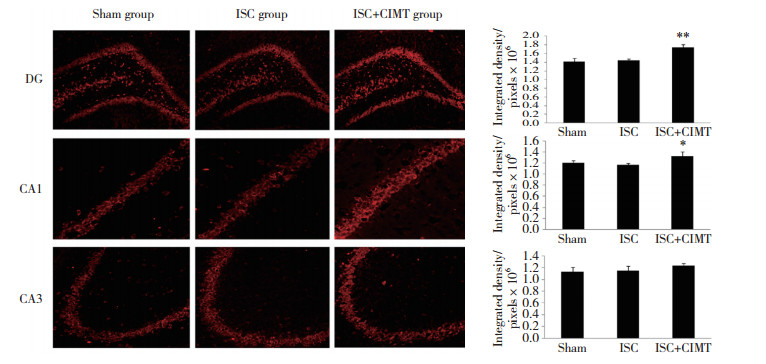
2 结果 2.1 各组大鼠海马SIRT1表达水平的比较免疫荧光染色结果显示, ISC组大鼠海马DG区、CA1区、CA3区SIRT1的表达水平与Sham组相比均无统计学差异(均P > 0.05)。ISC+CIMT组大鼠海马DG区、CA1区SIRT1的表达较ISC组均显著增加(P < 0.01, P < 0.05)。而ISC+CIMT组海马CA3区SIRT1的表达水平较ISC组有增高趋势, 但没有统计学差异(P > 0.05)。见图 1。
|
| ** P < 0.01, * P < 0.05 vs ISC group. 图 1 脑缺血后33 d各组大鼠海马各区SIRT1的表达情况(DG×100, CA1×400, CA3×200) Fig.1 Immunofluorescence staining of SIRT1 expression in the hippocampus of the rats in each group, 33 days after cerebral ischemia (DG×100, CA1×400, CA3×200) |
2.2 各组大鼠海马区域BDNF表达水平的比较
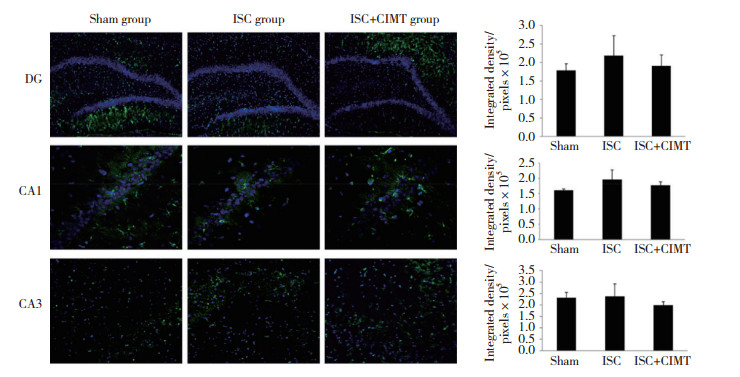
免疫荧光染色结果显示, ISC组海马DG、CA1区的BDNF表达水平较Sham组有增多趋势, ISC+CIMT组海马DG和CA1区BDNF的表达较ISC组有减少趋势, 但3组间海马DG、CA1区BDNF的表达水平没有统计学差异(均P > 0.05)。见图 2。
|
| 图 2 脑缺血后33 d各组大鼠海马各区BDNF的表达情况(DG×100, CA1×400, CA3×200) Fig.2 Immunofluorescence staining of BDNF expression in the hippocampus of the rats in each group, 33 days after cerebral ischemia (DG×100, CA1×400, CA3×200) |
ISC组海马CA3区BDNF的表达水平与Sham组比较无统计学差异(P > 0.05);ISC+CIMT组海马CA3区BDNF的表达较ISC组略减少, 但2组差异没有统计学意义(P > 0.05)。见图 2。
2.3 水迷宫实验结果重复测量方差分析结果显示, 各组大鼠水迷宫定位航行实验逃避潜伏期具有统计学差异(F = 11.80, P < 0.01)。与Sham组比较, ISC组大鼠逃避潜伏期明显增加(P < 0.01), 给予CIMT后可以明显降低缺血后大鼠逃避潜伏期(P < 0.05)。单因素方差分析结果也提示在定位航行实验的第2天和第3天, ISC组大鼠逃避潜伏期较Sham组明显增加(P < 0.01), ISC+CIMT组大鼠的逃避潜伏期较ISC组明显减低(P < 0.05)。空间探索实验结果提示ISC组大鼠在60 s内穿越平台所在位置的次数较SHAM组大鼠明显减少(P < 0.01), ISC+CIMT组大鼠穿越平台所在位置的次数较ISC组明显增加(P < 0.01), 见表 1。
| Group | Escape latency (s) | Pass times in probe trial | ||
| 1 d | 2 d | 3 d | ||
| Sham | 34.73±7.48 | 22.01±3.94 | 15.30±2.34 | 3.25±0.37 |
| ISC | 49.28±4.57 | 38.10±2.931) | 33.94±4.031) | 1.38±0.261) |
| ISC+CIMT | 44.65±3.04 | 25.55±2.632) | 17.18±1.462) | 2.75±0.313) |
| 1) P < 0.01 vs sham group; 2) P < 0.05, 3) P < 0.01 vs ISC group. | ||||
3 讨论
本研究大鼠行为学测试结果显示, ISC组大鼠认知功能较Sham组明显下降, 脑缺血后CIMT治疗可以显著改善脑缺血后大鼠的学习记忆功能。免疫荧光检测结果显示CIMT能够显著提高脑缺血后大鼠海马DG和CA1区SIRT1的表达水平; 脑缺血后海马DG和CA1区BDNF的表达较Sham组有增加趋势, CIMT治疗在一定程度上减少了脑缺血后BDNF的表达。
近年来, SIRT1对神经系统的调控作用引起了人们的广泛关注, 多项研究[12-14]表明SIRT1在突触可塑性和记忆的形成发挥关键作用。SIRT1是一类进化上保守的烟酰胺腺嘌呤二核苷酸依赖的组蛋白去乙酰化酶家族成员之一, 是广泛存在于哺乳动物中NAD +依赖的去乙酰化酶, 在哺乳动物的脑神经元中高度表达, 可通过增加线粒体再生、抗凋亡、调节转录水平等机制对神经元进行修复[15-16]。有研究[17-18]报道康复运动可通过提高大脑SIRT1的表达抵抗衰老, 动物实验表明跑台运动可能通过激活SIRT1通路改善阿尔茨海默病转基因小鼠的认知功能。本研究结果提示CIMT可以显著改善脑缺血后大鼠的水迷宫测试成绩, 同时增加脑缺血后大鼠海马各区域SIRT1的表达, 说明CIMT可能是通过SIRT1相关通路起到促进脑缺血后认知功能恢复的作用。
BDNF是一个对运动训练敏感的促进神经再生和突触发生的因子, 在脑组织广泛表达, 特别是在海马区, 对学习和记忆形成有重要作用。BDNF可能参与改善大脑认知功能[19]。
有研究[20-21]表明SIRT1可通过调节甲基-CpG结合蛋白2与BDNF基因启动子的结合状态调控BDNF的转录来改善认知。另外SIRT1也可通过与包含转录因子的抑制复合物相互作用而减少miR-134表达, 最终促进BDNF以及环磷腺苷效应元件结合蛋白的表达, 从而促进长时程增强效应形成介导学习记忆功能。本研究结果提示脑缺血后大鼠DG及CA1区BDNF的表达较Sham组增加, ISC+CIMT组大鼠海马各区域BNDF的表达较ISC组有减低趋势, 但差异均没有统计学意义(P > 0.05), 可能是因为样本量过小或者各组内样本差异过大所致。CIMT减少脑缺血后BDNF的表达究其原因可能是采用CIMT固定大鼠健侧肢体会引起大鼠紧张, 长期处于紧张压力状态导致慢性应激会影响脑缺血大鼠海马BDNF的表达。已有研究证实自主运动可明显促进脑缺血后大鼠海马BDNF的表达, 同时使大鼠表现出更少的皮质醇应激反应, 而给予强制性运动后大鼠的血清皮质醇浓度较自主运动组大鼠明显增高, 其体内高应激反应抑制了海马BDNF的表达[22-23]。
本研究结果表明, CIMT虽然增加了SIRT1的表达, 但并不是通过SIRT1-BDNF通路来起到改善脑缺血后认知功能的作用。SIRT1可以通过多种机制对缺血保护起重要作用, 主要包括促进线粒体功能并抗氧化、DNA修复、改善突触功能, 参与NAD+代谢的神经保护以及调节血液流动和神经炎症[9]。还有研究[24]证实褪黑素可以通过SIRT1-FoxO1通路改善认知。FoxO1是自噬调节的主要调节因子, 其介导的自噬能够改善血管性痴呆模型大鼠的认知功能[25]。近些年的动物模型相关实验[26]也显示自噬对血管性痴呆模型的大鼠起神经保护作用。CIMT是否通过SIRT1相关的其他通路改善脑缺血后大鼠认知功能, 需要将来进一步研究加以验证。
综上所述, 本研究从形态学角度结合行为学测试探讨了CIMT对脑缺血后大鼠认知功能改善的作用及可能的作用机制。证实了CIMT可以显著改善脑缺血后的认知功能障碍, 且CIMT可能通过SIRT1相关信号通路发挥其改善脑缺血后大鼠认知功能的作用, SIRT1通路下游的具体作用机制还需进一步探索。
本研究结果对于深入了解脑缺血后中枢神经系统的自我修复能力具有重要的意义, 并为脑梗死后的认知功能恢复提供了新的理论基础和治疗靶点。
| [1] |
ABDULLAHI A. Effects of number of repetitions and number of hours of shaping practice during constraint-induced movement therapy:a randomized controlled trial[J]. Neurol Res Int, 2018, 2018: 1-9. DOI:10.1155/2018/5496408 |
| [2] |
LIU XH, HUAI J, GAO J, et al. Constraint-induced movement therapy in treatment of acute and sub-acute stroke:a meta-analysis of 16 randomized controlled trials[J]. Neural Regen Res, 2017, 12(9): 1443-1450. DOI:10.4103/1673-5374.215255 |
| [3] |
ZHAO CS, WANG J, ZHAO SS, et al. Constraint-induced movement therapy enhanced neurogenesis and behavioral recovery after stroke in adult rats[J]. Tohoku J Exp Med, 2009, 218(4): 301-308. DOI:10.1620/tjem.218.301 |
| [4] |
ZHAO SS, QU HL, ZHAO Y, et al. CXCR4 antagonist AMD3100 reverses the neurogenesis and behavioral recovery promoted by forced limb-use in stroke rats[J]. Restor Neurol Neurosci, 2015, 33(6): 809-821. DOI:10.3233/RNN-150515 |
| [5] |
ZHAO SS, ZHAO M, XIAO T, et al. Constraint-induced movement therapy overcomes the intrinsic axonal growth-inhibitory signals in stroke rats[J]. Stroke, 2013, 44(6): 1698-1705. DOI:10.1161/STROKEAHA.111.000361 |
| [6] |
ZHAO SS, ZHAO Y, XIAO T, et al. Increased neurogenesis contributes to the promoted behavioral recovery by constraint-induced movement therapy after stroke in adult rats[J]. CNS Neurosci Ther, 2013, 19(3): 194-196. DOI:10.1111/cns.12058 |
| [7] |
DING P, REN D, HE S, et al. Sirt1 mediates improvement in cognitive defects induced by focal cerebral ischemia following hyperbaric oxygen preconditioning in rats[J]. Physiol Res, 2017, 66(6): 1029-1039. |
| [8] |
HARRIS NM, RITZEL R, MANCINI NS, et al. Nano-particle delivery of brain derived neurotrophic factor after focal cerebral ischemia reduces tissue injury and enhances behavioral recovery[J]. Pharmacol Biochem Behav, 2016, 150-151: 48-56. DOI:10.1016/j.pbb.2016.09.003 |
| [9] |
KORONOWSKI KB, PEREZ-PINZON MA. Sirt1 in cerebral ischemia[J]. Brain Circ, 2015, 1(1): 69-78. DOI:10.4103/2394-8108.162532 |
| [10] |
MANG CS, CAMPBELL KL, ROSS CJ, et al. Promoting neuroplasticity for motor rehabilitation after stroke:considering the effects of aerobic exercise and genetic variation on brain-derived neurotrophic factor[J]. Phys Ther, 2013, 93(12): 1707-1716. DOI:10.2522/ptj.20130053 |
| [11] |
SOLEMAN S, YIP P, LEASURE JL, et al. Sustained sensorimotor impairments after endothelin-1 induced focal cerebral ischemia (stroke) in aged rats[J]. Exp Neurol, 2010, 222(1): 13-24. DOI:10.1016/j.expneurol.2009.11.007 |
| [12] |
GOMES BAQ, SILVA JPB, ROMEIRO CFR, et al. Neuroprotective mechanisms of resveratrol in Alzheimer's disease:role of SIRT1[J]. Oxid Med Cell Longev, 2018, 2018: 8152373. DOI:10.1155/2018/8152373 |
| [13] |
MICHÁN S, LI Y, CHOU MM, et al. SIRT1 is essential for normal cognitive function and synaptic plasticity[J]. J Neurosci, 2010, 30(29): 9695-9707. DOI:10.1523/JNEUROSCI.0027-10.2010 |
| [14] |
WANG R, ZHANG Y, LI JG, et al. Resveratrol ameliorates spatial learning memory impairment induced by Aβ1-42 in rats[J]. Neuroscience, 2017, 344: 39-47. DOI:10.1016/j.neuroscience.2016.08.051 |
| [15] |
FUJITA Y, YAMASHITA T. Sirtuins in neuroendocrine regulation and neurological diseases[J]. Front Neurosci, 2018, 12: 778. DOI:10.3389/fnins.2018.00778 |
| [16] |
MAIESE K. Sirtuins:developing innovative treatments for aged-related memory loss and Alzheimer's disease[J]. Curr Neurovasc Res, 2018. DOI:10.2174/1567202616666181128120003 |
| [17] |
BAYOD S, GUZMÁN-BRAMBILA C, SANCHEZ-ROIGE S, et al. Voluntary exercise promotes beneficial anti-aging mechanisms in SAMP8 female brain[J]. J Mol Neurosci, 2015, 55(2): 525-532. DOI:10.1007/s12031-014-0376-6 |
| [18] |
KOO JH, KANG EB, OH YS, et al. Treadmill exercise decreases amyloid-β burden possibly via activation of SIRT-1 signaling in a mouse model of Alzheimer's disease[J]. Exp Neurol, 2017, 288: 142-152. DOI:10.1016/j.expneurol.2016.11.014 |
| [19] |
BERRETTA A, TZENG YC, CLARKSON AN. Post-stroke recovery:the role of activity-dependent release of brain-derived neurotrophic factor[J]. Expert Rev Neurother, 2014, 14(11): 1335-1344. DOI:10.1586/14737175.2014.969242 |
| [20] |
CHEN T, YANG YJ, LI YK, et al. Chronic administration tetrahydroxystilbene glucoside promotes hippocampal memory and synaptic plasticity and activates ERKs, CaMKⅡ and SIRT1/miR-134 in vivo[J]. J Ethnopharmacol, 2016, 190: 74-82. DOI:10.1016/j.jep.2016.06.012 |
| [21] |
ZOCCHI L, SASSONE-CORSI P. SIRT1-mediated deacetylation of MeCP2 contributes to BDNF expression[J]. Epigenetics, 2012, 7(7): 695-700. DOI:10.4161/epi.20733 |
| [22] |
KE Z, YIP SP, LI L, et al. The effects of voluntary, involuntary, and forced exercises on brain-derived neurotrophic factor and motor function recovery:a rat brain ischemia model[J]. PLoS One, 2011, 6(2): e16643. DOI:10.1371/journal.pone.0016643 |
| [23] |
ZALETEL I, FILIPOVIĆ D, PUŠKAŠ N. Hippocampal BDNF in physiological conditions and social isolation[J]. Rev Neurosci, 2017, 28(6): 675-692. DOI:10.1515/revneuro-2016-0072 |
| [24] |
JENWITHEESUK A, BOONTEM P, WONGCHITRAT P, et al. Melatonin regulates the aging mouse hippocampal homeostasis via the sirtuin1-FOXO1 pathway[J]. EXCLI J, 2017, 16: 340-353. DOI:10.17179/excli2016-852 |
| [25] |
JIANG X, NIU XL, GUO QJ, et al. FoxO1-mediated autophagy plays an important role in the neuroprotective effects of hydrogen in a rat model of vascular dementia[J]. Behav Brain Res, 2019, 356: 98-106. DOI:10.1016/j.bbr.2018.05.023 |
| [26] |
HU M, LIU ZJ, LV P, et al. Autophagy and Akt/CREB signalling play an important role in the neuroprotective effect of nimodipine in a rat model of vascular dementia[J]. Behav Brain Res, 2017, 325(Pt A): 79-86. DOI:10.1016/j.bbr.2016.11.053 |
 2020, Vol. 49
2020, Vol. 49