文章信息
- 傅桐, 侯玲, 范洋, 杜悦
- FU Tong, HOU Ling, FAN Yang, DU Yue
- 槐耳清膏对人肾小管上皮细胞内质网应激损伤的保护作用
- Protective effect of the Chinese herbal medicine Huaierqing on endoplasmic reticulum stress of human renal tubular epithelial cells
- 中国医科大学学报, 2020, 49(2): 147-150
- Journal of China Medical University, 2020, 49(2): 147-150
-
文章历史
- 收稿日期:2019-01-14
- 网络出版时间:2019-12-20 16:44
2. 中国医科大学附属盛京医院 研发中心, 辽宁 本溪 117000
2. Research Center, Shengjing Hospital, China Medical University, Benxi 117000, China
槐耳清膏的主要活性成分槐耳多糖蛋白是由6个单糖结合18种氨基酸组成的结合蛋白, 具有促进巨噬细胞功能、诱导细胞因子、提高细胞免疫和体液免疫功能等作用[1]。研究显示, 槐耳清膏具有抑制肺癌、前列腺癌、乳腺癌等癌症细胞增殖并促进其凋亡的作用。临床研究[2]显示, 槐耳清膏及复方颗粒可增强原发性肾病综合征患儿抗感染能力。还有研究[3]证实, 槐杞黄可降低紫癜性肾炎患儿的血尿和蛋白尿水平。有学者利用顺铂构建小鼠急性肾损伤(acute kidney injury, AKI)模型, 并通过实验证实, 发生AKI时, 槐杞黄可通过抑制肾小管上皮细胞损伤、抗凋亡、抗坏死和抗炎作用保护肾脏[4]。但是, 关于槐耳清膏对肾小管上皮细胞是否有保护作用, 有待进一步研究。本研究通过检测肾小管上皮细胞(HK-2细胞)损伤后内质网应激(endoplasmic reticulum stress, ERS)模型相关蛋白内质网源性转录因子(CCAAT/enhance-binding protein homologous protein, CHOP)、内质网分子伴侣葡萄糖调节蛋白78 (glucose-regulated protein 78, GRP78)表达的变化, 观察槐耳清膏对HK-2细胞ERS损伤产生的影响及其可能的机制。
1 材料与方法 1.1 实验材料细胞:正常人肾小管上皮细胞(HK-2细胞), 购自上海中科院, 保存于液氮中待用。
试剂:毒胡萝卜素(thapsigargin, TG, 美国Sigma公司), 胰蛋白酶(美国Gibco公司), 高糖DMEM培养基、胎牛血清(美国Hyclone公司), 小鼠抗大鼠CHOP单克隆抗体(英国Abcam公司, ab11419)、兔抗大鼠GRP78多克隆抗体(英国Abcam公司, ab108613), 槐耳清膏原液(中国启东盖天力药业有限公司)。
1.2 细胞培养采用含10%胎牛血清、100 μg/mL青链霉素的DMEM高糖培养基培养HK-2细胞, 移至25 mm细胞培养瓶中, 置于37 ℃、5%CO2、充分饱和湿度的培养箱内培养。隔日换液, 待细胞生长至80%融合后, 用0.25%胰蛋白酶液消化, 获取单细胞悬液, 按照1:2比例进行传代。
1.3 实验分组本课题组在前期研究[5]中发现, 5 μmol/L TG诱导HK-2细胞8 h后, CHOP及GRP78表达水平明显升高, 故选取此浓度及作用时间进行本实验。将同代细胞传代于6孔板中, 待细胞生长达90%融合时, 将细胞分为6组: (1)对照组, 正常生长的HK-2细胞; (2) TG组, 5 μmol/L TG处理8 h; (3) 5 mg/mL中药组, 5 mg/mL槐耳清膏处理12 h; (4) 10 mg/mL中药组, 10 mg/mL槐耳清膏处理12 h; (5) 5 mg/mL中药+TG组, 5 mg/mL槐耳清膏处理4 h后, 加入5 μmol/L TG共同作用8 h; (6) 10 mg/mL中药+TG组, 10 mg/mL槐耳清膏处理4 h后, 加入5 μmol/L TG共同作用8 h。
1.4 Western blotting检测CHOP、GRP78表达水平用RIPA裂解液裂解提取各组细胞总蛋白, BCA法蛋白定量后, 蛋白上样行SDS-PAGE电泳, PVDF膜转印, 洗膜, 5%脱脂奶粉封闭1 h。加入一抗(抗GAPDH抗体, 抗CHOP抗体, 抗GRP78抗体, 均1:1 000稀释), 4 ℃孵育过夜。TBST溶液洗膜3次, 10 min/次。加入二抗(1:3 000稀释), 室温孵育2 h。TBST洗膜3次, 10 min/次。ECL发光, 用凝胶成像仪曝光显影。用Image-Pro Plus分析各组条带灰度值。
1.5 统计学分析采用SPSS 19.0软件进行统计学分析。计量资料用x±s表示, 采用独立样本t检验进行比较, 各实验结果至少重复3遍。P < 0.05为差异有统计学意义。
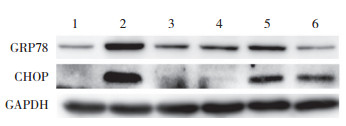
2 结果 2.1 ERS对正常HK-2细胞的影响与对照组比较, TG组CHOP、GRP78表达显著增加, 差异有统计学意义(P < 0.05), 提示HK-2细胞ERS模型建立成功。见图 1, 表 1。
|
| 1, control group; 2, TG group; 3, 5 mg/mL Chinese herb medicine group; 4, 10 mg/mL Chinese herb medicine group; 5, 5 mg/mL Chinese herb medicine + TG group; 6, 10 mg/mL Chinese herb medicine + TG group. 图 1 Western blotting检测各组细胞CHOP、GRP78蛋白的表达 Fig.1 Expression of CHOP and GRP78 in each group as detected by Western blotting |
| Group | CHOP | GRP78 |
| Control | 0.131 8±0.104 5 | 0.124 7±0.026 7 |
| TG | 0.831 9±0.645 71) | 1.141 2±0.513 91) |
| 5 mg/mL Chinese herb medicine | 0.274 4±0.222 3 | 0.679 6±0.495 4 |
| 10 mg/mL Chinese herb medicine | 0.473 7±0.223 1 | 0.688 0±0.553 0 |
| 5 mg/mL Chinese herb medicine + TG | 0.130 1±0.130 52) | 0.298 5±0.207 02) |
| 10 mg/mL Chinese herb medicine + TG | 0.253 8±0.153 22) | 0.196 8±0.130 92) |
| 1) P < 0.05 vs control group; 2) P < 0.05 vs TG group.TG, thapsigargin. | ||
2.2 槐耳清膏对正常HK-2细胞的影响
与对照组比较, 5、10 mg/mL中药组CHOP及GRP78的表达无明显变化(P > 0.05), 提示槐耳清膏不影响HK-2细胞CHOP及GRP78表达, 推测该浓度槐耳清膏不会引起正常细胞发生ERS。见图 1, 表 1。
2.3 槐耳清膏对应激HK-2细胞的影响与TG组比较, 5、10 mg/mL中药+TG组细胞中CHOP与GRP78的表达显著减少, 差异有统计学意义(P < 0.05), 提示槐耳清膏可通过抑制CHOP及GRP78表达减轻HK-2细胞ERS损伤。见图 1、3、4, 表 1。
3 讨论CHOP又名生长抑制DNA损伤基因153抗原(growth arrest and DNA damage-inducible gene 153, GADD153), 属于C/EBP家族的一员, 在ERS中介导凋亡反应的发生[6]。发生ERS反应时, 肌醇酶1 (inositol-requiring enzyme 1, IRE-1)、蛋白激酶的内质网类似激酶[protein kinase R (PKR)-like endoplasmic reticulum kinase, PERK]、激活转录因子6 (activating transcription factor 6, ATF6)这3条信号转导通路激活, 从而引起CHOP活化, 其中最主要的通路为PERK-CHOP信号通路。CHOP在正常细胞中的表达水平极低, 外界刺激引起细胞发生ERS反应时, 内质网分子伴侣GRP78与错误折叠或未折叠蛋白结合, 引起PERK与GRP78分离并激活, 活化的PERK使下游细胞因子elF2α发生磷酸化, 并经由ATF4进一步引起CHOP表达增加[7], 调控细胞分化及凋亡。当外界刺激作用于正常细胞时, 适当的ERS可以促进未折叠蛋白正确折叠, 降解错误折叠蛋白, 从而维持内环境的稳态。然而, 长时间、高强度的ERS反应则会对细胞产生严重危害, 能够通过多种细胞因子的级联反应最终引起细胞凋亡[8-9]。
AKI是临床上各种危重疾病最常见的并发症之一, 是由肾小球、肾小管、肾间质或血管等病变引起的肾功能在短期内急剧下降或丧失的临床综合征[10], 发病率高, 死亡率高。AKI根据病理生理可分为肾前性、肾性和肾后性, 其发病与自噬、炎症反应、氧化应激、线粒体功能障碍等机制相关。有研究[9, 11-13]证实, ERS通过与上述机制参与AKI的发生发展。
国内学者证实槐耳清膏可对肺癌[14]、乳腺癌[15]等肿瘤发挥抑制或杀伤作用。研究[16]发现, 槐耳清膏可能通过抑制上皮间质转化进展, 降低Hippo信号通路中核心蛋白YAP的表达, 抑制结肠癌干细胞增殖和侵袭。还有研究[17]发现, 槐耳清膏通过调节ERK/β-catenin信号通路干预人宫颈癌细胞体外侵袭能力。程万宏等[18]研究发现, 槐耳清膏抑制人肺腺癌A2细胞增殖、促进细胞凋亡可能与下调Wnt-1和Survivin表达有关。临床研究[19]证实, 槐耳清膏对慢性肾病及肾炎、儿童哮喘有显著疗效。但目前尚未见槐耳清膏对AKI影响的报道。
研究[8]证实, TG是细胞内质网钙离子-ATP酶抑制剂, 可诱导内质网中钙离子的大量释放并由内质网流入细胞质内, 即操纵性钙内流过程, 引起细胞发生ERS反应。本研究利用TG诱导正常人肾小管上皮HK-2细胞发生ERS反应模拟AKI, 用5 mg/mL及10 mg/mL槐耳清膏作用12 h后, 通过Western blotting比较各组CHOP及GRP78表达水平的变化。结果发现, HK-2细胞发生ERS时, GRP78和CHOP表达水平显著显升高; 5、10 mg/mL槐耳清膏作用12 h可抑制TG诱导的HK-2细胞内CHOP及GRP78的表达。由此推测, 当发生AKI时, 槐耳清膏可能通过抑制细胞ERS反应, 发挥对肾小管上皮细胞的保护作用。
| [1] |
李立新, 叶胜龙, 王艳红, 等. 槐耳浸膏的实验研究及临床应用进展[J]. 中国肿瘤, 2007, 16(2): 110-113. DOI:10.3969/j.issn.1004-0242.2007.02.016 |
| [2] |
张波, 倪宁, 吴玉斌. 原发性肾病综合征患儿槐杞黄颗粒治疗前后血清细胞因子变化的研究[J]. 中国实用儿科杂志, 2010, 25(1): 33-36. |
| [3] |
周杜鹃, 吴小川, 王复娟, 等. 槐杞黄对紫癜性肾炎患儿Th17/Treg细胞免疫失衡的调节作用[J]. 中华实用儿科临床杂志, 2013, 28(5): 352-356. DOI:10.3760/j.issn.2095-428X.2013.05.010 |
| [4] |
GUO YJ, WANG M, MOU JY, et al. Pretreatment of Huaiqihuang extractum protects against cisplatin-induced nephrotoxicity[J]. Sci Rep, 2018, 8: 7333. DOI:10.1038/s41598-018-25610-6 |
| [5] |
付晓鸥, 杜悦, 侯玲. 毒胡萝卜素诱导肾小管上皮细胞内质网应激后中性粒细胞明胶酶相关脂质运载蛋白的变化[J]. 国际儿科学杂志, 2017, 44(5): 352-355. DOI:10.3760/cma.j.issn.1673-4408.2017.05.015 |
| [6] |
ENDO M, MORI M, AKIRA S, et al. C/EBP homologous protein (CHOP) is crucial for the induction of caspase-11 and the pathogenesis of lipopolysaccharide-induced inflammation[J]. J Immunol, 2006, 176(10): 6245-6253. DOI:10.4049/jimmunol.176.10.6245 |
| [7] |
LI YM, GUO YS, TANG J, et al. New insights into the roles of CHOP-induced apoptosis in ER stress[J]. Acta Biochim Et Biophys Sin, 2014, 46(8): 629-640. DOI:10.1093/abbs/gmu048 |
| [8] |
EL KAROUI K, VIAU A, DELLIS O, et al. Endoplasmic reticulum stress drives proteinuria-induced kidney lesions via Lipocalin 2[J]. Nat Commun, 2016, 7: 10330. DOI:10.1038/ncomms10330 |
| [9] |
ZUGHAIER SM, STAUFFER BB, MCCARTY NA. Inflammation and ER stress downregulate BDH2 expression and dysregulate intracellular iron in macrophages[J]. J Immunol Res, 2014, 2014: 140728. DOI:10.1155/2014/140728 |
| [10] |
CHERTOW GM, BURDICK E, HONOUR M, et al. Acute kidney injury, mortality, length of stay, and costs in hospitalized patients[J]. J Am Soc Nephrol, 2005, 16(11): 3365-3370. DOI:10.1681/ASN.2004090740 |
| [11] |
Grootjans J, Kaser A, Kaufman RJ, et al. The unfolded protein response in immunity and inflammation[J]. Nat Rev Immunol, 2016, 16(8): 469-484. DOI:10.1038/nri.2016.62 |
| [12] |
Zeeshan HMA, Lee GH, Kim HR, et al. Endoplasmic reticulum stress and associated ROS[J]. Int J Mol Sci, 2016, 17(3): 327. DOI:10.3390/ijms17030327 |
| [13] |
Paillusson S, Stoica R, Gomez-Suaga P, et al. There's something wrong with my MAM; the ER mitochondria aixs and neurodegenerative disease[J]. Trends Neurosci, 2016, 39(3): 146-157. DOI:10.1016/j.tins.2016.01.008 |
| [14] |
鲁明骞, 卢宏达, 许新华, 等. 槐耳清膏对人肺腺癌A549细胞增殖及凋亡的影响[J]. 中国老年学杂志, 2017, 37(11): 2620-2621. DOI:10.3969/j.issn.1005-9202.2017.11.008 |
| [15] |
胡保全, 唐鹏, 齐晓伟, 等. 槐耳清膏对乳腺癌细胞系SUM-159细胞干性特征的影响[J]. 第三军医大学学报, 2013, 35(11): 1107-1110. |
| [16] |
韩甜甜, 周京旭, 李丹华. 槐耳清膏对人结肠癌HCT116干细胞增殖及迁移的影响[J]. 广州中医药大学学报, 2018, 35(3): 496-500. DOI:10.13359/j.cnki.gzxbtcm.2018.03.025 |
| [17] |
闫莉.槐耳清膏对人宫颈癌细胞的抑制作用及其机制研究[D].济南: 山东大学, 2016.
|
| [18] |
程万宏, 杨争秒. 槐耳清膏对人肺腺癌A2细胞生物学行为影响及相关机制研究[J]. 辽宁中医药大学学报, 2016, 18(3): 29-31. DOI:10.13194/j.issn.1673-842x.2016.03.009 |
| [19] |
胡爱娟. 槐杞黄颗粒联合孟鲁司特治疗儿童咳嗽变异性哮喘疗效观察[J]. 新中医, 2018, 50(12): 162-165. DOI:10.13457/j.cnki.jncm.2018.12.048 |
 2020, Vol. 49
2020, Vol. 49