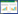文章信息
- 李虹, 韩奕勃, 呼虹宇, 李婷, 王帅, 王义宝, 仇波
- LI Hong, HAN Yibo, HU Hongyu, LI Ting, WANG Shuai, WANG Yibao, QIU Bo
- 弥散张量成像在检测颅内肿瘤与周围脑白质神经纤维束解剖关系中的临床应用价值
- Clinical value of diffusion tensor imaging in intracranial tumor anatomy and peripheral white matter nerve fiber bundles
- 中国医科大学学报, 2020, 49(12): 1125-1129
- Journal of China Medical University, 2020, 49(12): 1125-1129
-
文章历史
- 收稿日期:2020-01-18
- 网络出版时间:2020-12-03 10:40
颅内肿瘤的种类、级别、生长部位决定患者的预后[1]。胶质瘤是最常见的原发恶性颅内肿瘤,呈弥漫浸润性生长,边界不清,具有侵袭能力强、易复发的特点[2]。目前,手术仍是颅内肿瘤的首选治疗方案。肿瘤生长常累及重要功能皮层区及周围的脑白质神经纤维束,准确辨析解剖关系对于制定手术计划和判断预后具有重要意义。本研究拟运用弥散张量成像(diffusion tensor imaging,DTI)技术观察肿瘤与其周围脑白质神经纤维束的解剖关系,旨在指导临床实践。
1 材料与方法 1.1 一般资料选取2017年10月至2019年9月我科收治的颅内肿瘤患者79例,其中,男41例,女38例,年龄13~69岁,平均46.4岁。79例患者均行显微镜下肿瘤切除术,经术后病理证实,转移瘤3例,低级别胶质瘤(WHOⅠ~Ⅱ级)13例,高级别胶质瘤(WHO Ⅲ~Ⅳ级)12例,其中,弥漫性胶质瘤5例,胶质母细胞瘤7例),良性脑膜瘤(WHOⅠ级)49例,恶性脑膜瘤(WHOⅡ~Ⅲ级)2例。
1.2 影像学检查扩散谱成像(diffusion spectrum imaging,DSI)参数设定:使用2次重复聚焦的自旋回波平面成像序列采集核磁共振(magnetic resonance,MR)图像;弥散方向敏感梯度设定数量257;回波时间157 ms,重复时间9.916 ms,视场231 mm×231 mm,单个体素大小2.4 mm×2.4 mm×2.4 mm,bmax 7 000 s/mm2。总采集时间为52 min。DSI数据用DTI方法重建[3]。
1.3 影像后处理DSI-Studio软件是一种开放源代码分析工具,从网址http://dsi-studio.labsion asolver.org免费下载。经DSI-Studio软件后处理,计算每个体素的弥散张量与各向异性(fractional anisotropy,FA),获得部分FA图、方向编码彩色张量图,即FA彩图、脑白质纤维束示踪图。分别在肿瘤脑白质纤维束区、肿瘤周围水肿区、肿瘤周围正常白质纤维束区及肿瘤对侧正常脑白质纤维束区取感兴趣区(regions of interest,ROI),测定FA值。
1.4 统计学分析采用SPSS 20.0软件进行统计分析,计数资料以率或构成比表示,组间比较采用χ2检验;计量资料以x±s表示,组间比较采用t检验。P < 0.05为差异具有统计学意义。
2 结果 2.1 颅内肿瘤与周围脑白质纤维束的解剖关系FA彩图(图 1~3)中,以通用RGB彩色编码表示纤维束,左右走行纤维用红色表示,前后走行纤维用绿色表示,上下走行纤维用蓝色表示[4]。以红圈标示肿瘤大致区域。
|
| A and D, T1WI horizontal and coronal positions, T1 occupying lesions such as ellipse-like on the left middle cranial fossa; B, FA image; C, FA color image; E and F, the ROI was placed on both temporal trunks and the uncinate fassiculus were tracked, the fiber bundles had been pushed and the color from normally green to red; G, postoperative pathology is meningiomas (WHO gradeⅠ)×40. 图 1 典型病例1 Fig.1 Typical case 1 |
|
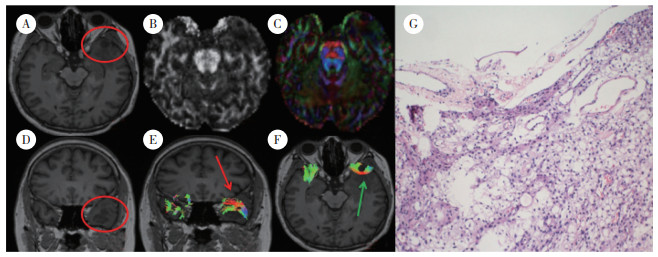
| A and D, T1WI horizontal and sagittal positions, T1 occupying lesions on the right temporal lobe, respectively; B, FA image; C, FA color image; E:The ROI was placed on both temporal trunks and the inferior fronto-occipicital fassiculus (IFOF) were tracked (red arrow indicates left, green arrow indicates right); F, the right IFOF was infiltrated by the tumor and the local fiber bunches turned from green to red as the blue arrow indicates; G, postoperative pathology is right temporal lobe diffuse glioma (WHO grade Ⅱ)×40. 图 2 典型病例2 Fig.2 Typical case 2 |
|
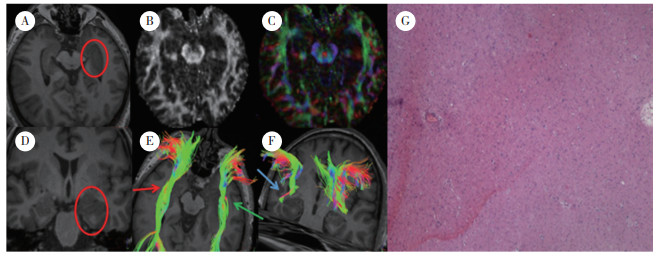
| A and D, T1WI horizontal and sagittal, T1 occupying lesions on the right parietal lobe, right ventricle deformed, and midline shifted; B, FA image; C, FA color image; E and F, ROI was placed on the brain foot and the corticospinal tract was tracked, the hindlimb structure of the right internal capsule was unclear and the fiber tract was damaged by the tumor, showing local fracture or inability to synthesize; G, postoperative pathology is glioblastoma (WHO grade Ⅳ)×40. 图 3 典型病例3 Fig.3 Typical case 3 |
2.1.1 移位
本组患者的肿瘤无论良恶性,周围脑白质神经纤维束均有不同程度移位。典型病例1(图 1)为62岁女性患者,以“慢性间断性头痛2年,加重2周”为主诉入院。图 1A和1D分别为T1WI水平位和冠状位,左侧中颅窝底类椭圆形等T1占位性病变;图 1E、1F为ROI置于双侧颞干,追踪钩束正常前后走行的纤维束呈现绿色,受肿瘤推挤后呈现红色,即左右方向移位;术后病理报告为脑膜瘤(WHOⅠ级)。
2.1.2 浸润9例低级别胶质瘤脑白质神经纤维束呈浸润性改变。典型病例2(图 2)为60岁男性患者,以“间断性头痛1个月,加重2周伴性格淡漠”起病。图 2A和2D分别为T1WI水平位和矢状位,右侧颞叶长T1占位性病变;图 2E为ROI置于双侧颞干,追踪下额枕束(红色箭头指示左侧,绿色箭头指示右侧);图 2F右侧下额枕束受肿瘤浸润,局部纤维束出现红色向外移位,而健侧无此表现(蓝色箭头指示处);术后病理报告为弥漫性胶质瘤(WHO Ⅱ级)。
2.1.3 破坏共19例脑白质神经纤维束破坏,其中,转移瘤3例,低级别胶质瘤4例,高级别胶质瘤12例。典型病例3(图 3)为55岁男性患者,以“头痛15 d,左侧肢体麻木3 d”起病。图 3A、3D分别为T1WI水平位和矢状位,右侧顶叶长T1占位性病变,右侧脑室受压变形,中线移位;图 3E、3F为ROI置于大脑脚,追踪皮质脊髓束,右侧内囊后肢结构不清,纤维束受肿瘤破坏,表现为局部断裂或无法合成;术后病理报告胶质母细胞瘤(WHO Ⅳ级)。
2.2 FA值在低级别与高级别胶质瘤中的差异性如表 1所示,在颅内肿瘤脑白质纤维区,高级别胶质瘤与低级别胶质瘤FA值比较,差异有统计学意义(P = 0.037,P < 0.05);在肿瘤周围水肿区、肿瘤周围正常脑白质纤维区、肿瘤对侧正常脑白质纤维区,FA值均无统计学差异(P = 0.184,P = 0.485,P = 0.494)。
| Area | White matter fiber area of tumor | Peritumoral edema | Normal white matter fiber area around tumor |
Normal white matter fiber area on the opposite side of the tumor |
| LGG | 0.185±0.026 | 0.216±0.039 | 0.433±0.036 | 0.438±0.041 |
| HGG | 0.236±0.029 | 0.222±0.063 | 0.422±0.045 | 0.427±0.052 |
| P | 0.037 | 0.184 | 0.485 | 0.494 |
| LGG,low grade glioma;HGG,high grade glioma. | ||||
3 讨论
脑组织是肿瘤好发部位之一[5]。脑胶质瘤占成人颅内肿瘤的35%~60%,恶性胶质瘤约占60%,具有高致残率和致死率,平均生存期不超过14个月[6],预后极差[7-9]。目前,手术是颅内肿瘤的首选治疗方案,判定肿瘤良恶性及瘤周界线对于手术方案的制定具有重要意义。
BASSER等[10]利用DTI使大脑的结构和神经元的完整性可视化,显示了周围脑白质神经纤维束解剖关系,对神经外科医生制定正确的手术治疗方案产生了重要指导意义。MORI等[11]采用DTI直观地展示了颅内肿瘤与其周围脑白质神经纤维束的解剖关系。WITWER等[12]将此类解剖关系分为移位、水肿、浸润和破坏4类。本研究结果显示,所有患者瘤周神经纤维束均有不同程度移位,9例(低级别胶质瘤)呈浸润改变,19例(3例转移瘤,4例低级别胶质瘤,12例高级别胶质瘤)呈破坏改变,提示脑白质神经纤维束破坏范围及程度与肿瘤的良恶性有关。对于单纯受肿瘤推挤而产生脑白质神经纤维束移位的患者,手术过程中应尽可能多地保护正常脑白质结构,此类患者术后功能恢复明显;对于脑白质神经纤维束受肿瘤浸润或破坏的患者,可视具体情况尽可能多地切除肿瘤,此类患者术后功能恢复未见明显改变。
DTI是无创性显示和分析脑白质神经纤维解剖关系的重要神经影像学技术,能够通过定向定量形式评价脑白质的各向异性[13],参数中的FA值主要反映脑白质神经纤维束解剖结构的完整性。WANG等[14]将DTI技术用于鉴别单发转移瘤、原发性中枢神经系统淋巴瘤及颅内胶质瘤。本研究结果显示,根据FA值可区分肿瘤脑白质纤维束区、肿瘤周围水肿区与肿瘤周围脑白质纤维区、肿瘤对侧正常脑白质纤维区,但不能区分肿瘤脑白质纤维区与肿瘤周围水肿区。本研究还发现,在肿瘤脑白质纤维区,高、低级别胶质瘤间FA值具有统计学差异(P < 0.05),而在肿瘤周围水肿区、肿瘤周围脑白质纤维区、肿瘤对侧正常脑白质纤维区,FA值均无统计学差异(P > 0.05)。提示FA值在区分高级别与低级别胶质瘤方面有一定的参考价值。
在临床实践中,DTI存在易受磁敏感效应、受试者依从性、纤维束交叉[15]及水肿区纤维成像[16]等诸多因素的影响。但是,DTI是唯一能在活体直观地显示脑白质神经纤维束的无创检查手段,其FA值在早期区分肿瘤级别高低方面具有一定的参考价值,为神经外科医生制定手术方案、预测手术风险等提供了重要的指导依据。未来DTI技术在科研和临床实践中将拥有更广阔的应用前景。
| [1] |
张崇杰, 黄亚博, 姚雷, 等. 磁共振弥散加权与灌注成像在脑肿瘤诊断中的应用[J]. 临床医药文献电子杂志, 2015, 2(33): 6909-6909, 6912. |
| [2] |
李宝庆, 王石磊, 李宝东. Twist1对胶质瘤样干细胞的增殖和侵袭影响[J]. 解剖科学进展, 2018, 24(2): 149-152. DOI:10.16695/j.cnki.1006-2947.2018.02.011 |
| [3] |
YEH FC, WEDEEN VJ, TSENG WYI. Generalized q-sampling imaging[J]. IEEE Trans Med Imaging, 2010, 29(9): 1626-1635. DOI:10.1109/tmi.2010.2045126 |
| [4] |
OKADA T, MIKUNI N, MIKI Y, et al. Corticospinal tract localization:integration of diffusion-tensor tractography at 3-T MR imaging with intraoperative white matter stimulation mapping:preliminary results[J]. Radiology, 2006, 240(3): 849-857. DOI:10.1148/radiol.2403050916 |
| [5] |
王忠诚. 颅内肿瘤的诊断与治疗[J]. 现代肿瘤医学, 1996, 4(1): 1-2. |
| [6] |
VAN MEIR EG, HADJIPANAYIS CG, NORDEN AD, et al. Exciting new advances in neuro-oncology:the avenue to a cure for malignant glioma[J]. CA:A Cancer J Clin, 2010, 60(3): 166-193. DOI:10.3322/caac.20069 |
| [7] |
WANG GT, LI WQ, OURSELIN S, et al. Automatic brain tumor segmentation using cascaded anisotropic convolutional neural networks[M]//Brainlesion: Glioma, Multiple Sclerosis, Stroke and Traumatic Brain Injuries. Cham: Springer International Publishing, 2018: 178-190. DOI: 10.1007/978-3-319-75238-9_16.
|
| [8] |
LOUIS DN, PERRY A, REIFENBERGER G, et al. The 2016 world health organization classification of tumors of the central nervous system:a summary[J]. Acta Neuropathol, 2016, 131(6): 803-820. DOI:10.1007/s00401-016-1545-1 |
| [9] |
奚卓, 李新星, 刁宏宇. miR-342对胶质瘤细胞增殖, 迁移侵袭及凋亡的影响[J]. 解剖科学进展, 2018, 24(1): 45-48. DOI:10.16695/j.cnki.1006-2947.2018.01.013 |
| [10] |
BASSER PJ, MATTIELLO J, LEBIHAN D. MR diffusion tensor spectroscopy and imaging[J]. Biophys J, 1994, 66(1): 259-267. DOI:10.1016/s0006-3495(94)80775-1 |
| [11] |
MORI S, FREDERIKSEN K, VAN ZIJL PCM, et al. Brain white matter anatomy of tumor patients evaluated with diffusion tensor imaging[J]. Ann Neurol, 2002, 51(3): 377-380. DOI:10.1002/ana.10137 |
| [12] |
WITWER BP, MOFTAKHAR R, HASAN KM, et al. Diffusion-tensor imaging of white matter tracts in patients with cerebral neoplasm[J]. J Neurosurg, 2002, 97(3): 568-575. DOI:10.3171/jns.2002.97.3.0568 |
| [13] |
WALTZMAN D, KNOWLTON BJ, COHEN JR, et al. DTI microstructural abnormalities in adolescent siblings of patients with childhood-onset schizophrenia[J]. Psychiatry Res Neuroimaging, 2016, 258: 23-29. DOI:10.1016/j.pscychresns.2016.10.010 |
| [14] |
WANG S, KIM S, CHAWLA S, et al. Differentiation between glioblastomas, solitary brain metastases, and primary cerebral lymphomas using diffusion tensor and dynamic susceptibility contrast-enhanced MR imaging[J]. AJNR Am J Neuroradiol, 2011, 32(3): 507-514. DOI:10.3174/ajnr.a2333 |
| [15] |
JIN ZR, BAO Y, WANG Y, et al. Differences between generalized Q-sampling imaging and diffusion tensor imaging in visualization of crossing neural fibers in the brain[J]. Surg Radiol Anat, 2019, 41(9): 1019-1028. DOI:10.1007/s00276-019-02264-1 |
| [16] |
王勇, 张洪亮, 仇波, 等. 弥散张量成像在颅脑病变周围水肿带内纤维显示局限性分析[J]. 中国微侵袭神经外科杂志, 2014, 19(12): 533-536. DOI:10.11850/j.issn.1009-122X.2014.12.002 |
 2020, Vol. 49
2020, Vol. 49