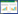文章信息
- 刘娜, 卑贵光, 李玉泽, 王聪
- LIU Na, BEI Guiguang, LI Yuze, WANG Cong
- 多高b值扩散加权成像联合T2WI对移行区前列腺癌的诊断价值
- The combined value of multi-high b-value diffusion-weighted imaging and T2WI in the diagnosis of transitional zone prostate cancer
- 中国医科大学学报, 2020, 49(12): 1112-1117
- Journal of China Medical University, 2020, 49(12): 1112-1117
-
文章历史
- 收稿日期:2020-05-12
- 网络出版时间:2020-12-03 10:27
2. 北部战区总医院放射诊断科, 沈阳 110812
2. Department of Radiology and Diagnostics, General Hospital of Northern Theater Command, Shenyang 110812, China
随着我国人口老龄化加剧,前列腺增生和前列腺癌的发病率也逐年升高[1]。研究[2]显示前列腺癌75%发生在外周带,25%发生在中央区和移行区。目前,研究[3-4]表明25%~30%的中央区前列腺癌是移行区前列腺增生发展恶变而来。与外周带前列腺癌(peripheral zone prostate cancer,PZ-PCa)不同,移行区前列腺癌(transition zone prostate cancer,TZ-PCa)以低分化和器官受侵更常见,前列腺特异性抗原(prostate-specific antigen,PSA)水平更高[5]。已有研究[6]显示早期TZ-PCa行前列腺根治术预后良好,但TZ-PCa常常发现较晚,大部分患者采用了内分泌、放化疗和手术治疗,复发率约为16%,而且高级别TZ-PCa术后切缘阳性概率较高[2],因此,尽早诊断和治疗TZ-PCa非常重要[7]。本研究回顾性分析2018年1月至2019年10月北部战区总医院放射诊断科行前列腺常规磁共振成像(magnetic resonance imaging,MRI)、扩散加权成像(diffusion weighted imaging,DWI)[常规b值DWI(single-b-value DWI,SB-DWI;b=1 000 s/mm2)及多高b值DWI(multi-high b-value DWI,MB-DWI;b分别为2 000 s/mm2、3 000 s/mm2)]检查、并行穿刺活检或手术病理证实移行区病变的70例患者临床资料。探讨不同b值DWI联合T2WI对移行区前列腺癌的诊断价值。
1 材料与方法 1.1 临床资料回顾性分析2018年1月至2019年10月北部战区总医院放射诊断科行前列腺常规MRI、DWI检查并行穿刺活检及手术病理证实移行区病变的70例患者临床资料。纳入标准:(1)相关临床诊疗数据完整、MRI及DWI影像资料完整;(2)行MRI检查前均未经过内分泌、放化疗等治疗;(3)对本研究知情同意并签署知情同意书;(4)行MRI检查后1个月内经直肠超声引导下穿刺或前列腺根治术获得病理确诊。排除标准:(1)未进行DWI检查或获得图像无法识别病变;(2)存在其他尿路病变。其中30例为TZ-PCa(TZ-PCa组),40例为移行区良性前列腺增生(transition zone benign prostatic hyperplasia,TZ-BPH;TZ-BPH组)。TZ-PCa组年龄46~76岁,平均(62.65±6.8)岁;Gleason评分[8] 4~7分,平均(5.14±1.12)分;血清总前列腺特异抗原(total serum prostate-specific antigen,TPSA)15.58~382.15 ng/mL,平均(172.45±41.38)ng/mL。TZ-BPH组年龄45~78岁,平均(65.23±7.96)岁,血清TPSA 3.57~55.67 ng/mL,平均(39.29±9.24)ng/mL。
1.2 仪器与检查方法采用美国GE Discovery 3.0T MR扫描仪,32通道体部相控阵线圈。扫描参数设置:腹部MRI平扫;快速自旋回波序列(fast spin echo sequence,FSE)T2WI:TR 8 000 ms,TE100 ms,层间距0.6 mm,层厚5.0 mm,矩阵352×352,视野(field of vision,FOV)240 mm×240 mm。DWI:TR/TE=5 200 ms/80 ms,FOV 320 mm×320 mm,层厚5.0 mm,层间距0.6 mm。矩阵128×128,回波间隙0.30 ms,激励分别为1、2、2、2次,DWI扫描b分别为0、1 000、2 000、3 000 s/mm2。检查前患者适度排空膀胱,以防止膀胱内液体过多而引起波动伪影。患者取仰卧位,线圈放置于盆腔部位,以耻骨联合上缘为中心。腹带固定线圈,减少腹部呼吸运动对采集数据质量的影响。高分辨率扫描包括整个前列腺及精囊。
1.3 图像观察及分析将采集的图像结果发送到AW4.6工作站,通过软件对图像进行处理,绘制椭圆形感兴趣区(region of interest,ROI),面积14~30 mm2,尽量避开尿道、血管、出血或钙化灶等。记录每个ROI面积大小和参数值,在同样的扫描层面及解剖位置重复测量3次,取平均值。获取表观扩散系数(apparent diffusion coefficient,ADC)值后进行标记确定出目标区,准确记录不同b值时TZ-PCa、TZ-BPH的ADC值。由2名经验丰富的副主任医师在不知病理结果的条件下,根据第二版前列腺影像报告与数据系统(the second edition of prostate imaging report and data system,PI-RADS v2)[9]以T2WI信号特点、DWI信号变化做出诊断评分。患者均结合T2WI、DWI独立分值取平均值作为最终联合诊断分值。评分标准以PI-RADS v2最终评分 > 3分为TZ-PCa的诊断界值。T2WI评分标准:1分,均匀中等信号强度(正常);2分,局限性低信号或不均匀有包膜结节(BPH);3分,边缘模糊、信号不均匀或所有不符合2、4、5分的标准;4分,边缘不清或呈凸透镜状、均匀中低信号,最大径 < 1.5 cm;5分,影像表现同4分,最大径≥1.5 cm,或有明确前列腺外侵犯行为。DWI评分标准:1分,ADC图和高b值DWI均无异常;2分,ADC图模糊不清的低信号;3分,ADC图局灶性轻或中度低信号,且MB-DWI等信号或轻度高信号;4分,ADC图局灶性显著低信号,MB-DWI显著高信号,且最大径线 < 1.5 cm;5分,表现同4分,但最大径线≥1.5 cm或有明确前列腺外侵犯行为。TZ-PCa及TZ-BPH影像表现见图 1、2。根据检查方法不同分为3种:A[T2WI+SB-DWI(b=1 000s/mm2)]、B [T2WI+SB-DWI(b=1 000 s/mm2)+MB-DWI(b=2 000 s/mm2)]、C [T2WI+SB-DWI(b=1 000s/mm2)+MB-DWI(b=3 000 s/mm2)]。
|
| A, T2WI; B, DWI obtained with b=1 000 s/mm2; C, DWI obtained with b=2 000 s/mm2; D, DWI obtained with b=3 000 s/mm2; E, on the D parametric map, the value of D was 0.793×10-3 s/mm2. 图 1 TZ-PCa患者(男,65岁)影像图像 Fig.1 Imaging results of a patient (male, 65 years old) with TZ-PCa |
|
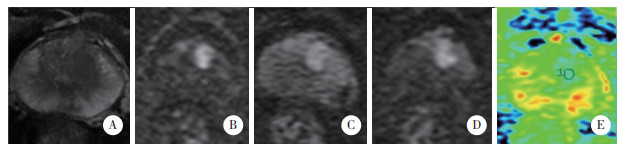
| A, T2WI; B, DWI obtained with b=1 000 s/mm2; C, DWI obtained with b=2 000 s/mm2; D, DWI obtained with b=3 000 s/mm2; E, on the D parametric map, the value of D was 0.894×10-3 s/mm2. 图 2 TZ-BPH患者(男,68岁)影像图像 Fig.2 Imaging results of a patient (male, 68 years old) with TZ-BPH |
1.4 统计学分析
采用SPSS 23.0统计软件进行数据处理,计量资料采用x±s表示,TZ-PCa组与TZ-BPH组3种b值的ADC比较采用配对t检验。2名医师诊断结果以病理结果为金标准做kappa一致性检验;采用决策矩阵计算A、B、C 3种方法诊断TZ-PCa的敏感度、特异度及准确性,计算3种b值诊断结果的受试者操作特征(receiver operating characteristic,ROC)曲线下面积,不同方法间敏感度和特异度差异采用McNemar检验,P < 0.05为差异有统计学意义。
2 结果 2.1 TZ-PCa组与TZ-BPH组3种b值下ADC比较结果显示,TZ-PCa组3种b值下ADC明显低于TZ-BPH组,差异有统计学意义(P < 0.01),见表 1。
| Group | n | ADC | ||
| b=1 000 s/mm2 | b=2 000 s/mm2 | b=3 000 s/mm2 | ||
| TZ-PCa | 30 | 0.928±12.21 | 0.794±8.41 | 0.594±9.29 |
| TZ-BPH | 40 | 1.026±12.34 | 0.848±10.79 | 0.679±14.67 |
| t | -5.142 | -4.066 | -3.291 | |
| P | < 0.01 | < 0.01 | < 0.01 | |
| ADC,apparent diffusion coefficient. | ||||
2.2 2名医师诊断结果与病理结果的一致性检验分析
结果显示,2名医师对A、B、C 3种诊断方法评分的一致性差异有统计学意义,(kappa值分别为0.419、0.743、0.819,均P < 0.01),A方法诊断一致性一般,B、C方法诊断一致性较好。
2.3 A、B、C 3种方法诊断TZ-PCa的敏感度、特异度及准确性结果显示,C方法诊断TZ-PCa的敏感度、特异度及准确性最高,3种方法比较差异有统计学意义(χ2=10.825,P < 0.01),见表 2。
| Method | Positive predictive value | Negative predictive value | Sensitivity | Specificity | Accuracy |
| A | 46.29 | 68.75 | 83.33 | 27.50 | 51.43 |
| B | 60.46 | 85.18 | 86.67 | 57.57 | 70.00 |
| C | 80.00 | 94.28 | 93.33 | 78.57 | 87.14 |
2.4 3种方法诊断TZ-PCa的ROC曲线分析
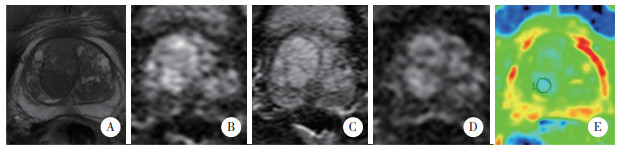
结果显示,A、B、C 3种方法曲线下面积分别为0.790、0.878、0.979;C方法曲线下面积最大,差异有统计学意义(P < 0.01)。b值为1 000、2 000、3 000s/mm2时的最佳临界点分别为0.966,0.871,0.722,Yoden指数分别为0.79,0.80,0.89。因此b=3 000s/mm2时诊断TZ-PCa最有效。见图 3。
|
| 图 3 A、B、C 3种检查方法的ROC曲线 Fig.3 ROC curve of methods A, B, and C |
3 讨论
全球前列腺癌发病率不断升高,前列腺癌的早期诊断与治疗是目前研究的重点[9-10]。TZ-PCa主要依靠多参数MRI进行术前诊断和评估[11]。常规MRI(T2WI)、单独应用DWI和动态增强磁共振成像(dynamic contrast enhanced magnetic resonance imaging,DCE-MRI)对TZ-PCa诊断的敏感性、特异性和准确性较低,研究[11-13]显示,结合前列腺成像报告和数据系统(the second edition of prostate imaging report and data system,PI-RADS)应用多参数MRI提高了TZ-PCa诊断的敏感度、特异度及准确性。
PI-RADS v2推荐TZ-PCa的诊断以T2WI为主,DWI作为补充序列[14]。BARENTSZ等[15-16]提出TZ-PCa在T2WI表现为边缘模糊的均质低信号结节,具有典型的“擦木炭画征”,但部分良性前列腺增生在T2WI时也表现为低信号结节。本研究中常规MRI检查发现54例均表现为T2WI低信号、DWI高信号结节,其中病理诊断为TZ-PCa25例,TZ-BPH29例。因此当TZ-BPH和TZ-PCa均表现T2WI低信号结节及弥散受限时,假阳性率极高、特异性极低,对TZ-PCa与TZ-BPH的鉴别有一定局限性及误诊率。两者影像表现相似原因可能是:(1)DWI可能因为扫描序列的差异、T2WI穿透效应的影响、组织细胞结构差异、细胞内外间隙及结构的变化、脑脊液波动等有不同表现;(2)TZ-PCa是正常腺体被排列紧密异质增生细胞取代、异质增生细胞外间隙小、细胞密度增大,水分子运动明显受限。基质型前列腺增生的增生细胞含有丰富的胶原和基质细胞、细胞密度增高、细胞紧凑导致细胞外间隙减少,水分子运动亦扩散受限,两者更难鉴别;(3)当基质型前列腺增生伴发前列腺炎时,病变结节在T2WI上无论形态还是信号都极其复杂,因此更难与TZ-PCa鉴别。此种情况下ADC值可发挥重要的作用。ADC值受b值影响,不同b值下前列腺癌与良性前列腺增生的ADC值亦不同。本研究结果显示,3种b值下TZ-PCa组的ADC值均低于TZ-BPH组(均P < 0.01)。但研究中发现部分移行区DWI(b=1 000 s/mm2)高信号结节仍无法用ADC值来鉴别TZ-PCa或TZ-BPH结节。但研究中发现少数在DWI序列上呈现高信号的TZ-PCa、TZ-BPH结节的ADC值仍有部分重叠,LIU等[17]发现基质型前列腺增生ADC值减低,与TZ-PCa结节难以鉴别,与本研究结果一致。
既往研究[18]证明,b > 1 000 s/mm2的DWI可以提高癌灶与非癌灶之间的对比,更加有利于癌灶的检出。国内研究[19]证实b=2 000 s/mm2时前列腺癌诊断最佳,KATAHIRA等[20]研究显示采用MB-DWI(b=2 000 s/mm2)扫描,对于良性前列腺增生结节有明显的信号抑制,前列腺癌结节有明显的信号凸显,其诊断的准确性、敏感度、特异度较高、对于鉴别诊断有一定的帮助和提高。但本研究发现b值为1 000、2 000 s/mm2时部分结节影像表现仍有重叠,由此可见中低b值良恶性病变的信号及ADC值存在较大重叠,除病变组织学特点所致外,还受中低b值微循环灌注效应及T2透射效应的影响。高及超高b值可以抑制这种影响,低b值区间(0~1 000 s/mm2)多个b值的每个像素的ADC值通过b值增加的信号强度衰减的单指数模型来计算和显示,而高b值区间(1 400~2 000 s/mm2)或更高b值(3 000 s/mm2)是利用已获得的低b值数据计算生成,不易产生伪影,且肿瘤信号显示更明显[21]。既往b值越高、图像的信噪比就会降低[22],但随着3.0T MRI的应用、扫描技术的更新,新的DWI超高b值采集方式不仅能明显提高图像质量,提高病灶的检出率、更提高了微小病灶的检出,诊断效能明显提高[23]。A、B、C3种方法诊断TZ-PCa的ROC下面积结果显示,MB-DWI(b=3 000 s/mm2)曲线下面积最大,差异有统计学意义(P < 0.01)。C方法诊断的敏感性、特异性及准确性最高(分别为93.33%、78.57%、87.14%),3种方法存在统计学差异(P < 0.01)。分析其原因可能是由于MB-DWI(b=3 000 s/mm2)的T2权重更小、并且抑制微循环灌注,更能反映水分子受限的特性,更能凸显癌灶信号,与张琨等[24]、UENO等[25]研究结果一致。本研究结果显示C方法阴性预测值为94.28%,与A、B两种方法比较,C方法假阴性降低了10%~20%,因此避免了漏诊及误诊,使患者获得最佳的治疗时机。
综上所述,MB-DWI(b=3 000 s/mm2)联合T2WI+SB-DWI(b=1 000 s/mm2)在TZ-PCa诊断中的诊断效能最高,能提高对于临床依赖PI-RADS v2诊断分级困难的TZ-PCa的检出率及准确性、为TZ-PCa疑似患者行穿刺活检提供可靠依据。本研究不足之处:(1)单中心研究;(2)样本量较小;(3)穿刺病理结果是点对点穿刺,可能对研究结果造成一定的偏倚。
| [1] |
刘博, 何晓静, 曾燕, 等. 体素内不相干运动成像在前列腺癌中的研究进展[J]. 中国医学影像学杂志, 2019, 27(2): 146-150. DOI:10.3969/j.issn.1005-5185.2019.02.016 |
| [2] |
韩博, 黄教悌. 2018年前列腺癌病理新进展[J]. 中华泌尿外科杂志, 2018, 39(10): 790-793. DOI:10.3760/cma.j.issn.1000-6702.2018.10.018 |
| [3] |
CHEN WQ, ZHENG RS, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [4] |
LEWIS S, BESA C, ROSEN A, et al. Multiparametric magnetic resonance imaging for transition zone prostate cancer:essential findings, limitations, and future directions[J]. Abdom Radiol, 2017, 42(11): 2732-2744. DOI:10.1007/s00261-017-1184-6 |
| [5] |
HAYES JH, BARRY MJ. Screening for prostate cancer with the prostate-specific antigen test[J]. JAMA, 2014, 311(11): 1143. DOI:10.1001/jama.2014.2085 |
| [6] |
WOO S, KIM SY, LEE J, et al. PI-RADS version 2 for prediction of pathological downgrading after radical prostatectomy:a preliminary study in patients with biopsy-proven Gleason score 7(3+4) prostate cancer[J]. Eur Radiol, 2016, 26(10): 3580-3587. DOI:10.1007/s00330-016-4230-9 |
| [7] |
HOEKSCMA, HAMBROCK T, YAKAR D, et al. Transition zone prostate cancer:detectionandlocalization with 3-T multiparametric MR imaging[J]. Radiology, 2013, 266(1): 207-217. DOI:10.1148/radiol.12120281 |
| [8] |
赵年欢, 王朋, 崔邦平, 等. 前列腺癌Gleason评分与不同影像学检查的关系[J]. 华中科技大学学报(医学版), 2018, 47(3): 375-378, 382. DOI:10.3870/j.issn.1672-0741.2018.03.026 |
| [9] |
BRATAN F, NIAF E, MELODELIMA C, et al. Influence of imaging and histological factors on prostate cancer detection and localisation on multiparametric MRI:a prospective study[J]. Eur Radiol, 2013, 23(7): 2019-2029. DOI:10.1007/s00330-013-2795-0 |
| [10] |
CHESNAIS AL, NIAF E, BRATAN F, et al. Differentiation of transitional zone prostate cancer from benign hyperplasia nodules:evaluation of discriminant criteria at multiparametric MRI[J]. Clin Radiol, 2013, 68(6): e323-e330. DOI:10.1016/j.crad.2013.01.018 |
| [11] |
TURKBEY B, MANI H, SHAH V, et al. Multiparametric 3T prostate magnetic resonance imaging to detect cancer:histopathological correlation using prostatectomy specimens processed in customized magnetic resonance imaging based molds[J]. J Urol, 2011, 186(5): 1818-1824. DOI:10.1016/j.juro.2011.07.013 |
| [12] |
DIKAIOS N, ALKALBANI J, SIDHU HS, et al. Logistic regression model for diagnosis of transition zone prostate cancer on multi-parametric MRI[J]. Eur Radiol, 2015, 25(2): 523-532. DOI:10.1007/s00330-014-3386-4 |
| [13] |
WIEDER H, BEER AJ, HOLZAPFEL K, et al. 11C-choline PET/CT and whole-body MRI including diffusion-weighted imaging for patients with recurrent prostate cancer[J]. Oncotarget, 2017, 8(39): 66516-66527. DOI:10.18632/oncotarget.16227 |
| [14] |
李拔森, 王良. 第二版前列腺影像报告和数据系统(PI-RADS)解读[J]. 中华放射学杂志, 2015, 49(10): 798-800. DOI:10.3760/cma.j.issn.1005-1201.2015.10.023 |
| [15] |
BARENTSZ JO, RICHENBERG J, CLEMENTS R, et al. ESUR prostate MR guidelines 2012[J]. Eur Radiol, 2012, 22(4): 746-757. DOI:10.1007/s00330-011-2377-y |
| [16] |
LEMAITRE L, PUECH P, PONCELET E, et al. Dynamic contrast-enhanced MRI of anterior prostate cancer:morphometric assessment and correlation with radical prostatectomy findings[J]. Eur Radiol, 2009, 19(2): 470-480. DOI:10.1007/s00330-008-1153-0 |
| [17] |
LIU X, ZHOU B, ZHOU L, et al. Differentiation of prostate cancer and stromal hyperplasia in the transition zone with histogram analysis of the apparent diffusion coefficient[J]. Acta Radiol, 2017, 58(12): 1528-1534. DOI:10.1177/0284185117698861 |
| [18] |
KIM CK, PARK BK, KIM B. High-b-value diffusion-weighted imaging at 3 T to detect prostate cancer:comparisons between b values of 1000 and 2000 s/mm2[J]. Am J Roentgenol, 2010, 194(1): 33-37. DOI:10.2214/ajr.09.3004 |
| [19] |
张鑫, 余永强, 钱银锋, 等. 3.0TMR超高b值扩散加权成像诊断前列腺癌的临床应用价值[J]. 临床放射学杂志, 2014, 33(4): 527-531. DOI:10.13437/j.cnki.jcr.2014.04.013 |
| [20] |
KATAHIRA K, TAKAHARA T, KWEE TC, et al. Ultra-high-b-value diffusion-weighted MR imaging for the detection of prostate cancer:evaluation in 201 cases with histopathological correlation[J]. Eur Radiol, 2011, 21(1): 188-196. DOI:10.1007/s00330-010-1883-7 |
| [21] |
徐钟石. 磁共振DWI结合T2WI诊断前列腺癌的临床应用[J]. 医学影像学杂志, 2012, 22(2): 318-320. DOI:10.3969/j.issn.1006-9011.2012.02.073 |
| [22] |
AZUMA T, KODAMA T, YANO T, et al. Optimal imaging parameters for readout-segmented EPI of the temporal bone[J]. Magn Reson Med Sci, 2015, 14(2): 145-152. DOI:10.2463/mrms.2014-0047 |
| [23] |
METENS T, MIRANDA D, ABSIL J, et al. What is the optimal b value in diffusion-weighted MR imaging to depict prostate cancer at 3T?[J]. Eur Radiol, 2012, 22(3): 703-709. DOI:10.1007/s00330-011-2298-9 |
| [24] |
张琨, 张轶伟, 郭勇, 等. 扩散加权成像诊断前列腺癌b值优化的初步探讨[J]. 实用医技杂志, 2018, 25(4): 352-355. DOI:10.19522/j.cnki.1671-5098.2018.04.002 |
| [25] |
UENO Y, KITAJIMA K, SUGIMURA K, et al. Ultra-high b-value diffusion-weighted MRI for the detection of prostate cancer with 3-T MRI[J]. J Magn Reson Imag, 2013, 38(1): 154-160. DOI:10.1002/jmri.23953 |
 2020, Vol. 49
2020, Vol. 49