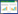文章信息
- 李志伟, 郑新宇, 程晓琪, 王芳琳
- LI Zhiwei, ZHENG Xinyu, CHENG Xiaoqi, WANG Fanglin
- 临床病理模型预测早期乳腺癌腋窝淋巴结转移的回顾性研究
- Retrospective study of a clinicopathological model for predicting axillary lymph node metastasis in early breast cancer
- 中国医科大学学报, 2020, 49(11): 992-996, 1001
- Journal of China Medical University, 2020, 49(11): 992-996, 1001
-
文章历史
- 收稿日期:2020-01-02
- 网络出版时间:2020-10-28 15:01
乳腺癌是目前女性最常见的恶性肿瘤,淋巴结状态是评估乳腺癌预后的重要因素。前哨淋巴结活检术(sentinel lymph node biopsy,SLNB)是评估腋窝淋巴结转移常用的技术手段,能够可靠地评估腋窝淋巴结状态[1],适用于临床腋窝淋巴结阴性[2],或仅有1~2枚转移淋巴结的患者[3-5]。腋窝淋巴结清扫术(axillary lymph node dissection,ALND)能有效地控制腋窝区域的风险,同时也造成许多并发症,如疼痛、麻木、上肢功能受限和淋巴水肿等[6-8]。而SLNB能最大程度地降低并发症的发生率[9]。在NSABP B-32随机3期临床试验中随访3 986例患者10年后发现,接受SLNB的患者相对于接受ALND的患者,总生存率和无病生存率无统计学差异[4, 10-12]。
评估腋窝淋巴结状态是个体化治疗中必不可少的环节[13-17]。本研究对1 569例乳腺癌患者的临床病理资料进行回顾性分析,发现年龄、体质量指数(body mass index,BMI)、肿瘤大小、Ki-67、组织学分级、月经和HER2状态等7种因子与腋窝淋巴结转移相关。以7种临床病理因子建立评估模型,探讨临床病理因素与乳腺癌腋窝淋巴结转移的相关性。
1 材料与方法 1.1 一般资料本研究的病例均来自于中国医科大学附属第一医院乳腺外科。收集2010年5月至2014年5月,以及2019年1月至2019年10月接受原发性乳腺癌手术但无远处转移且临床病理生理资料完整(包括完整腋窝淋巴结数据)的病例。排除标准:接受姑息手术的患者;接受新辅助疗法(包括化学疗法或内分泌疗法)的患者;在其他机构接受过治疗的患者;患有双侧乳腺癌(同步或异时)的患者;SLNB证实转移未接受ALND的患者;对于IHC-HER2 2+,未经FISH进一步确定的患者;以及那些尚不清楚肿瘤亚型的患者。该时期共纳入1 836例患者,按标准排除后剩余1 569例患者,其中,2010年5月至2014年5月1 165例,2019年1月至2019年10月404例。
1.2 临床病理生理因素评估收集患者生理学信息(手术时的年龄)和肿瘤大小、临床分期、组织学类型、雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER2状况、Ki-67、腋窝淋巴结资料(取样的淋巴结数量和转移的数量),以及手术切除标本的病理检查结果。肿瘤大小采自手术记录,部分参考术前乳腺X线、超声检查和MRI(临床T期)报告。肿瘤表型由ER,PR和HER2状态的组合定义,通过IHC评估,并根据指南(表达ER / PR的癌细胞≥1%)确定ER和PR阳性。根据临床病理学标准定义了5种分子亚型[17]:三阴性型(基底样,HER2-/HR-),HER2阳性型(非Luminal,HER2+/HR-),Luminal A型(HR+/HER2-/Ki-67≤20%),Luminal B-HER2阴性型(HR+/HER2-/Ki-67>20%)和Luminal B-HER2阳性型(HR+/HER2 +所有等级Ki-67)。
1.3 统计学分析应用SPSS 23.0,GraphPad 18和MedCalc 18.2.1进行数据分析。根据腋窝淋巴结状态对患者进行分组。通过独立样本t检验和皮尔逊χ2检验对可能影响腋窝淋巴结转移的潜在因素进行单因素分析,并对单因素分析有统计学意义的因素进行多因素logistic回归分析确定多因子模型,由接受者操作特征(receiver operating characteristic,ROC)曲线确定7个有效因子的临界值(Youden’s index最大),并将7个因子得分相加所得总分作为评估模型的临界值,重复确认所有测试结果。P < 0.05为差异有统计学意义。
2 结果 2.1 研究人群特征对训练组1 165例乳腺癌患者进行单因素分析(表 1)。结果显示,994例(85.3%)患者接受ALND,171例(14.7%)接受SLNB,57例(4.9%)发生前哨淋巴结转移并接受ALND,114例(9.8%)无腋窝淋巴结转移;391例(33.6%)发生腋窝淋巴结转移,774例(66.4%)无腋窝淋巴结转移。Ⅰ期患者332例(28.5%),Ⅱ期患者655例(56.2%),Ⅲ期患者178例(15.3%)。所有患者均为女性,本组病例中位年龄为52岁(19~87岁)。
| Item | Total(n = 1 165) | Metastasis(n = 391) | Non-metastasis(n = 774) | P |
| Age(year) | 0.004 | |||
| ≤40 | 181(16) | 88(20) | 93(13) | |
| > 40-60 | 649(55) | 239(54) | 410(57) | |
| > 60 | 335(29) | 114(26) | 221(30) | |
| BMI | 0.015 | |||
| < 24 | 594(51) | 177(45) | 417(54) | |
| 24- < 30 | 348(30) | 135(35) | 213(28) | |
| ≥30 | 223(19) | 79(20) | 144(18) | |
| Menstruation | 0.039 | |||
| Pre-menopause | 606(52) | 220(56) | 386(50) | |
| Post-menopause | 559(48) | 171(44) | 388(50) | |
| T stage | < 0.001 | |||
| T1 | 393(34) | 61(16) | 332(43) | |
| T2 | 708(61) | 290(74) | 418(54) | |
| T3 | 64(5) | 40(10) | 24(3) | |
| N stage | - | |||
| N0 | 774(66) | 0(0) | 774(100) | |
| N1 | 225(19) | 225(58) | 0(0) | |
| N2 | 101(9) | 101(26) | 0(0) | |
| N3 | 65(6) | 65(16) | 0(0) | |
| Histologic | 0.006 | |||
| Ⅰ | 190(16) | 48(12) | 142(18) | |
| Ⅱ | 734(63) | 247(63) | 487(63) | |
| Ⅲ | 241(21) | 96(25) | 145(19) | |
| ER status | 0.041 | |||
| Positive | 820(70) | 274(70) | 546(71) | |
| Negative | 345(30) | 117(30) | 228(29) | |
| PR status | 0.002 | |||
| Positive | 773(66) | 253(65) | 520(67) | |
| Negative | 392(34) | 138(35) | 254(33) | |
| Her2 | 0.019 | |||
| Positive | 449(39) | 163(42) | 336(43) | |
| Negative | 666(61) | 228(58) | 438(57) | |
| Ki-67 | 0.009 | |||
| ≤20% | 536(46) | 159(43) | 377(49) | |
| > 20% | 629(54) | 232(57) | 397(51) |
在验证阶段共对404例患者进行了回顾性研究。135例(33.4%)接受ALND,269例(66.6%)接受SLNB,有33例患者最初接受SLNB,后发现存在前哨淋巴结转移接受ALND;133例(32.9%)发生腋窝淋巴结转移,271例(67.1%)无腋窝淋巴结转移;Ⅰ期患者96例(23.8%),Ⅱ期患者240例(59.4%),Ⅲ期患者68例(16.8%)。所有患者均为女性,中位年龄为51岁(26~78岁)。
在训练组中发现,ER(P = 0.041),PR(P = 0.001),Ki-67(P = 0.009),年龄(P = 0.004),BMI(P = 0.015),月经(P = 0.039),Her2状态,肿瘤大小(P < 0.001),组织学分级(P = 0.006)与乳腺癌腋窝淋巴结转移相关。
2.2 腋窝淋巴结转移风险评估模型对单因素分析有统计学意义的进一步logistic回归分析(表 2),结果显示,年龄、BMI、肿瘤大小、Ki-67、组织学分级、月经、HER2状态、与腋窝淋巴结转移相关。
| Item | B | SE | OR | 95% CI | P | |
| Age | 1.02 | 0.15 | 2.77 | 2.07 | 3.72 | < 0.001 |
| BMI | 0.52 | 0.10 | 1.69 | 1.38 | 2.07 | < 0.001 |
| T stage | 0.70 | 0.15 | 2.02 | 1.49 | 2.72 | < 0.001 |
| Ki-67 | 1.28 | 0.17 | 3.58 | 2.58 | 4.97 | < 0.001 |
| Histologic | 1.04 | 0.16 | 2.82 | 2.07 | 3.84 | < 0.001 |
| Menstruation | 1.01 | 0.22 | 2.76 | 1.78 | 4.26 | < 0.001 |
| Her2 | 1.48 | 0.18 | 4.38 | 3.08 | 6.22 | < 0.001 |
将各因素分别与腋窝淋巴结转移关联建立ROC曲线(图 1A~G),确定最佳截止值(Youden’s index最大)。年龄(截止值=2.5,P < 0.001),BMI(截止值=2.5,P < 0.001),肿瘤大小(截止值=2.5,P < 0.001),Ki-67(截止值=1.5,P < 0.001),组织学分级(截止值=2.5,P < 0.001),月经(截止值=1.5,P < 0.001),Her2状态(截止值=1.5,P < 0.001)。
|
| A, age; B, BMI; C, T stage; D, Ki-67;E, histologic; F, menstruation; G, Her2;H, combined diagnosis. 图 1 研究因素在训练组中的ROC曲线 Fig.1 ROC curve of the factors in the training group |
将7种因子建立联合诊断ROC曲线,AUC=0.840,敏感度为85.4%,特异度为75.6%,P < 0.001(图 1H)。将诊断模型的7种因子得分相加(范围7~18分),总分≤11分记为低分险组,总分>11分记为高风险组,并绘制成风险量表,见表 3。
| Item | Score |
| Age | |
| ≤40 | 3 |
| > 40-60 | 2 |
| > 60 | 1 |
| BMI | |
| Normal(< 24) | 1 |
| Overweight(24- < 30) | 2 |
| Obesity(≥30) | 3 |
| T stage | |
| T1(≤2 cm) | 1 |
| T2(> 2-5 cm) | 2 |
| T3(> 5 cm) | 3 |
| Ki-67 | |
| Low expression(≤20%) | 1 |
| High expression(> 20%) | 2 |
| Histologic | |
| Ⅰ | 1 |
| Ⅱ | 2 |
| Ⅲ | 3 |
| Menstruation | |
| Pre-menopause | 1 |
| Post-menopause | 2 |
| Her2 | |
| Positive | 1 |
| Negative | 2 |
| Total | 7-18 |
2.3 评估模型的诊断效能
同样在404例验证组中,建立联合诊断ROC曲线,AUC=0.816,敏感度为77.4%,特异度为72.3%,P < 0.001(图 2)。结果与训练组相符合。
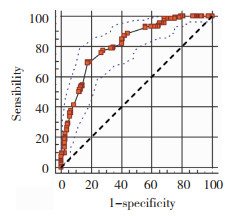
|
| 图 2 预测模型验证组中的ROC曲线 Fig.2 ROC curve in the prediction model validation group |
在训练组的1 165例患者中,低风险组829例(72%),高风险组336例(28%),高风险组与低风险组在腋窝淋巴结转移存在统计学差异(χ2=518.3,P < 0.001)。验证组中,低分组269例(67%),高分组135例(33%),高风险组与低风险组在腋窝淋巴结转移存在统计学差异(χ2=258.0,P < 0.001),见表 4。
| Group | Training group(n = 1 165) | P | Validation group(n = 404) | P | ||||
| Metastasis(n = 391) | Non-metastasis(n = 1 074) | Total | Metastasis(n = 133) | Non-metastasis(n = 271) | Total | |||
| Low(score≤11) | 112(14) | 717(86) | 829 | < 0.001 | 17(6) | 252(94) | 269 | < 0.001 |
| High(score > 11) | 279(83) | 57(17) | 336 | 116(86) | 19(14) | 135 | ||
3 讨论
本研究收集了乳腺癌患者临床病理资料,建立预测模型,数据显示该模型对预测淋巴结转移有统计学意义。另外,在验证阶段利用一组病例验证该模型的评估效能,希望以更小的成本,收获更大的临床效益,指导手术方式及后续治疗,从而实现个体化治疗,避免腋窝淋巴结阴性的患者接受过度治疗。
市面上目前常用的Oncotype DX(Genomic Health Inc,Redwood City,CA,USA)在许多国家,尤其是发展中国家,并没有达到常规使用,原因有以下3点:(1)缺乏标准化,尽管基因检测已成为一项核心研究方法,但商业方法仍是首次引入临床应用,世界范围内缺少统一标准[18-19];(2)成本效益,Oncotype DX的高昂价格及其对治疗决策获益的影响尚不清楚;(3)Oncotype DX仅在基因水平上使用,未考虑临床病理资料。因此,本研究拟将临床病理资料进行整合,以最小的成本达到最大的效益。
在训练组的1 165例早期乳腺癌队列中,利用临床病理因素建立的联合诊断模型可以达到85.4%的敏感度及75.6%的特异度,且P < 0.001。另外在验证组的404例早期乳腺癌队列中,建立的诊断模型同样可以达到77.4%的敏感度和72.3%的特异度,且P < 0.001。结果表明,在没有Oncotype DX测定的情况下,利用临床病理资料中整合的预测模型可能是一个良好的替代。
作为一项回顾性研究,部分研究人群由于信息不完整而退出研究队列,可能会造成人群偏倚,建立的研究模型在外部应用的时存在局限性。虽然在后续的验证队列中评估模型同样有诊断效能,但在实际临床中应用还需要进行前瞻性试验。
| [1] |
LYMAN GH, GIULIANO AE, SOMERFIELD MR, et al. American Society of Clinical Oncology guideline recommendations for sentinel lymph node biopsy in early-stage breast cancer[J]. J Clin Oncol, 2005, 23(30): 7703-7720. DOI:10.1200/JCO.2005.08.001 |
| [2] |
ZAHOOR S, HAJI A, BATTOO A, et al. Sentinel lymph node biopsy in breast cancer:a clinical review and update[J]. J Breast Cancer, 2017, 20(3): 217-227. DOI:10.4048/jbc.2017.20.3.217 |
| [3] |
GALIMBERTI V, COLE BF, VIALE G, et al. Axillary dissection versus no axillary dissection in patients with breast cancer and sentinel-node micrometastases(IBCSG 23-01):10-year follow-up of a randomised, controlled phase 3 trial[J]. Lancet Oncol, 2018, 19(10): 1385-1393. DOI:10.1016/S1470-2045(18)30380-2 |
| [4] |
GIULIANO AE, BALLMAN KV, MCCALL LM, et al. Effect of axillary dissection vs no axillary dissection on 10-year overall survival among women with invasive breast cancer and sentinel node metastasis:the ACOSOG Z0011(Alliance)randomized clinical trial[J]. JAMA, 2017, 318(10): 918-926. DOI:10.1001/jama.2017.11470 |
| [5] |
MARTELLI G, MICELI R, DAIDONE MG, et al. Axillary dissection versus No axillary dissection in elderly patients with breast cancer and No palpable axillary nodes:results after 15 years of follow-up[J]. Ann Surg Oncol, 2011, 18(1): 125-133. DOI:10.1245/s10434-010-1217-7 |
| [6] |
ERNST MF, VOOGD AC, BALDER W, et al. Early and late morbidity associated with axillary levels Ⅰ-Ⅲ dissection in breast cancer[J]. J Surg Oncol, 2002, 79(3): 151-155. DOI:10.1002/jso.10061 |
| [7] |
VERONESI U, PAGANELLI G, VIALE G, et al. A randomized comparison of sentinel-node biopsy with routine axillary dissection in breast cancer[J]. N Engl J Med, 2003, 349(6): 546-553. DOI:10.1056/nejmoa012782 |
| [8] |
LUCCI A, MCCALL LM, BEITSCH PD, et al. Surgical complications associated with sentinel lymph node dissection(SLND)plus axillary lymph node dissection compared with SLND alone in the American college of surgeons oncology group trial Z0011[J]. J Clin Oncol, 2007, 25(24): 3657-3663. DOI:10.1200/jco.2006.07.4062 |
| [9] |
ASHIKAGA T, KRAG DN, LAND SR, et al. Morbidity results from the NSABP B-32 trial comparing sentinel lymph node dissection versus axillary dissection[J]. J Surg Oncol, 2010, 102(2): 111-118. DOI:10.1002/jso.21535 |
| [10] |
GIULIANO AE, HUNT KK, BALLMAN KV, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis:a randomized clinical trial[J]. JAMA, 2011, 305(6): 569-575. DOI:10.1001/jama.2011.90 |
| [11] |
VERONESI U, PAGANELLI G, GALIMBERTI V, et al. Sentinelnode biopsy to avoid axillary dissection in breast cancer with clinically negative lymph-nodes[J]. Lancet, 1997, 349(9069): 1864-1867. DOI:10.1016/S0140-6736(97)01004-0 |
| [12] |
KRAG DN, ANDERSON SJ, JULIAN TB, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer:overall survival findings from the NSABP B-32 randomised phase 3 trial[J]. Lancet Oncol, 2010, 11(10): 927-933. DOI:10.1016/S1470-2045(10)70207-2 |
| [13] |
VAN DEN HOVEN I, VAN KLAVEREN D, VOOGD AC, et al. A Dutch prediction tool to assess the risk of additional axillary nonsentinel lymph node involvement in sentinel node-positive breast cancer patients[J]. Clin Breast Cancer, 2016, 16(2): 123-130. DOI:10.1016/j.clbc.2015.09.003 |
| [14] |
BARCO I, GARCIA FM, GARCIA FA, et al. A logistic regression model predicting high axillary tumour burden in early breast cancer patients[J]. Clin Tran Oncol, 2017, 19(11): 1393-1399. DOI:10.1007/s12094-017-1737-8 |
| [15] |
QIU SQ, ZENG HC, ZHANG F, et al. A nomogram to predict the probability of axillary lymph node metastasis in early breast cancer patients with positive axillary ultrasound[J]. Sci Rep, 2016, 6: 21196. DOI:10.1038/srep21196 |
| [16] |
CHEN K, LIU JQ, LI SR, et al. Development of nomograms to predict axillary lymph node status in breast cancer patients[J]. BMC Cancer, 2017, 17(1): 1-10. DOI:10.1186/s12885-017-3535-7 |
| [17] |
XIE XH, TAN WG, CHEN B, et al. Preoperative prediction nomogram based on primary tumor miRNAs signature and clinicalrelated features for axillary lymph node metastasis in early-stage invasive breast cancer[J]. Int J Cancer, 2018, 142(9): 1901-1910. DOI:10.1002/ijc.31208 |
| [18] |
CARLSON JJ, ROTH JA. The impact of the oncotype Dx breast cancer assay in clinical practice:a systematic review and metaanalysis[J]. Breast Cancer Res Treat, 2013, 141(1): 13-22. DOI:10.1007/s10549-013-2666-z |
| [19] |
DAVIDSON JA, CROMWELL I, ELLARD SL, et al. A prospective clinical utility and pharmacoeconomic study of the impact of the 21-gene recurrence scoreⓇ assay in oestrogen receptor positive node negative breast cancer[J]. Eur J Cancer, 2013, 49(11): 2469-2475. DOI:10.1016/j.ejca.2013.03.009 |
 2020, Vol. 49
2020, Vol. 49