文章信息
- 芦恩婷, 田东立, 窦磊, 张颐
- 子宫浆膜下肌瘤合并癌抗原125水平异常升高和腹腔积液1例报告
- Subserosal fibroids with peritoneal effusion and abnormally elevated CA125 levels:a case report
- 中国医科大学学报, 2020, 49(11): 1049-1051
- Journal of China Medical University, 2020, 49(11): 1049-1051
-
文章历史
- 收稿日期:2020-04-02
- 网络出版时间:2020-10-28 14:50
子宫肌瘤是妇科最常见的良性肿瘤,其中20%的患者可出现症状并需要手术治疗[1],而这类患者大多因月经量增大或经期延长而就诊,少有因腹胀、腹腔积液就诊。在妇科领域中,癌抗原125(cancer antigen 125,CA125)主要存在于上皮性卵巢癌患者的癌组织和血液中,在某些妇科良性疾病中也可有CA125水平不同程度的升高,如子宫内膜异位症、盆腔炎性疾病等。子宫平滑肌瘤患者CA125水平异常升高且合并大量腹水极为罕见。本文报道了1例子宫浆膜下平滑肌瘤合并CA125水平异常升高和腹腔积液的患者,探讨了子宫平滑肌瘤合并CA125水平升高和腹腔积液的原因和误诊原因。
1 临床资料患者,女,39岁,已婚育。以“腹胀15 d”为主诉,于2019年7月29日入我院。患者存在消化道症状,入院前1周出现腹泻,未治疗,持续1周后腹胀、腹泻缓解,月经量和经期无明显改变。既往1次剖宫产史,无其他疾病史。入院查体:子宫前方可触及约10 cm大小囊实性肿物,肿物与子宫界限不清,活动欠佳。盆腔超声提示:子宫体大小6.0 cm×4.1 cm×4.9 cm;子宫肌层见多个低回声结节,大者位于宫底部后壁,大小约3.3 cm×2.6 cm;子宫左前上方可见实质性低回声,大小约9.7 cm×7.6 cm×12.4 cm,被膜不光滑,血流丰富;盆腔子宫前方可见无回声,深度约6.8 cm。实验室检查:CA125 526.40 U/mL,人附睾蛋白4(human epididymal protein 4,HE4)和其余肿瘤标志物正常。全腹增强CT(图 1)提示:子宫前方可见团片状软组织密度影,大小约10.1 cm×7.3 cm;增强扫描可见明显强化,强化不均匀,强化部分程度与子宫接近,CT值约110 Hu,病灶与子宫前壁分界欠清,盆腔占位性病变子宫来源可能大,疑似子宫肌瘤变性,腹盆腔大量积液,肠系膜密度增高。
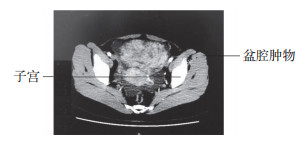
|
| 图 1 全腹增强CT |
术前诊断:盆腔肿物(性质待定),子宫肌瘤。于2019年8月1日行开腹探查术。术中见:盆腹腔淡黄色腹水,约1 000 mL;子宫体正常大小,子宫前壁浆膜下生发手拳大囊实混合性肿物,与膀胱后壁致密粘连,子宫底部和后壁浆膜下多发肌瘤结节,大者直径约2.5 cm,右侧卵巢表面可见0.5 cm质硬小结节。术中取子宫来源肿物和双侧卵巢组织送快速病理,提示子宫平滑肌瘤和正常卵巢组织,遂行全子宫和双侧输卵管切除术。术后病理诊断:子宫体部多发平滑肌瘤,右侧卵巢卵泡膜细胞瘤。术后2周复查CA125水平降至68.20 U/mL,术后1个月复查CA125水平降至正常。术后1个月复查超声,提示未见腹腔积液。
2 讨论CA125是上皮性卵巢癌、输卵管癌的重要肿瘤标志物,由上皮性卵巢肿瘤和来自体腔上皮的正常组织细胞表达。研究[2]表明,在超过80%的经组织学证实的非黏液性上皮性卵巢癌病例中CA125水平升高。研究[3]显示,CA125用于卵巢癌筛查时,在50%的Ⅰ期患者中可观察到水平异常(> 35 U/mL),且该标志物水平越高,阳性预测率越高。但是CA125水平在某些良性疾病中也可有不同程度的升高,如盆腔子宫内膜异位症、卵巢良性肿瘤、结缔组织疾病、心力衰竭、腹膜透析、胸膜和肺疾病、慢性肝病、腹水等[4]。良性疾病通常是由于间皮细胞损伤或增殖导致胸膜或腹膜来源的浆膜积液而发生的,由于腹膜和胸膜腔内细胞类似胚胎发育来源,在这些组织中任何炎症或刺激都会导致CA125分泌增加[5]。此外,CA125水平也可随月经期、妊娠期波动[6]。
Meigs综合征是指卵巢纤维瘤伴有胸腔和腹腔积液者,手术切除肿瘤后胸腔和腹腔积液消失的临床现象,分为真性Meigs综合征和假性Meigs综合征。其中,假性Meigs综合征主要由良性畸胎瘤、子宫平滑肌瘤、输卵管乳头状瘤和盆腔血管瘤等引起[7]。真性Meigs综合征通常由卵巢纤维瘤引起。据文献报道,Meigs综合征发病率较低,占卵巢纤维瘤的比例不及1%[8],而由子宫肌瘤伴CA125升高引起假性Meigs综合征较为少见。研究[9]表明,CA125水平升高是由CA125的间皮细胞表达而非肌瘤本身引起的,腹膜炎症坏死或变性肌瘤释放细胞因子可能导致CA125水平升高。
研究[6]显示,盆腔良性肿瘤产生腹腔积液可能是因为腹膜炎症、肿瘤压迫对腹膜的刺激以及肿瘤产生的介质(如补体、组胺等)导致毛细血管通透性增加。研究[10-11]认为,间皮细胞表达CA125是Meigs综合征患者腹水产生的主要原因之一,且腹水量与CA125表达水平呈正相关。也有学者认为,腹水与肿瘤直径有一定关系,直径 > 6 cm的纤维瘤约40%伴有腹水[12]。ZANNONI等[13]认为,腹水产生原因可能还与内分泌的刺激、肿瘤扭转、血清低蛋白、播散于腹膜表面的肿瘤和炎症介质的释放有关。而持续的腹膜刺激又可导致CA125水平升高。本例患者术后CA125水平下降良好、腹腔积液未复发,考虑其卵泡膜细胞瘤较小,推测本例患者较高水平的CA125和大量的腹腔积液可能与子宫浆膜下肌瘤较大及其对腹膜的持续刺激有关的可能性大,但是也不能完全除外与卵泡膜细胞瘤有关。
术前本例患者的盆腔肿物被误诊为盆腔恶性肿瘤的原因包括:(1)患者既往存在消化系统症状,即排便习惯改变和排便后腹胀缓解,且合并大量腹腔积液,从临床症状上符合晚期卵巢恶性肿瘤患者就诊时的一般主诉;(2)本例患者CA125水平异常升高,符合大多数卵巢恶性肿瘤的辅助检查特点。但本例患者就诊时一般状态良好,并无晚期卵巢恶性肿瘤合并腹水的消耗状态。本文提示:(1)CA125虽是卵巢癌诊断、疗效评价和预后评估的重要指标,但不能作为临床诊断的唯一依据。(2)HE4作为一种新型卵巢癌诊断指标,是一种主要存在于生殖系统上皮(如附睾上皮、输卵管上皮等)中的分泌性蛋白,近来已被高度认可是上皮性卵巢癌的肿瘤标志物,比CA125的特异度更高。研究[14]显示,HE4在妇科良性疾病中升高并不显著,因而在临床上有助于鉴别CA125升高的良性妇科疾病等。此外,MOORE等[15]发现,HE4在整个女性生理月经周期中无明显波动。将HE4与CA125联合用于临床上皮性卵巢癌的诊断中,具有更高的特异度和敏感度,可以更好鉴别的良恶性妇科疾病。本例患者CA125水平虽有升高,但HE4水平正常,起到了鉴别诊断的作用,提示本例患者的盆腔肿物可能为良性。(3)一般来说,晚期卵巢恶性肿瘤患者的盆腔肿物大多位于子宫后方,子宫直肠窝可存在转移病灶,且存在腹水的患者大网膜可有转移病灶,而本例患者CT提示盆腔肿物位于子宫前方且与子宫关系密切,术中探查大网膜外观正常,不符合晚期卵巢癌的临床特点。(4)本例患者的一般状态良好,而非晚期恶性肿瘤的消耗状态,这对于鉴别诊断盆腔肿物合并大量腹腔积液也有重要的作用。
综上所述,对于盆腔肿物合并CA125水平异常升高和腹腔积液的患者,应综合考虑肿物位置、来源、HE4和患者一般状态,在辅助检查难以明确诊断时,应尽早手术探查,明确病理诊断并正确治疗,以免误诊。
| [1] |
LAUGHLIN SK, SCHROEDER JC, BAIRD DD. New directions in the epidemiology of uterine fibroids[J]. Semin Reprod Med, 2010, 28(3): 204-217. DOI:10.1055/s-0030-1251477 |
| [2] |
BAST RC, BADGWELL D, LU Z, et al. New tumor markers:CA125 and beyond[J]. Int J Gynecol Cancer, 2005, 15(Suppl 3): 274-281. DOI:10.1111/j.1525-1438.2005.00441.x |
| [3] |
CHO FN, LIU CB, LI JY, et al. Dramatic changes of CA 125 levels in a pregnant woman with a degenerated subserosal myoma[J]. Taiwan J Obstet Gynecol, 2012, 51(1): 117-118. DOI:10.1016/j.tjog.2012.01.025 |
| [4] |
ESCUDERO JM, AUGE JM, FILELLA X, et al. Comparison of serum human epididymis protein 4 with cancer antigen 125 as a tumor marker in patients with malignant and nonmalignant diseases[J]. Clin Chem, 2011, 57(11): 1534-1544. DOI:10.1373/clinchem.2010.157073 |
| [5] |
CURE MC, CURE E, KIRBAS A, et al. Requests for tumor marker tests in Turkey without indications and frequency of elevation in benign conditions[J]. Asian Pac J Cancer Prev, 2012, 13(12): 6485-6489. DOI:10.7314/apjcp.2012.13.12.6485 |
| [6] |
ABRAMOV Y, ANTEBY SO, FASOULIOTIS SJ, et al. The role of inflammatory cytokines in Meigs' syndrome[J]. Obstet Gynecol, 2002, 99(5 Pt 2): 917-919. DOI:10.1016/s0029-7844(01)01602-7 |
| [7] |
PEPARINI N, CHIRLETTI P. Ovarian malignancies with cytologically negative pleural and peritoneal effusions:demons' or meigs' pseudosyndromes?[J]. Int J Surg Pathol, 2009, 17(5): 396-397. DOI:10.1177/1066896909336441 |
| [8] |
李林, 曾玺, 刘辉, 等. Meigs综合征临床病理特征分析[J]. 中华妇幼临床医学杂志(电子版), 2014, 10(5): 576-580. DOI:10.3877/cma.j.issn.1673-5250.2014.05.004 |
| [9] |
MITROU S, MANEK S, KEHOE S. Cystic struma ovarii presenting as pseudo-Meigs' syndrome with elevated CA125 levels. A case report and review of the literature[J]. Int J Gynecol Cancer, 2008, 18(2): 372-375. DOI:10.1111/j.1525-1438.2007.00998.x |
| [10] |
RIKER D, GOBA D. Ovarian mass, pleural effusion, and ascites:revisiting Meigs syndrome[J]. J Bronchology Interv Pulmonol, 2013, 20(1): 48-51. DOI:10.1097/LBR.0b013e31827ccb35 |
| [11] |
廖谦和, 胡树红, 段焕元, 等. Meigs综合征4例报道并文献复习[J]. 现代妇产科进展, 2012, 21(8): 632-633. DOI:10.13283/j.cnki.xdfckjz.2012.08.025 |
| [12] |
HLAISE KK, SHINGANGE SM. Sudden death associated with Meigs syndrome:an autopsy case report[J]. Am J Forensic Med Pathol, 2012, 33(1): 58-60. DOI:10.1097/PAF.0b013e3181edf318 |
| [13] |
ZANNONI GF, GALLOTTA V, LEGGE F, et al. Pseudo-Meigs' syndrome associated with malignant struma ovarii:a case repot[J]. Gynecol Oncol, 2004, 94(1): 226-228. DOI:10.1016/j.ygyno.2004.03.045 |
| [14] |
DELIĆ R, ŠTEFANOVIĆ M, KRIVEC Š, et al. Comparison of HE4 and CA125 levels in women with benign gynecologic disorders:does age or menopausal status matter[J]. Wien Klin Wochenschr, 2016, 128(Suppl 7): 543-547. DOI:10.1007/s00508-016-1099-1 |
| [15] |
MOORE RG, PLANTE B, HARTNETT E, et al. Assessment of serum HE4 levels throughout the normal menstrual cycle[J]. Am J Obstet Gynecol, 2017, 217(1): 51-53. DOI:10.1016/j.ajog.2017.02.029 |
 2020, Vol. 49
2020, Vol. 49