文章信息
- 王慧, 杨洋, 费菲, 张春娣, 李国荣, 赵冬艳
- WANG Hui, YANG Yang, FEI Fei, ZHANG Chundi, LI Guorong, ZHAO Dongyan
- 沙库巴曲缬沙坦钠片在射血分数降低的心力衰竭老年患者中的临床应用及其对半乳糖凝集素3的干预作用
- Clinical application of sacubitril valsartan sodium tablet and its effect on galectin 3 in elderly patients with heart failure and reduced ejection fraction
- 中国医科大学学报, 2020, 49(10): 925-928, 939
- Journal of China Medical University, 2020, 49(10): 925-928, 939
-
文章历史
- 收稿日期:2019-12-30
- 网络出版时间:2020-10-09 9:23
射血分数降低的心力衰竭(heart failure with reduced ejection fraction,HFrEF)是多种因素导致的心脏结构和功能异常,是以心室收缩功能障碍为主的一组临床综合征,其患病率随着年龄增长而增加。老年人常因多疾病共存、衰弱、联合用药多等因素更易发生心功能恶化,再住院率高,预后不良。神经内分泌系统异常激活导致心肌纤维化、凋亡和重构是心力衰竭(简称心衰)主要的病理生理机制。现阶段,虽以β受体阻滞剂、血管紧张素转换酶抑制剂等为核心的治疗一定程度上阻断了许多心衰患者的病程发展,但仍有研究[1]显示,患者再住院率高,1年全因死亡率 > 20%。沙库巴曲缬沙坦钠片是血管紧张素Ⅱ受体和脑啡肽酶双重抑制剂,研究[2]结果表明,心衰患者应用后可降低心血管病死亡风险和心衰再住院率。研究[3]发现,半乳糖凝集素3(galectin 3,Gal-3)在心肌纤维化和重构中起到重要作用,与N末端B型利钠肽原(N-terminal pro-brain natriuretic peptide,NT-proBNP)联合监测更有利于评估心衰患者的危险程度和预后[4]。本研究通过观察HFrEF老年患者应用沙库巴曲缬沙坦钠片后Gal-3水平的变化与心脏结构的关系,探讨其对心肌重构和生活质量的影响及可能的心脏保护机制。
1 材料与方法 1.1 研究对象和分组选择2018年8月至2019年10月我院收治的符合入选标准的HFrEF患者60例。纳入标准:NYHA心功能Ⅱ~Ⅳ级,左心室射血分数(left ventricular ejection fraction,LVEF)≤40%,慢性心衰病史≥3个月,年龄 > 65岁。排除标准:症状性低血压,高钾血症,估算的肾小球滤过率 < 30 mL/(min·1.73 m2),重度肝功能损害,血管性水肿病史,不耐受血管紧张素转换酶抑制剂和血管紧张素受体拮抗剂的不良反应,机械性通气。
将60例HFrEF老年患者随机分为A组和B组,每组30例。A组在常规抗心衰治疗基础上,在贝那普利停服36 h后转换为沙库巴曲缬沙坦钠片,50 mg/次,2次/d,口服,每2周倍增1次剂量,直至靶剂量(200 mg/次,2次/d)或最大耐受剂量,并维持。B组为常规抗心衰治疗加贝那普利,贝那普利10~20 mg/d,口服,并维持。对患者持续治疗并随访6个月,观察相关指标变化情况。
1.2 观察指标 1.2.1 生活质量评估采用疾病特异性生活质量评估表即明尼苏达心衰生活质量量表(Minnesota Living with Heart Failure Questionaire,MLHFQ),量化评判HFrEF患者的生活质量。内容包含症状体征、社会功能、心理状态等问题,每项问题5分制,共21项(105分),得分越高则生活质量越低。
1.2.2 血清Gal-3和NT-proBNP浓度的测定入选患者均在平静状态下采集肘静脉血5 mL,离心,其中3 mL用于酶联免疫吸附法测定Gal-3,2 mL用于荧光定量法测定NT-proBNP。
1.2.3 超声心动图指标每次测量3个心动周期的左心室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、左心室后壁厚度(left ventricular posterior wall thickness,LVPWT)、左心房内径(left atrial diameter,LA),取平均值。以简化双平面Simpson法评定LVEF。
1.3 统计学分析采用SPSS 22.0软件进行数据分析,计量资料以x±s表示,2组间比较采用t检验。计数资料以率表示,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2 结果 2.1 2组患者临床资料的比较对60例入选患者的临床资料进行比较,包括性别、年龄、危险因素、NYHA心功能分级、心衰基础疾病和临床用药等方面。2组患者比较,临床资料无统计学差异(P > 0.05)。见表 1。
| Item | Group A(n = 30) | Group B(n = 30) |
| Age(year) | 68.07±2.69 | 68.77±3.51 |
| Male [n(%)] | 18(60.0) | 19(63.3) |
| Hypertension [n(%)] | 18(60.0) | 16(53.3) |
| Diabetes [n(%)] | 11(36.7) | 9(30.3) |
| Smoking [n(%)] | 12(40.0) | 15(50.0) |
| NYHA classification [n(%)] | ||
| Ⅱ | 4(13.3) | 5(16.6) |
| Ⅲ/Ⅳ | 26(86.7) | 25(83.3) |
| Basic disease of heart failure [n(%)] | ||
| Ischemic cardiomyopathy | 13(43.3) | 12(40.0) |
| Dilated cardiomyopathy | 12(40.0) | 11(36.7) |
| Hypertensive heart disease | 5(16.7) | 7(23.3) |
| Clinical medication [n(%)] | ||
| Digoxin | 12(40.0) | 10(33.3) |
| β-blocker | 27(90.0) | 28(93.3) |
| Aldactone | 19(63.3) | 20(66.7) |
2.2 治疗前后2组患者MLHFQ评分和Gal-3、NT-proBNP浓度的变化
治疗前2组比较,MLHFQ评分和血清Gal-3、NT-proBNP浓度无统计学差异(P > 0.05)。与治疗前比较,2组患者治疗后6个月MLHFQ评分下降,血清NT-proBNP、Gal-3浓度下降,差异有统计学意义(P < 0.05)。治疗后,A组患者MLHFQ评分和血清NT-proBNP、Gal-3浓度低于B组,差异有统计学意义(P < 0.05)。见表 2。
| Group | MLHFQ score | NT-proBNP(ng/L) | Gal-3(ng/mL) |
| A(n = 30) | |||
| Before treatment | 68.37±1.69 | 5 027.00±1 634.24 | 17.73±1.71 |
| After treatment | 51.40±6.641),2) | 2 922.23±1 347.641),2) | 10.05±1.531),2) |
| B(n = 30) | |||
| Before treatment | 67.77±1.84 | 4 781.87±1 640.07 | 17.54±1.78 |
| After treatment | 54.97±5.901) | 3 983.80±1 380.901) | 11.02±1.931) |
| 1)P < 0.05 vs before treatment within group;2)P < 0.05 vs group B at the same time point. | |||
2.3 治疗前后2组患者超声心动图指标的变化
治疗前2组患者比较,超声心动图指标无统计学差异(P > 0.05)。与治疗前比较,2组患者治疗后6个月LA变小(图 1),LVEF提高,差异有统计学意义(P < 0.05),LVEDD和LVPW较治疗前均降低,但差异无统计学意义(P > 0.05)。治疗后,A组LA低于B组,LVEF高于B组,差异有统计学意义(P < 0.05)。见表 3。
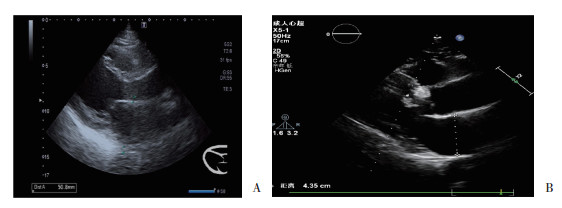
|
| A, before treatment; B, 6 months after treatment. 图 1 A组治疗前和治疗后左心房内径 Fig.1 Left atrial diameter before versus after treatment in group A |
| Group | LA(mm) | LVEDD(mm) | LVPWT(mm) | LVEF(%) |
| A(n = 30) | ||||
| Before treatment | 46.53±5.27 | 60.23±4.70 | 9.67±1.39 | 35.83±3.21 |
| After treatment | 41.23±2.911),2) | 58.80±3.92 | 9.57±1.18 | 39.33±2.961),2) |
| B(n = 30) | ||||
| Before treatment | 45.70±5.51 | 59.77±4.83 | 9.80±1.41 | 35.97±2.77 |
| After treatment | 43.07±4.001) | 57.73±3.22 | 9.72±1.19 | 37.87±2.361) |
| 1)P < 0.05 vs before treatment within group;2)P < 0.05 vs group B at the same time point. | ||||
3 讨论
HFrEF临床十分常见,常为各种心血管疾病终末阶段,其患病率和死亡率均居高不下。随年龄的增长其患病率迅速增加,70岁以上人群达10%以上,老年患者更易发生低氧血症、肺水肿和重要脏器低灌注。目前认为,HFrEF的发生、发展与多种因素有关,根据其主要病理生理机制,目前抑制交感神经系统和肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)过度激活的药物治疗是抗心衰的基本部分,可改善、逆转心脏重构和心功能持续恶化。同时,众多体液因子也参与HFrEF进程,如利钠肽系统具有扩血管、抗RAAS、消除水钠潴留、改善心脏纤维化等作用。因此,抑制内源性利钠肽降解或增加外源性利钠肽成为治疗HFrEF的又一重要途径。脑啡肽酶可降解利钠肽,抑制这种酶可以提高内源性利钠肽浓度,起到抗心衰的作用。SYBERTZ等[5]发现,脑啡肽酶被抑制后心房利钠肽水平明显升高,起到利尿作用。
沙库巴曲缬沙坦钠片是一种盐复合物,由缬沙坦分子和脑啡肽酶抑制剂前体药物AHU377分子按1:1构成[6]。它具有双作用靶点,一方面抑制脑啡肽酶提高利钠肽浓度,另一方面阻断1型血管紧张素受体抑制RAAS激活,发挥协同作用[7],比单用血管紧张素受体拮抗剂类药物表现出更强的抗增生和纤维化作用。动物实验提示,沙库巴曲缬沙坦钠片能够提高大鼠体内心房利钠肽浓度。SOLOMON等[8]发现,该药可使心衰患者心功能分级和左心房容积指数明显改善。研究[2]表明,该药改善心衰患者的症状和预后。
Gal-3是由活化的巨噬细胞产生并分泌的β半乳糖苷结合蛋白[9],能够促进心肌成纤维细胞增殖分泌形成胶原蛋白,巨噬细胞释放炎性介质,介导心肌纤维化和炎症,参与心脏重塑[10]。SHARMA等[11]发现,健康小鼠注射Gal-3后发生了心肌重塑。研究[9]发现,Gal-3水平与心肌纤维化严重程度正相关;与健康人群比较,慢性心衰患者Gal-3浓度明显增高,Gal-3高水平表达提示心衰患者住院率和死亡率增高,与严重程度相关,对预后有预测价值[12]。以上研究均表明,Gal-3作为心肌纤维化的重要因子,在心脏重塑和心衰发展中有着重要作用,动态监测其浓度变化对评价心衰进展有重要意义。NT-proBNP是目前临床用于心衰患者诊断、病情严重程度和预后评估的可靠指标,可预测心血管事件风险,经治疗后其水平未见下降表明预后差。NT-proBNP的分泌与心室壁压力有关,而Gal-3与此无关,两者是心衰过程中不同的病理生理变化。DE BOER等[12]的研究发现,在判断心衰预后价值方面,Gal-3与NT-proBNP结合高于二者独立的价值,可指导心衰治疗。NYHA心功能分级易受患者主观因素影响,而应用MLHFQ评估心衰患者生活质量,能够较客观、全面地反映临床疗效。
本研究采用沙库巴曲缬沙坦钠片治疗HFrEF老年患者,A组中既往使用血管紧张素转换酶抑制剂类药物的患者转换为使用沙库巴曲缬沙坦钠片,结果提示,与治疗前比较,治疗后6个月A组患者MLHFQ评分明显下降,优于B组,说明沙库巴曲缬沙坦钠片可有效改善患者症状和体征,提高患者生活质量。治疗后6个月A组LA缩小,左心室收缩功能指标LVEF提高,与治疗前和治疗后B组比较,均有统计学差异;LVPWT、LVEDD均较治疗前改善;血清NT-proBNP和Gal-3浓度降低,与治疗前和治疗后B组比较,均有统计学差异。说明沙库巴曲缬沙坦钠片干预后可有效地降低HFrEF老年患者Gal-3和NT-proBNP水平,改善心脏结构。此机制可能与Gal-3参与慢性心衰结构重构的过程,而沙库巴曲缬沙坦钠片减弱1型血管紧张素受体效应,增强血管紧张素2受体效应,缓激肽分泌升高,抑制细胞肥大和纤维化,沙库巴曲缬沙坦钠片使这一作用增强,下调Gal-3的表达有关。
综上所述,沙库巴曲缬沙坦钠片治疗HFrEF老年患者可提高患者生活质量和预后,降低血清Gal-3水平,有效改善心脏结构,对心脏有保护作用。
| [1] |
ITO S, SATOH M, TAMAKI Y, et al. Safety and efficacy of LCZ696, a first-in-class angiotensin receptor neprilysin inhibitor, in Japanese patients with hypertension and renal dysfunction[J]. Hypertens Res, 2015, 38(4): 269-275. DOI:10.1038/hr.2015.1 |
| [2] |
MCMURRAY JJ, PACKER M, DESAI AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure[J]. N Engl J Med, 2014, 371(11): 993-1004. DOI:10.1056/NEJMoa1409077 |
| [3] |
何东升, 柳云恩, 赵科研, 等. 半乳糖凝集素3与心力衰竭[J]. 中华老年心脑血管病杂志, 2014, 16(8): 875-877. DOI:10.3969/j.issn.1009-0126.2014.08.029 |
| [4] |
WANG H, CHEN Q, LI Y, et al. Prognostic value of galectin-3 on admission in Chinese patients with heart failure:a prospective observational study[J]. Acta Cardiol, 2017, 72(2): 188-195. DOI:10.1080/00015385.2017.1291187 |
| [5] |
SYBERTZ EJ, CHIU PJ, VEMULAPALLI S, et al. SCH 39370, a neutral metalloendopeptidase inhibitor, potentiates biological responses to atrial natriuretic factor and lowers blood pressure in desoxycorticosterone acetate-sodium hypertensive rats[J]. J Pharmacol Exp Ther, 1989, 250(2): 624-631. |
| [6] |
MCMURRAY JJ, PACKER M, DESAI AS, et al. Dual angiotensin receptor and neprilysin inhibition as an alternative to angiotensin-converting enzyme inhibition in patients with chronic systolic heart failure:rationale for and design of the prospective comparison of ARNI with ACEI to determine impact on global mortality and morbidity in heart failure trial (PARADIGM-HF)[J]. Eur J Heart Fail, 2013, 15(9): 1062-1073. DOI:10.1093/eurjhf/hft052 |
| [7] |
REED BN, STREET SE, JENSEN BC. Time and technology will tell:the pathophysiologic basis of neurohormonal modulation in heart failure[J]. Heart Fail Clin, 2014, 10(4): 543-557. DOI:10.1016/j.hfc.2014.07.002 |
| [8] |
SOLOMON SD, ZILE M, PIESKE B, et al. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction:a phase 2 double-blind randomised controlled trial[J]. Lancet, 2012, 380(9851): 1387-1395. DOI:10.1016/S0140-6736(12)61227-6 |
| [9] |
HSU DK, CHEN HY, LIU FT. Galectin-3 regulates T-cell functions[J]. Immunol Rev, 2009, 230(1): 114-127. DOI:10.1111/j.1600-065X.2009.00798.x |
| [10] |
POLAT V, BOZCALI E, UYGUN T, et al. Diagnostic significance of serum galectin-3 levels in heart failure with preserved ejection fraction[J]. Acta Cardiol, 2016, 71(2): 191-197. DOI:10.1080/AC.71.2.3141849 |
| [11] |
SHARMA UC, POKHAREL S, VAN BRAKEL TJ, et al. Galectin-3 marks activated macrophages in failure-prone hypertrophied hearts and contributes to cardiac dysfunction[J]. Circulation, 2004, 110(19): 3121-3128. DOI:10.1161/01.cir.0000147181.65298.4d |
| [12] |
DE BOER RA, LOK DJ, JAARSMA T, et al. Predictive value of plasma galectin-3 levels in heart failure with reduced and preserved ejection fraction[J]. Ann Med, 2011, 43(1): 60-68. DOI:10.3109/07853890.2010.538080 |
 2020, Vol. 49
2020, Vol. 49