文章信息
- 李兰丽, 姜丽丽, 夏杨柳, 刘勇
- LI Lanli, JIANG Lili, XIA Yangliu, LIU Yong
- 达塞布韦对扑热息痛葡萄糖醛酸化的抑制作用
- Inhibition of paracetamol glucuronidation by dasabuvir
- 中国医科大学学报, 2020, 49(10): 887-892
- Journal of China Medical University, 2020, 49(10): 887-892
-
文章历史
- 收稿日期:2019-08-23
- 网络出版时间:2020-10-08 7:01
扑热息痛(paracetamol,APAP)又称对乙酰氨基酚、醋氨酚,是世界上应用最广泛的解热镇痛药,临床上常与其他药物联合使用。过量服用APAP可导致肝毒性和急性肝功能衰竭[1]。APAP在人体内主要通过肝脏中多种尿苷二磷酸-葡萄糖醛酸转移酶(UDP-glucuronosyltransferases,UGTs)介导的葡萄糖醛酸化反应清除,其中最主要的是尿苷二磷酸-葡萄糖醛酸转移酶1A9 (UDP-glucuronosyltransferases1A9,UGT1A9) [2-3]。UGTs是人体内一类重要的Ⅱ相代谢酶,参与了许多内源性物质(如胆红素)和外源性化学物(如药物)的代谢清除[4-5]。研究[6-8]表明,当与APAP同时服用的药物对UGTs活性具有抑制作用时,APAP的不良反应率可能会增加,甚至引发严重的肝毒性。
抗病毒药物达塞布韦,又名ABT-333,是丙型肝炎病毒(hepatitis C virus,HCV)的新型非核苷抑制剂,通过抑制NS5B的RNA聚合酶抑制HCV复制[9]。研究[10]发现,达塞布韦对几种UGTs有抑制作用,且HCV治疗周期较长[11],因此,达塞布韦在临床上与其他药物同时服用时,有可能通过其对某些UGTs的抑制导致药物相互作用[12]。
本研究拟利用酶动力学和药物相互作用预测模型,定量评价达塞布韦对APAP的葡萄糖醛酸化的抑制作用,并预测由此引发药物相互作用的危险度,以期为达塞布韦的临床安全应用提供理论支持。
1 材料与方法 1.1 材料p-乙酰氨基苯-β-D-葡萄糖酸钠盐(p-acetamid-ophenyl β-D-glucuronide sodium salt,APAPG),尿苷-5’-二磷酸葡糖醛酸三钠盐(uridine 5’-diphosphoglu-curonic acid trisodium salt,UDPGA)购自美国Sigma-Aldrich公司。人肝微粒体(human liver microsomes,HLMs)购自上海瑞德肝脏疾病研究有限公司。人重组UGT1A9购自美国康宁公司。APAP、3’-羟基乙酰苯胺购自中国阿拉丁公司。达塞布韦购自美国Selleck公司。
1.2 方法 1.2.1 HLMs中APAP的葡萄糖醛酸化动力学研究选用混合HLMs反应体系孵育系统[12],在含有HLMs (0.5 mg/mL)、50 mmol/L Tris-HCl缓冲液(pH7.4)、丙甲菌素(2.5 mg/mL)、MgCl2(100 mmol/L)、底物APAP(终浓度为0.2、0.5、1.0、2.0、5.0、10.0、15.0、20.0、30.0、40.0 mmol/L)和UDPGA (50 mmol/L)的200 μL总体积典型孵育混合体系中,进行酶促反应,所有实验设置2个平行组。上述条件加入Tris-HCl、HLMs、丙甲菌素后轻轻涡旋5 s,冰浴15 min后,再依次向EP管内加入MgCl2、APAP后涡旋5 s,在37 ℃下预温孵育5 min后,将启动反应的辅助因子UDPGA加入到该体系中启动反应。在37 ℃下反应30 min后,向该体系加入100 μL冰乙腈(含内标物3-乙酰氨基苯酚,1 mmol/L)终止反应,并涡旋混匀后放入冰中。4 ℃、20 000 g离心15 min,取上清液再离心1次后,取50 μL上清液转移至进样瓶中。将上清液(10 μL)注入高效液相色谱仪HPLC (Waters 2695,美国沃特世公司)中进行分析。分离柱为Tnature C18[4.6 mm × 250 mm,5 μm,中国华谱科仪(北京)科技有限公司与美国沃特世公司联合出品]。UV检测波长为254 nm,流速为1 mL/min。流动相A和B分别含有1.19 %冰醋酸和甲醇。比例为84%A液和16%B液,进样20 min。通过使用标准曲线定量APAP代谢物APAPG。
1.2.2 达塞布韦对APAP葡萄糖醛酸化的抑制作用研究将10 mmol/L APAP与达塞布韦(0~200 μmol/L)分别在0.5 mg/mL的HLMs或重组UGT1A9反应体系中孵育反应。达塞布韦和APAP溶于DMSO中(终浓度为1%),加入达塞布韦的催化APAP葡萄糖醛酸化活性/空白的活性的百分比值作为Y轴,lg (达塞布韦浓度)的值作为X轴,从而拟合出IC50值来评价药物的抑制作用。
1.2.3 达塞布韦对APAP葡萄糖醛酸化抑制动力学研究根据前期实验结果和文献[6]作为参考,设置底物浓度覆盖其Km值参考范围。另根据前面的抑制作用实验得到的IC50为参考,设置抑制作用药物达塞布韦浓度覆盖IC50值范围。将不同浓度的APAP (5、10、15、或20 mmol/L)和达塞布韦(1、2、4、或8 μmol/L)孵育于HLMs(0.5 mg/mL)或重组UGT1A9(蛋白质终浓度为0.5 mg/mL)。分别利用竞争性抑制公式(1){v = (VmaxS) / (Km (1+[I]/Ki) +S) }、非竞争性抑制公式(2){v = (VmaxS) / (Km+S) (1+[I]/Ki) }、反竞争性抑制公式(3){v= (VmaxS) / (Km+ (1+[I]/Ki) S) }和混合性抑制公式(4){v = (VmaxS) / ((Km (1+[I]/Ki) +S (1+[I]/αKi) }进行数据拟合,判断抑制类型并求得抑制常数Ki。上述公式中,v和Vmax分别表示反应速度和最大反应速度,Km是反应速度为最大反应速度的一半时的底物浓度,Ki是表观抑制常数,表示酶与抑制剂的亲和力,S是底物浓度,[I]是抑制剂浓度。分别利用Lineweaver-Burk作图法和Dixon作图法来直观表现抑制类型及Ki。
1.2.4 计算曲线下面积(area under curve,AUC)比率以定量预测药物相互作用风险度因达塞布韦的抑制而导致的药物相互作用危险度的预测根据存在和不存在抑制剂达塞布韦的情况下APAP的AUC的比率{AUCi/AUC=1/ (fm/ (1+[I]/Ki) + (1-fm) }[13]来进行预测。其中,Ki是从体外实验获得的抑制剂常数;fm是被抑制酶代谢的比例(fm = 0.55) [14],APAP药物主要由UGTs代谢。[I]是酶活性位点上的抑制剂浓度。既往研究[9]表明,在该计算模型中使用[I]in作为参数来评估药物相互作用较为准确。[I]in是最大肝输入药物浓度。有研究[13]表明,用[I]in参数代替[I]参数评估药物相互作用更加准确。计算公式为[I]in =[I]av+kaFaD/Qh。其中,ka是达塞布韦吸收速率常数,其值为0.5 (1/h);Fa是从肠道进入血中的吸收比例,其值为0.7;D代表给药剂量(250 mg/次,2次/d) [15];Qh是肝的血液流速(1 610 mL/min[13]);达塞布韦的ka、Fa参数均能从文献[10]中获取。[I]av是反复口服达塞布韦后系统血浆浓度的平均值。计算公式为[I]av= (D/τ) / (CL/F)。其中,τ代表给药间隔,其值为12 h;CL/F是药物的表观清除率,其值为1 150 L/d[12]。
2 结果 2.1 HLMs中APAP的葡萄糖醛酸化动力学结果显示,HLMs中APAP的葡萄糖醛酸化反应符合米氏方程,米氏常数Km和最大反应速度Vmax分别为(10.84±2.07) mmol/L和(26.20±1.85) pmol·min-1·mg-1 protein。
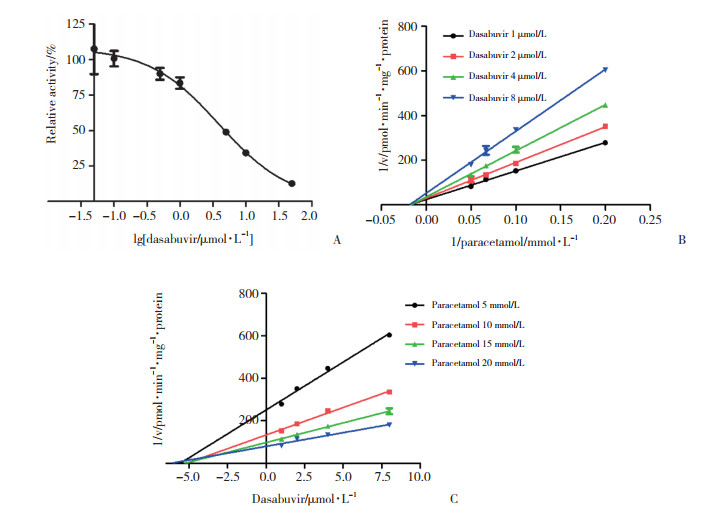
2.2 HLMs中达塞布韦对APAP葡萄糖醛酸化的抑制作用如图 1A所示,随着达塞布韦浓度的增加,温孵体系中APAP葡萄糖醛酸化产物量明显减少,表明达塞布韦对APAP的葡萄糖醛酸化反应具有较强的抑制作用,其IC50值为(3.94±1.29) μmol/L。进一步对抑制动力学实验数据进行非线性回归分析及Lineweaver-Burk作图和Dixon作图。Lineweaver-Burk作图得到图 1B,随着不同抑制物(达塞布韦)浓度的增加,直线的倾斜率增加且交于x轴同一点,由此可知达塞布韦是通过非竞争可逆性抑制机制作用于APTP葡萄糖醛酸化过程的。根据Dixon作图法得到图 1C,可拟合得到其表观抑制常数Ki值为(5.50±0.46) μmol/L。
|
| A, the IC50 plot; B, the Lineweaver-Burk plots of inhibited effect of dasabuvir; C, the Dixon plots of inhibited effect of dasabuvir. All data points shown represent the mean of duplicate measurements. 图 1 人肝微粒体中达塞布韦对APAP葡萄糖醛酸化的抑制作用 Fig.1 The inhibited effect of dasabuviron on paracetamol glucuronidation in pooled HLMs |
2.3 UGT1A9中达塞布韦对APAP葡萄糖醛酸化的抑制作用
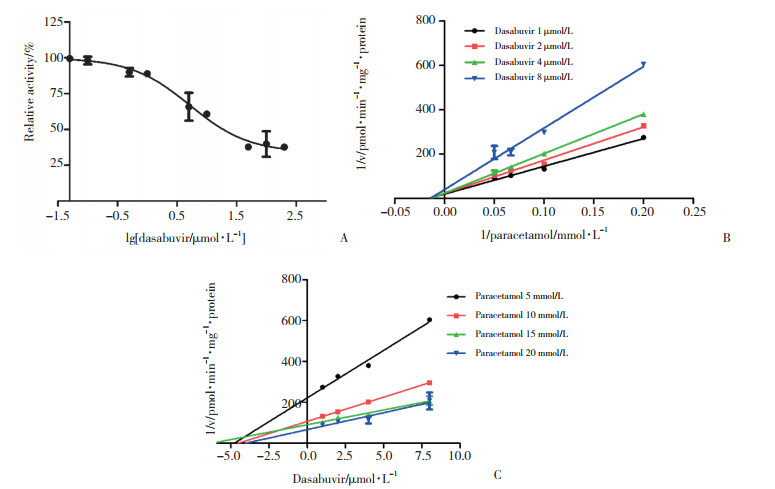
如图 2A所示,在单酶UGT1A9体系中,达塞布韦对APAP的葡萄糖醛酸化具有较强的抑制作用,其IC50值为(5.24±1.26) μmol/L。非线性回归分析及Lineweaver-Burk作图和Dixon作图(图 2B、2C)表明,达塞布韦通过非竞争性的可逆性抑制机制作用于APAP葡萄糖醛酸化过程,Ki值为(4.92±0.46) μmol/L。与HMLs体系中得到的动力学参数相似,表明达塞布韦对APAP葡萄糖醛酸化反应的抑制主要通过抑制UGT1A9完成。
|
| A, the IC50 plot; B, the Lineweaver-Burk plots; C, the Dixon plots. All data points shown represent the mean of duplicate measurements. 图 2 UGT1A9中达塞布韦对APTP葡萄糖醛酸化的抑制作用 Fig.2 The inhibited effect of dasabuvir on paracetamol glucuronidation in UGT1A9 |
2.4 AUC比率
根据查到的参数,结合公式可计算得到反复口服达塞布韦后系统血浆浓度的平均值,即[I]av的值为0.88 μmol/L,并得到最大肝输入药物浓度,即[I]in为2.97 μmol/L。最后,将体外HLMs中达塞布韦对APAP葡萄糖醛酸化的抑制常数(Ki=5.50 μmol/L)带入到公式中,进而得出APAP的AUC的比率(AUCi/AUC)为1.27,即达塞布韦与APAP同时服用时APAP的AUC较单独服用APAP时将增加27%,提示二者联合用药时发生药物相互作用的可能性很大,应当引起重视。
3 讨论达塞布韦对UGTs有抑制作用[10],而APAP又主要由UGTs催化代谢。APAP的毒性与APAP葡萄糖醛酸化抑制程度相关[6],即UGTs活性受到抑制的情况下,APAP葡萄醛酸化物量减少,其母药在体内暴露量增加,毒性增加,这也是APAP导致肝毒性的主要原因之一。因此,当达塞布韦与APAP联合用药时,有可能导致参与APAP代谢的UGTs受到抑制,进而引发不良反应。由于肝内的UGTs有一定的底物特异性,因此,本研究中首先探讨了达塞布韦是否对APAP的葡萄糖醛酸化有影响。HLMs中APAP的葡萄糖醛酸化动力学研究的实验数据表明,本研究测定的Km值和文献[6]报道相近,说明本实验的反应体系中HLMs中的酶活性较好,可进行后续实验。
本研究发现,在HLMs中,达塞布韦对APAP的葡萄糖醛酸化具有较强的非竞争性抑制作用。HLMs中有很多种UGTs亚型[16],在APAP正常发挥药效的血药浓度条件下,UGT1A9对APAP的葡萄糖醛酸化发挥着重要的催化作用[6]。因此,本研究进一步在UGT1A9单酶体系中进行了酶抑制动力研究。结果表明,UGT1A9单酶体系中和HLMs中的结果相似,均为非竞争性抑制,抑制常数Ki也相近,说明HLMs中达塞布韦对APAP的葡萄糖醛酸化的抑制作用主要通过UGT1A9完成。
fm是指底物被参与其代谢的酶代谢的比例(fm = 0.55) [14],参数fm是DDI风险评估的关键参数[17],在很多研究DDI的文献[18-19]中都会引用到该参数。值得注意的是,本研究中药物相互作用预测计算结果仅仅基于达塞布韦对肝中的UGTs的抑制作用,然而,UGT1A9还存在于肝外组织,如肠道、肾脏中[20]。口服药物在达到系统循环前需穿过胃肠道壁,在吸收过程中由于肠和肝而损失药物的过程称为首过效应。因此,若考虑到达塞布韦对肝外组织UGTs的抑制作用,即对首过效应的抑制可能引起血药浓度增高,其AUC比率会更高。另外,用于计算血药浓度的药代动力学参数是采用人群的平均值参数,但个体间的变异性很高,某些个体中达塞布韦血药浓度更高[21]。此外,APAP的最大血药浓度(Cmax)可以因空腹摄入而增加1.72倍[22],且有研究[23]表明体外数据倾向于低估体内药物葡萄糖醛酸化的抑制作用。综上所述,临床上由于达塞布韦对UGTs的抑制作用,APAP的AUC增加的结果应当比计算预测的更多,特别是对于一些达塞布韦血液浓度较高的人。根据公式(1)预测得到AUC将是原来的1.27倍,而美国食品药品监督管理局(Food and Drug Administration,FDA)规定预测的AUC比率在0.8~1.25就应当进行体内实验的初筛标准。因此,达塞布韦与APAP联用时,在体内可能会使APAP的AUC增加而产生肝毒性,应引起临床医生的警惕。
尽管已有研究[24-25]预测体内抑制药物相互作用的危险度,但从体外数据外推到体内药物相互作用的结果仍需谨慎对待。体内的药物代谢受各种因素影响,如与体内大分子蛋白的结合、药物分子一系列的转运蛋白和代谢酶的情况都可影响药物浓度的估算。另外,不同于已有大量报道的细胞色素P (cytochrome,CYP) 450酶介导的药物相互作用,现在对由于UGTs抑制或诱导引发的药物相互作用的研究[13]较少,不便于通过数据统计分析推导出更适合UGTs介导的药物相互作用模型。因此,为了进一步确定达塞布韦与APAP联用是否会引起APAP肝毒性的发生,仍需进一步的体内研究。而FDA只考虑到CYP和转运体介导的药物相互作用,忽略了UGTs介导的药物相互作用。本研究结果作为一个初筛,为临床医生的安全合理用药提供理论建议。在临床中,当达塞布韦与APAP联用时,需留意监测服药者的APAP的血药浓度以免发生药物的不良反应。
| [1] |
WONG A, GRAUDINS A. Risk prediction of hepatotoxicity in paracetamol poisoning[J]. Clin Toxicol, 2017, 55(8): 879-892. DOI:10.1080/15563650.2017.1317349 |
| [2] |
LINAKIS MW, COOK SF, KUMAR SS, et al. Polymorphic expression of UGT1A9 is associated with variable acetaminophen glucuronidation in neonates:a population pharmacokinetic and pharmacogenetic study[J]. Clin Pharmacokinet, 2018, 57(10): 1325-1336. DOI:10.1007/s40262-018-0634-9 |
| [3] |
LANCASTER EM, HIATT JR, ZARRINPAR A. Acetaminophen hepatotoxicity: an updated review[J]. Arch Toxicol, 2015, 89(2): 193-199. DOI: 10.1007%2Fs00204-014-1432-2.
|
| [4] |
YANG N, SUN RB, LIAO XY, et al. UDP-glucuronosyltransferases (UGTs) and their related metabolic cross-talk with internal homeostasis:a systematic review of UGT isoforms for precision medicine[J]. Pharmacol Res, 2017, 121: 169-183. DOI:10.1016/j.phrs.2017.05.001 |
| [5] |
RICHES Z, COLLIER AC. Posttranscriptional regulation of uridine diphosphate glucuronosyltransferases[J]. Expert Opin Drug Metab Toxicol, 2015, 11(6): 949-965. DOI:10.1517/17425255.2015.1028355 |
| [6] |
MUTLIB AE, GOOSEN TC, BAUMAN JN, et al. Kinetics of acetaminophen glucuronidation by UDP-glucuronosyltransferases 1A1, 1A6, 1A9 and 2B15. Potential implications in acetaminophen-induced hepatotoxicity[J]. Chem Res Toxicol, 2006, 19(5): 701-709. DOI:10.1021/tx050317i |
| [7] |
KOSTRUBSKY SE, SINCLAIR JF, STROM SC, et al. Phenobarbital and phenytoin increased acetaminophen hepatotoxicity due to inhibition of UDP-glucuronosyltransferases in cultured human hepatocytes[J]. Toxicol Sci, 2005, 87(1): 146-155. DOI:10.1093/toxsci/kfi211 |
| [8] |
LIU Y, RAMÍREZ J, RATAIN MJ. Inhibition of paracetamol glucuronidation by tyrosine kinase inhibitors[J]. Br J Clin Pharmacol, 2011, 71(6): 917-920. DOI:10.1111/j.1365-2125.2011.03911.x |
| [9] |
KATI WM, KOEV G, IRVIN M, et al. In vitro activity and resistance profile of dasabuvir, a nonnucleoside hepatitis C virus polymerase inhibitor[J]. Antimicrob Agents Chemother, 2015, 59(3): 1505-1511. DOI:10.1128/AAC.04619-14 |
| [10] |
SHEBLEY M, LIU JR, KAVETSKAIA O, et al. Mechanisms and predictions of drug-drug interactions of the hepatitis C virus three direct-acting antiviral regimen:paritaprevir/ritonavir, ombitasvir, and dasabuvir[J]. Drug Metab Dispos, 2017, 45(7): 755-764. DOI:10.1124/dmd.116.074518 |
| [11] |
KING JR, ZHA JH, KHATRI A, et al. Clinical pharmacokinetics of dasabuvir[J]. Clin Pharmacokinet, 2017, 56(10): 1115-1124. DOI:10.1007/s40262-017-0519-3 |
| [12] |
MENSING S, ECKERT D, SHARMA S, et al. Population pharmacokinetics of paritaprevir, ombitasvir, dasabuvir, ritonavir and ribavirin in hepatitis C virus genotype 1 infection:analysis of six phaseⅢtrials[J]. Br J Clin Pharmacol, 2017, 83(3): 527-539. DOI:10.1111/bcp.13138 |
| [13] |
ITO K, BROWN HS, HOUSTON JB. Database analyses for the prediction of in vivo drug-drug interactions from in vitro data[J]. Br J Clin Pharmacol, 2004, 57(4): 473-486. DOI:10.1111/j.1365-2125.2003.02041.x |
| [14] |
PRESCOTT LF. Kinetics and metabolism of paracetamol and phenacetin[J]. Br J Clin Pharmacol, 1980, 10(S2): 291S-298S. DOI:10.1111/j.1365-2125.1980.tb01812.x |
| [15] |
FELD JJ, BERNSTEIN DE, YOUNES Z, et al. Ribavirin dose management in HCV patients receiving ombitasvir/paritaprevir/ritonavir and dasabuvir with ribavirin[J]. Liver Int, 2018, 38(9): 1571-1575. DOI:10.1111/liv.13708 |
| [16] |
CHENG Y, TANG SW, CHEN A, et al. Evaluation of the inhibition risk of shikonin on human and rat UDP-glucuronosyltransferases (UGT) through the cocktail approach[J]. Toxicol Lett, 2019, 312: 214-221. DOI:10.1016/j.toxlet.2019.05.017 |
| [17] |
ZHANG HJ, DAVIS CD, SINZ MW, et al. Cytochrome P450 reaction-phenotyping:an industrial perspective[J]. Expert Opin Drug Metab Toxicol, 2007, 3(5): 667-687. DOI:10.1517/17425255.3.5.667 |
| [18] |
UMEHARA K, HUTH F, WON CS, et al. Verification of a physiologically based pharmacokinetic model of ritonavir to estimate drug-drug interaction potential of CYP3A4 substrates[J]. Biopharm Drug Dispos, 2018, 39(3): 152-163. DOI:10.1002/bdd.2122 |
| [19] |
BLANCHARD N, RICHERT L, COASSOLO P, et al. Qualitative and quantitative assessment of drug-drug interaction potential in man, based on Ki, IC50 and inhibitor concentration[J]. Curr Drug Metab, 2004, 5(2): 147-156. DOI:10.2174/1389200043489072 |
| [20] |
MANO ECC, SCOTT AL, HONORIO KM. UDP-glucuronosyltransf-erases:structure, function and drug design studies[J]. Curr Med Chem, 2018, 25(27): 3247-3255. DOI:10.2174/0929867325666180226111311 |
| [21] |
COURT MH, ZHU ZH, MASSE G, et al. Race, gender, and genetic polymorphism contribute to variability in acetaminophen pharmacokinetics, metabolism, and protein-adduct concentrations in healthy African-American and European-American volunteers[J]. J Pharmacol Exp Ther, 2017, 362(3): 431-440. DOI:10.1124/jpet.117.242107 |
| [22] |
MOORE R A, DERRY S, WIFFEN P J, et al. Effects of food on pharmacokinetics of immediate release oral formulations of aspirin, dipyrone, paracetamol and NSAIDs-a systematic review[J]. Br J Clin Pharmacol, 2015, 80(3): 381-388. DOI:10.1111/bcp.12628 |
| [23] |
UCHAIPICHAT V, MACKENZIE PI, ELLIOT DJ, et al. Selectivity of substrate (trifluoperazine) and inhibitor (amitriptyline, androsterone, canrenoic acid, hecogenin, phenylbutazone, quinidine, quinine, and sulfinpyrazone) "probes" for human udp-glucuronosyltransferases[J]. Drug Metab Dispos, 2006, 34(3): 449-456. DOI:10.1124/dmd.105.007369 |
| [24] |
YOSHIDA K, MAEDA K, KONAGAYA A, et al. Accurate estimation of in vivo inhibition constants of inhibitors and fraction metabolized of substrates with physiologically based pharmacokinetic drug-drug interaction models incorporating parent drugs and metabolites of substrates with cluster Newton method[J]. Drug Metab Dispos, 2018, 46(11): 1805-1816. DOI:10.1124/dmd.118.081828 |
| [25] |
UFUK A, KOSA RE, GAO H, et al. In vitro-in vivo extrapolation of OATP1B-mediated drug-drug interactions in cynomolgus monkey[J]. J Pharmacol Exp Ther, 2018, 365(3): 688-699. DOI:10.1124/jpet.118.247767 |
 2020, Vol. 49
2020, Vol. 49