文章信息
- 陈芸, 孙媛媛, 富伟能
- CHEN Yun, SUN Yuanyuan, FU Weineng
- MYCT1通过PRSS21抑制喉癌细胞的增殖和迁移
- MYCT1 inhibits the proliferation and migration of laryngeal carcinoma cells via PRSS21
- 中国医科大学学报, 2020, 49(10): 876-881
- Journal of China Medical University, 2020, 49(10): 876-881
-
文章历史
- 收稿日期:2019-12-05
- 网络出版时间:2020-10-07 15:38
喉癌是发生在喉部的恶性肿瘤,以鳞状细胞癌多见,是耳鼻喉科最常见的恶性肿瘤之一[1]。在我国,喉癌约占全身恶性肿瘤的2.1%,占头颈部肿瘤的13.9%,且发病率仍呈上升趋势[2-4]。喉癌患者以40~60岁为主,在我国东北和华北地区发病率高,且男性发病率高于女性[2-4]。喉癌的发病与吸烟、饮酒、性激素水平、人乳头瘤病毒(human papilloma virus,HPV)感染、职业因素、空气污染等因素有关,其中吸烟和饮酒是主要危险因素[5]。目前,喉癌相关研究虽有很大进展,但其发生发展的分子机制仍不清楚。因此,从分子水平研究喉癌发生发展机制显得尤为重要,为喉癌分子诊治的深入研究提供线索。
MYCT1是本课题组前期发现的与喉癌相关的基因[6]。在喉癌中MYCT1是潜在的抑癌基因,能够抑制喉癌细胞增殖和迁移能力,促进细胞凋亡[7-8]。PRSS21基因编码膜蛋白睾丸素,特异性表达于睾丸[9]。研究[10]发现,PRSS21在肿瘤中参与多种生物学功能的调控。前期本课题组通过iTRAQ技术在稳转MYCT1的喉癌细胞中检测到PRSS21蛋白表达降低,提示PRSS21与喉癌的发生发展相关。本研究拟在喉癌细胞中初步探讨MYCT1对PRSS21表达的影响及其通过PRSS21对喉癌细胞增殖和迁移能力的影响。
1 材料与方法 1.1 材料人喉癌细胞系Hep-2细胞、人口腔角质细胞系HOK细胞购自中国科学院上海生命科学院;喉癌样本来自解放军北部战区空军医院耳鼻喉科;MYCT1过表达载体、空质粒载体购自中国基凯公司;si-MYCT1、si-PRSS21和NC购自中国生工公司;胎牛血清、RPMI 1640培养基购自美国Hyclone公司;RNAiso Plus、Primescript RT reagent Kit购自日本TaKaRa公司;jetPRIME transfection reagent购自法国Polyplus公司;SYBR qPCR Master Mix购自美国Vazyme公司;细胞膜蛋白与细胞浆蛋白抽提试剂盒、SDS-PAGE凝胶配制试剂盒购自中国碧云天公司;BCA蛋白含量检测试剂盒购自中国凯基生物公司;anti-MYCT1 antibody ab107968购自英国abcam公司;alpha Tubulin Mouse Monoclonal antibody、ATP/A/ Rabbit PolyAb购自美国Proteintech公司;PRSS21 antibody购自中国absin公司;Cell Counting Kit-8购自美国bimake公司;1%结晶紫染色液购自中国Solarbio公司。
1.2 方法 1.2.1 细胞培养人喉癌细胞系Hep-2细胞接种于含10%胎牛血清、100 μg/mL青霉素和100 μg/mL链霉素的RPMI 1640完全培养基中,人口腔角质细胞系HOK细胞接种于含10%胎牛血清、100 μg/mL青霉素和100 μg/mL链霉素的DMEM完全培养基中,两者均在5%CO2、37 ℃及饱和湿度的条件下常规培养,待细胞生长至对数生长期时用于实验。
1.2.2 细胞转染转染前1 d,将对数生长期的Hep-2细胞以3×105/孔接种于6孔板中,每孔加入2 mL完全培养基进行培养,当细胞密度达到60%~70%时进行转染。将MYCT1过表达载体、空质粒载体、si-MYCT1、si-PRSS21和NC等分别加入jetPRIME Buffer中,再加入jetPRIME Transfection Reagen配制转染混合液,涡旋10 s室温孵育10 min。将孵育好的混合液加入6孔板中,混匀,培养6 h后更换RPMI 1640完全培养基继续培养,48 h后收取细胞用于实时PCR检测,72 h后收取细胞用于Western blotting检测。
过表达MYCT1实验分组为空载体对照组和MYCT1组;干扰MYCT1实验分组为NC对照组和si-MYCT1组;细胞功能实验分组为NC对照组、si-PRSS21组、si-MYCT1组和si-MYCT1 +si-PRSS21共转染组。
1.2.3 实时PCR检测取细胞、喉癌组织和癌旁组织,提取总RNA并检测RNA纯度和浓度。使用反转试剂盒配置反转体系将RNA反转为cDNA,反应条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃ +∞。以cDNA为模板按照SYBR qPCR Master Mix配置扩增体系,进行实时PCR,反应条件为95 ℃ 30 s,95 ℃ 5 s、60 ℃ 34 s,共40个循环,溶解曲线分析:65~95 ℃。结果用2-ΔΔct法计算并用相对定量表示。实时PCR引物序列见表 1,GAPDH为内参基因。
| Name | Primer sequence (5’-3’) |
| MYCT1 | F:GCCAGAAAACTTTTGGGAGGA |
| R:ATCCAGTTCTGTTGAGGCCG | |
| PRSS21 | F:GCGCACTGCTTTGAAACTGA |
| R:ACTCAAATGTGGAGGCCTGG | |
| GAPDH | F:CATGTTCGTCATGGGTGTGAACC |
| R:GGTCATGAGTCCTTCCACGATACC |
1.2.4 Western blotting检测
取细胞、喉癌组织和癌旁组织,用细胞膜蛋白与细胞浆蛋白抽提试剂盒提取浆蛋白和膜蛋白。测定蛋白浓度后,在蛋白中加入上样缓冲液,100 ℃煮10 min使蛋白变性。配制10%分离胶和5%浓缩胶,取20 μg蛋白样品进行SDS-PAGE琼脂糖凝胶电泳。在4 ℃、200 mA恒流条件下转膜1 h。用5%脱脂牛奶室温封闭2 h。一抗4 ℃孵育过夜、二抗37 ℃孵育1 h后,用超敏ECL化学发光试剂盒发光显影,对结果进行灰度分析。
1.2.5 CCK-8检测细胞增殖实验细胞转染6 h后,用胰酶消化细胞重悬成浓度为5×104/mL的细胞悬液,将其接种于96孔板中,每孔100 μL,每组设置5个复孔。常规培养一定时间(24 h、48 h和72 h)后,每孔加入10 μL CCK-8溶液,继续孵育2 h,用酶标仪测定450 nm处的光密度,并绘制曲线图。
1.2.6 克隆形成实验细胞转染6 h后,用胰酶消化细胞重悬成细胞悬液,将其接种于6孔板中,3×103/孔,并添加2 mL完全培养基。将6孔板放入培养箱中继续培养。当细胞团中细胞个数达到50时停止培养,甲醇固定30 min,0.1%结晶紫染色20 min,自来水侧面冲洗干净,拍照计数。
1.2.7 划痕实验待转染细胞长满后,用200 μL无菌移液枪枪头在6孔板中画直线,用磷酸缓冲液洗去划落的细胞,并拍照记录。加入无血清和抗生素的培养基继续培养24 h后,再次拍照记录,计算细胞迁移距离。
1.3 统计学分析采用SPSS 22.0软件进行统计分析,数据均以x±s表示。2组间的比较采用t检验,多组间的比较采用单因素方差分析,P < 0.05为差异有统计学意义,实验均重复3次以上。
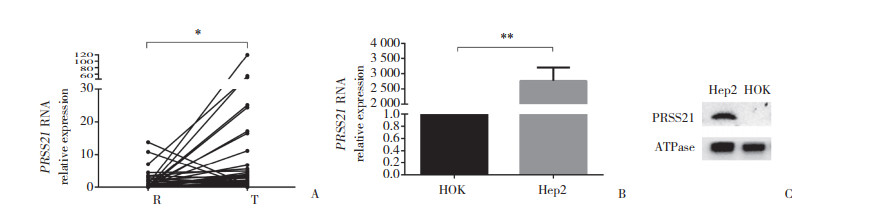
2 结果 2.1 PRSS21在喉癌中高表达采用实时PCR和Western blotting检测44例喉癌样本和细胞中PRSS21的表达情况。实时PCR结果显示,喉癌组织中PRSS21的表达水平显著高于癌旁组织,差异有统计学意义(P = 0.026 6),见图 1A;喉癌细胞Hep-2细胞中PRSS21的表达水平显著高于口腔角质细胞HOK细胞,差异有统计学意义(P = 0.008 0),见图 1B。Western blotting结果显示,PRSS21在口腔角质细胞HOK细胞中不表达,在喉癌细胞Hep-2细胞中高表达,差异有统计学意义(P = 0.037 4),见图 1C。
|
| A, relative expression of PRSS21 mRNA in Hep-2 cells and HOK cells; B, relative expression of PRSS21 mRNA in laryngeal carcinoma tissues; C, PRSS21 protein expression in Hep-2 cells and HOK cells. *P < 0.05 vs para-carcinoma tissues; **P < 0.01 vs HOK group. 图 1 PRSS21在喉癌中的表达情况 Fig.1 Expression of PRSS21 in Laryngeal carcinoma |
2.2 MYCT1抑制PRSS21在喉癌细胞中的表达
采用实时PCR和Western blotting检测转染细胞中MYCT1和PRSS21表达水平变化。结果显示,与对照组空载体相比,MYCT1组Hep-2细胞中MYCT1表达明显升高(P = 0.005 4和P = 0.010 4),但PRSS21表达降低(P = 0.031 5和P = 0.046 8),差异有统计学意义,见图 2A、B。与对照组NC相比,si-MYCT1组Hep-2细胞中MYCT1表达明显降低(P = 0.034 7和P = 0.037 5),但PRSS21表达升高(P = 0.044 9和P = 0.024 2),差异有统计学意义,见图 2C、D。

|
| A, relative expression of MYCT1 and PRSS21 mRNA in Hep-2 cells transfected with MYCT1 or vector; B, relative expression of MYCT1 and PRSS21 protein in Hep-2 cells transfected with MYCT1 or vector; C, relative expression of MYCT1 and PRSS21 mRNA in Hep-2 cells transfected with si-MYCT1 or NC; D, relative expression of MYCT1 and PRSS21 protein in Hep-2 cells transfected with si-MYCT1 or NC. *P < 0.05, **P < 0.01 vs vector group, #P < 0.05 vs NC group. 图 2 MYCT1对Hep-2细胞中PRSS21表达的影响 Fig.2 Effect of the modulation of MYCT1 on the expression of PRSS21 in Hep-2 cells |
2.3 MYCT1通过PRSS21抑制喉癌细胞的增殖能力
CCK-8实验结果显示,与对照组NC比,si-MYCT1组Hep-2细胞在培养24 h、48 h和72 h后增殖能力显著增强,差异有统计学意义(P = 0.046 2,P = 0.027 4和P = 0.019 6);si-PRSS21组Hep-2细胞在培养24 h、48 h和72 h后增殖能力显著减弱,差异有统计学意义(P = 0.034 2,P = 0.021 9和P = 0.036 2),见图 3A。si-PRSS21 +si-MYCT1组回复实验结果表明,PRSS21逆转了MYCT1对喉癌细胞增殖能力的影响,差异有统计学意义(P = 0.035 2,P = 0.048 6和P = 0.020 5),见图 3A。

|
| A, results of the CCK-8 assay; B, results of the clone formation assay. *P < 0.05 vs NC group, #P < 0.05 vs si-MYCT1 group. 图 3 MYCT1通过PRSS21对Hep-2细胞增殖和克隆形成能力的影响 Fig.3 Effect of MYCT1 on the PRSS21-mediated proliferation and colony formation of laryngeal cancer cells |
克隆形成实验结果显示,与对照组NC比,si-MYCT1组Hep-2细胞克隆形成数目显著增加,差异有统计学意义(P = 0.025 1);si-PRSS21组Hep-2细胞克隆形成数目显著减少,差异有统计学意义(P = 0.038 6),见图 3B。si-PRSS21 +si-MYCT1组回复实验结果表明,PRSS21逆转了MYCT1对喉癌细胞克隆形成的影响,差异有统计学意义(P = 0.018 5),见图 3B。上述结果表明,MYCT1可通过PRSS21显著抑制喉癌细胞的增殖能力。
2.4 MYCT1通过PRSS21抑制喉癌细胞的迁移能力划痕实验结果显示,与对照组NC比,si-MYCT1组Hep-2细胞在培养24 h后迁移能力显著增强,差异有统计学意义(P = 0.014 2);si-PRSS21组Hep-2细胞在培养24 h后迁移能力显著减弱,差异有统计学意义(P = 0.042 7),见图 4。si-PRSS21 +si-MYCT1组回复实验结果表明,PRSS21逆转了MYCT1对喉癌细胞迁移能力的影响,差异有统计学意义(P = 0.027 7),见图 4。上述结果表明,MYCT1可通过PRSS21显著抑制喉癌细胞迁移能力。

|
| A, results of the scratch assay (×50);B, quantitative results of the scratch assay. *P < 0.05 vs NC group; #P < 0.05 vs si-MYCT1 group. 图 4 MYCT1通过PRSS21对Hep-2细胞迁移能力的影响 Fig.4 Effect of MYCT1 on the PRSS21-mediated migration of laryngeal cancer cells |
3 讨论
近年来,我国喉癌的发病率不断上升[2-4]。喉癌是头颈部最常见的恶性肿瘤之一,研究影响喉癌生物学功能的基因对喉癌的诊断和治疗具有重要意义。
研究[9]表明,PRSS21具有组织特异性,发挥促进或抑制肿瘤发生发展的作用。PRSS21正常表达于减数分裂前睾丸生殖细胞,在睾丸生殖细胞肿瘤中不表达,PRSS21是睾丸肿瘤发生的抑制因子[11-12]。PRSS21在其他正常组织中表达水平很低或不表达,在卵巢癌、宫颈癌、胃癌等多种不同来源的肿瘤中高表达,发挥促癌作用[9, 13-16]。TANG等[10]证明PRSS21促进上皮细胞恶性转变,抑制肿瘤细胞凋亡,促进肿瘤细胞生长,诱导体内肿瘤形成。DRIESBAUGH等[16]发现,PRSS21激活蛋白酶激活受体PAR-2,影响下游信号通路,抑制卵巢肿瘤细胞的凋亡。YEOM等[15]首次证明,在宫颈癌中PRSS21阻断maspin介导的细胞死亡途径,增加细胞的侵袭和迁移,从而促进了肿瘤的发生。然而PRSS21与喉癌的关系尚未见报道。
本研究利用实时PCR和Western blotting检测PRSS21在正常和喉癌细胞及组织中的表达水平,结果发现PRSS21在正常细胞或组织中不表达或低表达,在喉癌细胞或组织中显著高表达。随后利用CCK-8、克隆形成和划痕实验检测PRSS21对喉癌细胞生物功能的影响,结果显示,PRSS21能显著促进喉癌细胞的增殖和迁移。由此推测PRSS21在喉癌中发挥促癌作用。研究[8-9]发现,MYCT1在喉癌中发挥抑癌作用。进一步结果表明,MYCT1抑制喉癌细胞中PRSS21的表达,继而抑制喉癌细胞的增殖和迁移能力。
在正常细胞中,启动子甲基化是调控基因表达的重要机制。而在肿瘤细胞中,异常启动子甲基化或去甲基化可导致基因异常表达。PRSS21基因启动子区包含5个CpG岛和5个CpG富集区域,容易被甲基化[9]。KAWANO等[11]首次证实在睾丸生殖细胞肿瘤中PRSS21因启动子高甲基化表达沉默。随后KEMPKENSTEFFEN等[12]发现了PRSS21基因沉默涉及的异常甲基化CpG位点。本课题组通过iTRAQ技术在稳转MYCT1的喉癌细胞中检测到METTL7A蛋白表达增加和MBD4蛋白质表达减少(数据未出示)。METTL7A是一种甲基转移酶,促进基因启动子甲基化;MBD4是与甲基- CpG结合域(MBD)有关的核蛋白家族的成员,能够特异性结合甲基化DNA,抑制基因启动子甲基化。由此推测MYCT1可能通过促进PRSS21启动子甲基化从而抑制其表达,进而影响喉癌细胞生物学功能,但有待进一步研究证实。
综上所述,本研究首次证明了MYCT1通过抑制PRSS21的表达抑制喉癌细胞的增殖和迁移能力。该研究结果有助于为MYCY1通过PRSS21参与喉癌发生发展分子机制的深入研究奠定理论基础。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA:A Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
CHEN WQ, ZHENG RS, BAADE PD, et al. Cancer statistics in China, 2015[J]. CA:A Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [3] |
LI HZ, WANG YQ, ZHU C, et al. Incidence and mortality of laryngeal cancer in Zhejiang cancer registry, 2000-2011[J]. J Cancer Res Ther, 2015, 11 Suppl 2: C155-C160. DOI:10.4103/0973-1482.168177 |
| [4] |
ZHANG SS, XIA QM, ZHENG RS, et al. Laryngeal cancer incidence and mortality in China, 2010[J]. J Cancer Res Ther, 2015, 11(Suppl 2): C143-C148. DOI:10.4103/0973-1482.168175 |
| [5] |
MARUR S, FORASTIERE AA. Head and neck squamous cell carcinoma:update on epidemiology, diagnosis, and treatment[J]. Mayo Clin Proc, 2016, 91(3): 386-396. DOI:10.1016/j.mayocp.2015.12.017 |
| [6] |
邱广斌, 邱广蓉, 徐振明, 等. 6q25区域内一个新基因MTLC的克隆及特性分析[J]. 中华医学遗传学杂志, 2003, 20(2): 94-97. DOI:10.3760/j.issn:1003-9406.2003.02.002 |
| [7] |
WANG HT, TONG X, ZHANG ZX, et al. MYCT1 represses apoptosis of laryngeal cancerous cells through the MAX/miR-181a/NPM1 pathway[J]. FEBS J, 2019, 286(19): 3892-3908. DOI:10.1111/febs.14942 |
| [8] |
ZHANG ZX, ZHANG WN, SUN YY, et al. CREB promotes laryngeal cancer cell migration via MYCT1/NAT10 axis[J]. Oncotargets Ther, 2018, 11: 1323-1331. DOI:10.2147/OTT.S156582 |
| [9] |
HOOPER JD, BOWEN N, MARSHALL H, et al. Localization, expression and genomic structure of the gene encoding the human serine protease testisin[J]. Biochim Biophys Acta, 2000, 1492(1): 63-71. DOI:10.1016/s0167-4781(00)00071-3 |
| [10] |
TANG T, KMET M, CORRAL L, et al. Testisin, a glycosyl-phosphatidylinositol-linked serine protease, promotes malignant transformation in vitro and in vivo[J]. Cancer Res, 2005, 65(3): 868-878. |
| [11] |
KAWANO N, KANG W, YAMASHITA M, et al. Mice lacking two sperm serine proteases, ACR and PRSS21, are subfertile, but the mutant sperm are infertile in vitro[J]. Biol Reprod, 2010, 83(3): 359-369. DOI:10.1095/biolreprod.109.083089 |
| [12] |
KEMPKENSTEFFEN C, CHRISTOPH F, WEIKERT S, et al. Epigenetic silencing of the putative tumor suppressor gene testisin in testicular germ cell tumors[J]. J Cancer Res Clin Oncol, 2006, 132(12): 765-770. DOI:10.1007/s00432-006-0124-6 |
| [13] |
CONWAY GD, BUZZA MS, MARTIN EW, et al. PRSS21/testisin inhibits ovarian tumor metastasis and antagonizes proangiogenic angiopoietins ANG2 and ANGPTL4[J]. J Mol Med, 2019, 97(5): 691-709. DOI:10.1007/s00109-019-01763-3 |
| [14] |
YEOM SY, JANG HL, LEE SJ, et al. Interaction of testisin with maspin and its impact on invasion and cell death resistance of cervical cancer cells[J]. FEBS Lett, 2010, 584(8): 1469-1475. DOI:10.1016/j.febslet.2010.02.072 |
| [15] |
SONG W, LIU YY, PENG JJ, et al. Identification of differentially expressed signatures of long non-coding RNAs associated with different metastatic potentials in gastric cancer[J]. J Gastroenterol, 2016, 51(2): 119-129. DOI:10.1007/s00535-015-1091-y |
| [16] |
DRIESBAUGH KH, BUZZA MS, MARTIN EW, et al. Proteolytic activation of the protease-activated receptor (PAR) -2 by the glycosylphosphatidylinositol-anchored serine protease testisin[J]. J Biol Chem, 2015, 290(6): 3529-3541. DOI:10.1074/jbc.M114.628560 |
 2020, Vol. 49
2020, Vol. 49