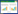文章信息
- 向莉伟, 郑华川
- XIANG Liwei, ZHENG Huachuan
- 卵巢癌中REG4的表达及其作用机制
- The clinicopathological significance and molecular mechanism of REG4 expression in ovarian cancer
- 中国医科大学学报, 2020, 49(10): 865-870
- Journal of China Medical University, 2020, 49(10): 865-870
-
文章历史
- 收稿日期:2019-07-10
- 网络出版时间:2020-10-08 7:01
卵巢癌的发病率居妇科恶性肿瘤第3位,病死率居首位。卵巢癌起病隐匿,缺乏早期的典型症状和成熟的早期诊断方法,且易于盆腹腔广泛种植播散,80%~85%患者还会出现复发和转移,5年生存率仅为35%~38%[1]。因此,提高对卵巢癌发生过程中基因表达变化的认识,识别新的癌症诊断生物标志物和新的治疗靶点,明确相关分子机制,可能有助于提高诊断、治疗和预防水平。再生基因(regenerating gene,REG)家族属于钙依赖性凝集素超家族,这些蛋白在功能上类似于凝集素,具有抗凋亡因子作用,REG基因编码分泌蛋白,在糖尿病、炎症损伤自身免疫和癌瘤发生中起重要作用[2]。随着对癌症发生、发展及其机制研究的不断深入,已有文献报道再生基因4(regenerating gene family member 4,REG4)在肿瘤细胞中高表达,对肿瘤的发展、治疗和预后产生重要影响,但关于卵巢癌中REG4的表达及其分子机制少见报道。本研究旨在观察REG4在卵巢癌中的作用及其分子机制。
1 材料与方法 1.1 材料pcDNA3.1-REG4表达质粒由日本东北大学再生先进生物科学系SUGAWARA教授提供;卵巢癌SKOV3细胞系购自美国ATCC公司;细胞培养试剂购自美国Gibco公司;细胞转染试剂、RNA提取试剂盒购自德国Qiagen公司;实时PCR、SYBR Premix Ex TaqTM Ⅱ、反转录酶、随机引物购自日本TaKaRa公司;REG4抗体购自美国R & D公司;FITC/PI试剂盒购自中国凯基公司;Transwell小室购自美国BD公司。
1.2 方法 1.2.1 基因表达分析UCSC Xena数据库集合了包括癌症基因组图谱(The cancer genome atlas,TCGA)、国际肿瘤基因组协作组(International Cancer Genome Consortium,ICGC)、基因型-组织表达数据库(Genotype-Tissue Expression,GTEx)、癌细胞系百科全书(Cancer Cell Line Encyclopedia,CCLE)等在内大约200个公共数据集,进入UCSC Xena (http://xena.ucsc.edu)网页调取TCGA、TARGET、GTEx数据库,选择sample type和ovary,输入REG4,选择Gene Expression,对REG4在卵巢的mRNA表达进行分析。调取TCGA数据库,选择sample type和ovary,再选择REG4和感兴趣的基因,分析REG4与该基因在mRNA表达水平上的关系。
1.2.2 生存分析使用Kaplan-Meier Plotter (http://www.kmplot.com)评估REG4 mRNA表达对卵巢癌预后的影响。Kaplan-Meier Plotter分析各亚型卵巢癌患者的总体生存率、无进展生存率和后进展生存率与REG4 mRNA表达的关系。
1.2.3 细胞培养、转染和质粒鉴定卵巢癌SKOV3细胞接种于含10%胎牛血清的McCoy’s 5A培养基中常规培养。取对数生长期的SKOV3细胞接种于6 cm2培养盘,待融合度达60%左右,PBS冲洗1次,加入200 μL无血清培养基。将2.4 μg质粒和9 μL转染试剂分别加入到200 μL无血清培养基,37 ℃孵育15 min后加入到培养盘中,500 mg/L遗传霉素(geneticin,G418)筛选单克隆细胞株,实时PCR、Western blotting检测REG4表达水平,取REG4高表达单克隆细胞株用于后续实验。将稳定转染pcDNA3.1-REG4的细胞株作为过表达REG4组,稳定转染pcDNA3.1空载体的细胞作为Mock组。
1.2.4 实时PCR检测取2组对数生长期细胞,根据QIAGEN RNase minikit说明书提取总RNA,使用禽骨髓母细胞瘤病毒逆转录酶和随机引物对总RNA进行cDNA合成。按照SYBR Premix Ex TaqTM Ⅱ试剂盒说明书配制体系进行实时PCR反应。REG4基因扩增引物:上游5’-TAACTTGGAGCAGCAACGAATG-3’,下游5’-GGCTAGCAGAAAGGAAGAGGA-3’;内参GAPDH引物:上游5’-CAATGACCCCTTCATTGACC-3’,下游5’-TGGAAGATGGTGATGGGATT-3’。反应条件:94 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min,共34个循环。采用2-ΔΔCt法计算mRNA的相对表达量。
1.2.5 Western blotting用RIPA裂解液中提取卵巢癌和转染细胞总蛋白,并测定蛋白浓度。按浓度稀释后95 ℃ 5 min变性。变性蛋白进行聚丙烯酰胺凝胶电泳后转膜,于5%脱脂牛奶中室温封闭1 h,加入2 mL抗REG4抗体(美国R & D公司),4 ℃反应过夜。二抗采用HRP标记的羊抗兔的IgG,室温反应1 h,ECL-Plus试剂盒发光显影检测目的蛋白。
1.2.6 MTT法检测细胞增殖能力:将细胞接种于96孔板(2×103/孔),每组设3个复孔,并设3个空白对照孔,常规培养。待细胞贴壁后,分别在0、24、48 h加入20 μL MTT溶液,孵育4 h后弃掉液体,并每孔加入150 μL DMSO溶解,震荡10 min,用酶标仪测定各组490 nm处吸光度值并计算增殖率,以时间为横轴、增殖率为纵轴绘制上涨曲线。
1.2.7 细胞凋亡检测取处于对数生长期的2组细胞,收集细胞和上清液,PBS冲洗2次,用Annexin V-FITC结合缓冲液重悬至单细胞悬液,并调整其浓度为1×106/mL。加入5 μL Annexin V-FITC染料,室温避光孵育15 min,再加入5 μL碘化丙啶染料孵育5 min,上流式细胞仪检测分析。
1.2.8 Transwell细胞侵袭实验取处于对数生长期的2组细胞,以无血清培养基调整细胞浓度为2.5×105/mL后接种于预先涂有基质胶的Transwell小室上层,下室加入含10%胎牛血清的培养基作为化学引诱物。24 h后用棉球擦掉上层未迁移的细胞,PBS清洗小室,黏附在下层膜的细胞经4%多聚甲醛固定并用结晶紫溶液染色,光学显微镜下(×100)选取5个随机区域照相。
1.2.9 基因富集分析从TCGA公共数据库收集卵巢癌、REG4基因数据,进行基因集富集分析,探讨REG4在卵巢癌发生发展中的作用和机制。
1.3 统计学分析采用SPSS 17.0软件进行统计分析。满足正态性检验的计量资料以x±s表示,采用单因素方差分析进行多组间比较,进一步两两比较采用SNK-q检验。不满足正态分布者以M (P25~P75)表示,多组间比较采用非参数秩和检验。2组独立样本比较采用独立样本t检验,结果用3次独立实验的x±s表示。P < 0.05为差异有统计学意义。
2 结果 2.1 基因表达分析 2.1.1 REG4在卵巢癌组织中的表达收集515例样本,其中正常卵巢组织88例,原位卵巢癌419例,复发性卵巢癌8例,分析REG4的表达。与正常卵巢组织相比(均值=0),REG4 mRNA表达水平在卵巢癌中上调(均值=1.56),在复发性卵巢癌中更高(均值=2.35) (P < 0.001)。见图 1。
|
| 图 1 REG4在卵巢癌组织中的表达 Fig.1 Expression of REG4 in ovarian cancer tissues |
2.1.2 REG4相关基因表达
REG4的表达与Bid (r = -0.203,P < 0.001)、Fas (r = -0.171,P < 0.001)、AIF1(r = -0.272,P < 0.001)等凋亡因子的表达呈明显负相关,而与细胞周期蛋白依赖激酶CDK4 (r = 0.205,P < 0.001)、抑凋亡因子Bcl-2 (r = 0.204,P < 0.001)、促增殖因子Raf (r = 0.118,P = 0.039)和药物代谢相关酶ALDH1A1 (r = 0.121,P = 0.036)、GSTA1 (r = 0.175,P = 0.002)、GSTA2 (r = 0.201,P < 0.001)、UGT2A3 (r = 0.192,P < 0.001)的表达呈正相关。
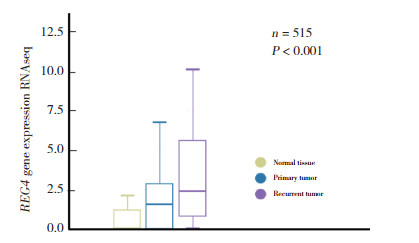
2.2 REG4 mRNA表达与卵巢癌患者生存率的关系 2.2.1 REG4 mRNA表达与所有卵巢癌患者生存率的关系Kaplan-Meier Plotter分析结果显示,REG4 mRNA的高表达与所有卵巢癌患者的总体生存率、无进展生存率和后进展生存率降低相关,见图 2。
|
| 图 2 Kaplan-Meier曲线分析REG4mRNA表达与卵巢癌患者总体生存率、无进展生存率和后进展生存率的关系 Fig.2 The correlation between REG4expression and overall, progression-free, and post-progression survival rates of the ovarian cancer patients according to Kaplan-Meier curve |
2.2.2 REG4 mRNA表达与亚组卵巢癌患者生存时间的关系
组织学分型浆液性卵巢癌、临床分期Ⅰ~Ⅳ期和病理分级Ⅱ~Ⅲ级的卵巢癌患者的总体生存率与REG4 mRNA的表达量呈负相关;组织学分型浆液性卵巢癌,临床分期Ⅰ、Ⅲ、Ⅳ期和病理分级Ⅲ级的卵巢癌患者的无进展生存率与REG4 mRNA的表达量呈负相关;临床分期Ⅲ期、病理分级Ⅱ级的卵巢癌患者的后进展生存率与REG4 mRNA的表达量呈负相关;其余亚组的卵巢癌患者的总体生存率、无进展生存率和后进展生存率与REG4 mRNA的表达量均不相关。见表 1。
| Clinicopathological feature | Overall survival rate | Progression-free survival rate | Post-progression survival rate | |||||
| Hazard ratio | Log rank P | Hazard ratio | Log rank P | Hazard ratio | Log rank P | |||
| Histology | ||||||||
| Endometrioid | 6.32(0.66-60.85) | 0.067 | 0.47(0.15-1.41) | 0.167 | - | - | ||
| Serous | 1.45(1.16-1.82) | 0.001 | 1.58(1.26-1.97) | < 0.001 | 1.27(0.99-1.64) | 0.063 | ||
| Clinical stage | ||||||||
| Ⅰ | 6.70(1.35-33.30) | 0.007 | 4.15(1.16-14.92) | 0.018 | - | - | ||
| Ⅱ | 0.20(0.04-0.92) | 0.022 | 0.44(0.14-1.35) | 0.139 | 3.56(0.37-34.35) | 0.241 | ||
| Ⅲ | 1.45(1.13-1.87) | 0.003 | 1.44(1.15-1.81) | 0.002 | 1.40(1.97-1.82) | 0.012 | ||
| Ⅳ | 1.99(1.03-3.85) | 0.036 | 2.06(1.20-3.53) | 0.008 | 1.68(0.82-3.43) | 0.149 | ||
| Pathological grade | ||||||||
| Ⅰ | 1.83(0.63-5.28) | 0.260 | 5.19(0.65-41.50) | 0.083 | - | - | ||
| Ⅱ | 1.70(1.07-2.68) | 0.022 | 0.80(0.56-1.15) | 0.227 | 1.70(1.05-2.76) | 0.030 | ||
| Ⅲ | 1.29(1.00-1.66) | 0.046 | 1.48(1.14-1.92) | 0.003 | 1.24(0.90-1.71) | 0.186 | ||
| Ⅳ | 2.01(0.67-6.04) | 0.205 | - | - | - | - | ||
2.3 过表达REG4的SKOV3细胞表型
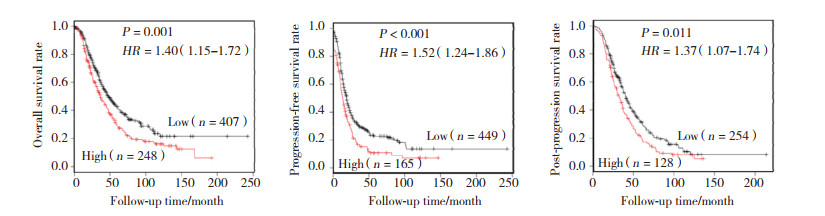
通过G418筛选,成功获得了稳定高表达REG4的单克隆细胞株SKOV3。实时PCR结果显示,过表达REG4组细胞REG4 mRNA的表达水平明显高于Mock组(P < 0.001),Western blotting结果表明,REG4组细胞REG4蛋白的表达水平明显高于Mock组(P < 0.05),表明其已稳定高表达REG4。见图 3A。
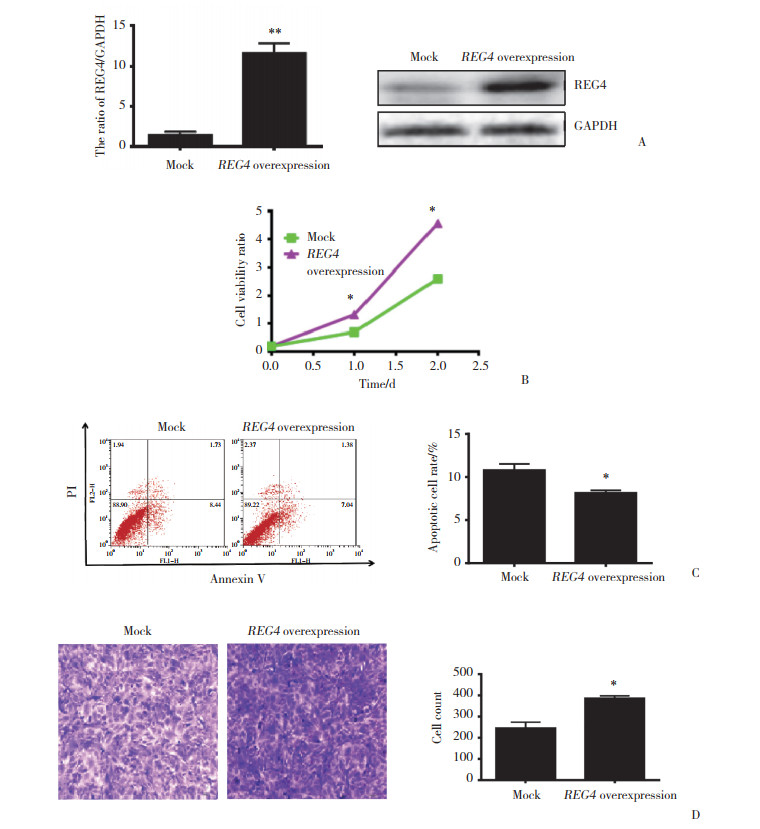
|
| A, confirmation of REG4 transfectants; B, effect of REG4 overexpression on the proliferation of SKOV3 cells; C, effect of REG4 overexpression on apoptosis of SKOV3 cells; D, effects of REG4 overexpression on the invasion of SKOV3 cells (×100). * P < 0.01 vs mock group; ** P < 0.001 vs mock group. 图 3 REG4过表达对卵巢癌恶性细胞表型的影响 Fig.3 The effects of REG4overexpression on the aggressive phenotypes of ovarian cancer cells |
MTT结果显示,过表达REG4的SKOV3增殖能力明显高于Mock组(P < 0.05),表明REG4过表达可促进卵巢癌细胞SKOV3的增殖能力。见图 3B。
流式细胞仪结果显示,REG4过表达的卵巢癌细胞SKOV3凋亡减少(P < 0.05),表明过表达REG4可抑制卵巢癌细胞SKOV3的凋亡。见图 3C。
Transwell结果显示,过表达REG4的SKOV3穿膜细胞数量明显高于Mock组(P < 0.05),表明REG4过表达可促进卵巢癌细胞SKOV3的侵袭能力。见图 3D。
2.4 基因富集分析REG4在凋亡和药物代谢细胞色素P450相关基因中富集。且REG4与凋亡相关基因呈明显负相关,而与药物代谢细胞色素P450相关基因呈正相关。见图 4。
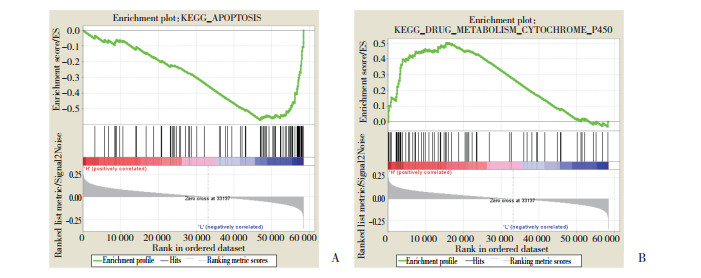
|
| A, apoptosis (P < 0.001;false discovery rate = 0.053;enrichment score =-0.571);B, drug metabolism cytochrome P450 (P = 0.002;false discovery rate =0.268;enrichment score = 0.503). 图 4 依据KEGG的REG4表达相关基因富集的信号传导通路分析 Fig.4 Signal pathway analysis of REG4-related genes according to KEGG |
3 讨论
人REG4基因定位于染色体1q12-q21,编码158个核苷酸,蛋白分子量为17 000[2]。本研究发现,REG4 mRNA在卵巢癌组织中表达升高,在胃癌、结直肠癌、大肠癌、胰腺导管腺癌等多种人类恶性肿瘤中均发现REG4 mRNA和蛋白表达升高[3-4],提示REG4表达上调参与人类恶性肿瘤的发生。人卵巢癌细胞SKOV3过表达REG4蛋白后,细胞增殖增强,凋亡抑制。BISHNUPURI等[5]发现,REG4蛋白激活Akt/GSK3β/β-Catenin/TCF-4和EGF受体/Akt/AP-1信号通路,增加细胞周期调控基因Cyclin D1和Cyclin D3以及相关的周期蛋白依赖性激酶(CDK4和CDK6)的表达,从而促进肿瘤细胞增殖。生物信息分析发现,REG4与周期蛋白依赖性激酶CDK4的表达呈正相关,同时基因富集结果显示,REG4相关基因抑制凋亡信号通路,且REG4的表达与Bid、Fas、AIF1等凋亡因子的表达呈负相关,与抑凋亡因子Bcl-2的表达呈正相关。BISHNUPURI等[5]的研究也证明了REG4处理结直肠癌细胞后,Bcl-2、Bcl-XL和Survivin蛋白表达增加,表明REG4能够通过调节细胞增殖和凋亡参与肿瘤发生。
卵巢癌患者的生存与卵巢癌的复发和转移密切相关。生存分析显示,亚临床分型和分级的卵巢癌中,REG4表达水平与患者生存率呈负相关。OUE等[6]发现,大肠癌中REG4的表达与肿瘤分期相关,Ⅲ/Ⅳ期大肠癌中REG4表达频率高于Ⅰ/Ⅱ期,且直肠癌与肿瘤的TNM分期、淋巴结转移和肝转移密切相关。SAUKKONEN等[7]发现,胰腺导管腺癌中REG4的表达与肿瘤的组织学分级有关,且在肿瘤ⅠA~ⅡA期中,REG4血清水平高的患者生存期较差。本研究发现,过表达REG4的卵巢癌细胞侵袭增强。HE等[8]发现,REG4蛋白能诱导基质金属蛋白酶7和基质金属蛋白酶9两种细胞侵袭因子表达上调。此外,本研究中REG4高表达的卵巢癌患者的总体生存率、无进展生存率和后进展生存率较低,且复发性卵巢癌患者REG4的表达高于原发性卵巢癌患者。以上数据表明,REG4可能参与卵巢癌的侵袭和转移,并因此降低卵巢癌患者的生存率。
本研究中,REG4相关基因表达分析发现,REG4与ALDH1A1、GSTA1、GSTA2、UGT2A3等药物代谢相关酶的表达呈正相关,基因富集分析显示,REG4与药物代谢细胞色素P450相关基因密切相关。JIN等[9-10]发现,REG4蛋白能够调控Hsp27、Bcl-2的表达以及多种酪氨酸激酶受体等关键信号分子的激活,从而介导肿瘤细胞对化疗药物的耐受作用。总之,REG4不利于肿瘤的药物治疗。
综上所述,REG4能够促进肿瘤细胞周期进程、增殖和侵袭,抵抗凋亡,并能够提高肿瘤细胞对化疗药物的耐受水平,与卵巢癌的不良预后密切相关,可作为卵巢癌早期诊断、预后评价和晚期基因治疗一个新的分子靶点,以提高卵巢癌患者生存率和生存质量。
| [1] |
HARUTA S, FURUKAWA N, YOSHIZAWA Y, et al. Molecular genetics and epidemiology of epithelial ovarian cancer (Review)[J]. Oncol Rep, 2011, 26(6): 1347-1356. DOI:10.3892/or.2011.1456 |
| [2] |
KÄMÄRÄINEN M, HEISKALA K, KNUUTILA S, et al. RELP, a novel human REG-like protein with up-regulated expression in inflammatory and metaplastic gastrointestinal mucosa[J]. Am J Pathol, 2003, 163(1): 11-20. DOI:10.1016/S0002-9440(10)63625-5 |
| [3] |
李想, 张雪晴, 尹天琦, 等. Reg蛋白作为新型药物的研发进展[J]. 药学进展, 2018, 42(3): 231-237. |
| [4] |
ZHANG N, CHAI D, DU H, et al. Expression of Reg Ⅳ and SOX9 and their correlation in human gastric cancer[J]. BMC Cancer, 2018, 18(1): 344. DOI:10.1186/s12885-018-4285-x |
| [5] |
BISHNUPURI KS, SAINATHAN SK, BISHNUPURI K, et al. Reg4-induced mitogenesis involves Akt-GSK3β-β-Catenin-TCF-4 signaling in human colorectal cancer[J]. Mol Carcinog, 2014, 53(Suppl 1): E169-E180. DOI:10.1002/mc.22088 |
| [6] |
OUE N, MITANI Y, AUNG PP, et al. Expression and localization of Reg Ⅳ in human neoplastic and non-neoplastic tissues:Reg Ⅳ expression is associated with intestinal and neuroendocrine differentiation in gastric adenocarcinoma[J]. J Pathol, 2005, 207(2): 185-198. DOI:10.1002/path.1827 |
| [7] |
SAUKKONEN K, HAGSTRÖM J, MUSTONEN H, et al. Prognostic and diagnostic value of REG4 serum and tissue expression in pancreatic ductal adenocarcinoma[J]. Tumour Biol, 2018, 40(3): 1010428318761494. DOI:10.1177/1010428318761494 |
| [8] |
HE XJ, JIANG XT, MA YY, et al. REG4 contributes to the invasiveness of pancreatic cancer by upregulating MMP-7 and MMP-9[J]. Cancer Sci, 2012, 103(12): 2082-2091. DOI:10.1111/cas.12018 |
| [9] |
JIN J, LV H, WU J, et al. Regenerating family member 4(Reg4) enhances 5-fluorouracil resistance of gastric cancer through activating MAPK/Erk/Bim signaling pathway[J]. Med Sci Monit, 2017, 23: 3715-3721. DOI:10.12659/msm.903134 |
| [10] |
ZHANG XQ, YU LT, DU P, et al. Single-chain antibody against Reg4 suppresses gastric cancer cell growth and enhances 5-FU-induced cell death in vitro[J]. Anticancer Agents Med Chem, 2019, 19(5): 610-619. DOI:10.2174/1871520619666181122104720 |
 2020, Vol. 49
2020, Vol. 49