文章信息
- 周博, 赵兴, 付佳琳, 郭晓临
- ZHOU Bo, ZHAO Xing, FU Jialin, GUO Xiaolin
- 乳糜泻易感基因及血清特异性自身抗体在有相关症状儿童中的检出情况
- Detection of celiac disease susceptive genes and serum-specific autoantibodies in children with related symptoms
- 中国医科大学学报, 2020, 49(1): 67-70
- Journal of China Medical University, 2020, 49(1): 67-70
-
文章历史
- 收稿日期:2019-05-08
- 网络出版时间:2019-12-12 10:28
2. 中国医科大学附属第一医院儿科, 沈阳 110001
2. Department of Pediatrics, The First Hospital, China Medical University, Shenyang 110001, China
乳糜泻(celiac disease,CD)是一种由于个体携带易感基因HLA-DQ (包括HLA-DQ2.2、HLA-DQ2.5和HLA-DQ2.8)而引起的麦麸物质(主要是麸质)敏感性肠病,该基因产物介导麸质蛋白在小肠中诱发一系列自身免疫反应,引起小肠黏膜损伤[1]。CD患者可表现出典型的吸收障碍症状和体征,也可表现出肠外非典型症状,如发育不良、骨质疏松等[1]。小肠组织活检发现典型病理变化即可诊断CD,但是由于小肠活检属于有创性检查且难以实现,因此需应用特异性血清抗体检测进行初步筛查,包括抗肌内膜(endomysial antibody,EMA)抗体、抗组织型转谷氨酰胺酶(tissue transglutaminase,tTG)抗体和抗麦胶蛋白(gliadin,GAF)抗体[2]。如果有条件,可同时进行HLA-DQ2和HLA-DQ8基因分型检测。若抗体与基因同时阳性,即为CD疑似病例,建议行小肠活检或随访[3]。CD确诊后,最有效的治疗方法是立即开始无麸质饮食,大多数患者都能够通过无麸质饮食改善临床症状,修复损伤的小肠黏膜[4]。
CD曾被认为发病主要集中在欧美人群[5]。该病对儿童的影响巨大,他们处在身体发育的关键阶段,如果得不到及时的诊断和治疗,生长发育和心理健康都会受到严重影响,所以CD在欧美被定义为公共卫生问题[6]。我国在这方面的研究报道非常有限[7],目前尚无关于儿童CD的系统性临床研究。因此,本研究通过调查在具有1种或多种CD相关肠内和肠外症状的儿童中易感基因及特异性自身抗体的检出情况,分析其中的CD疑似病例,提示临床应完善CD相关检查,提高对CD的重视。
1 材料与方法 1.1 试剂与仪器基因组DNA提取试剂盒(北京天根);抗EMA抗体、抗tTG抗体、抗GAF抗体检测试剂盒(ELISA法);HLA-DQ2和HLA-DQ8核酸检测试剂盒(微阵列法)、微阵列芯片自动判读仪(德国欧蒙);System9700 PCR仪(美国ABI)。
1.2 研究对象连续收集在2018年7月至9月间于中国医科大学附属第一医院儿科门诊就诊的有CD肠内及肠外症状[8]的儿童152例作为症状组,收集26例健康或无相关症状的儿童作为对照组。
1.3 方法 1.3.1 HLA-DQ基因检测使用全血细胞基因组DNA提取试剂盒提取基因组DNA,要求浓度不低于20 ng/μL,260 nm/280 nm要求在1.6~1.8之间。将DNA用配套的PCR mix进行目的片段(HLA-DQ2.2、HLA-DQ2.5及HLA-DQ8)扩增,25 μL反应体系(5 μL DNA+20 μL PCR mix)。使用PCR仪进行基因扩增:95 ℃ 5 min,变性95 ℃ 15 s,退火60 ℃ 15 s,延伸72 ℃ 20 s,37个循环,72 ℃ 10 min,8 ℃终止,之后将扩增产物按说明进行微阵列基因芯片检测,并使用芯片判读仪进行结果判读。
1.3.2 血清特异性自身抗体检测使用ELISA试剂对抗tTG抗体和抗GAF抗体进行定量检测,包括IgA和IgG。使用间接免疫荧光试剂对血清抗EMA抗体进行定性检测,应用荧光显微镜进行镜下阅片。
1.4 统计学分析使用SPSS 24.0软件进行统计学分析。症状组与对照组间易感基因及各类抗体检出率(%)的比较采用χ2检验,当理论频数 > 5时,采用Pearson χ2检验;当期待频数 < 5时,采用Fisher确切概率分析。P < 0.05为差异有统计学意义。
2 结果 2.1 HLA-DQ基因的检出情况症状组152例患儿中共检出44例基因阳性,总检出率为28.95%,其中以HLA-DQ2.2为主(16.45%)。4例患儿同时携带HLA-DQ2.2和HLA-DQ2.5,在计算携带2个等位基因的病例总数时,这4例患儿仅计1次,因此携带HLA-DQ2(HLA-DQ2.2+ HLA-DQ2.5)的患儿总数为32例,HLA-DQ2的总检出率为21.05%,高于HLA-DQ8 (7.89%)。对照组26例儿童中各基因型的检出情况与症状组相似。2组间各基因型的检出率无统计学差异。见表 1。
| Gene | Symptom group (n = 152) | Control group (n = 26) | P |
| HLA-DQ2.2 | 25(16.45) | 2(7.69) | 0.376 8 |
| HLA-DQ2.5 | 11(7.24) | 1(3.85) | > 0.999 9 |
| HLA-DQ2.2+HLA-DQ2.5 | 32(21.05) | 3(11.54) | 0.421 9 |
| HLA-DQ8 | 12(7.89) | 2(7.69) | > 0.999 9 |
| Total | 44(28.95) | 5(19.23) | 0.352 4 |
2.2 血清特异性自身抗体的检出情况
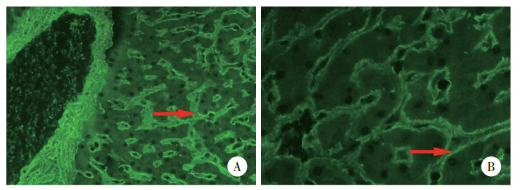
对症状组152例患儿的血清特异性自身抗体进行检测。抗EMA抗体的检出率最高,为12.5% (19/152)。荧光显微镜下抗EMA抗体阳性时,肝组织中可见肝血窦周围基底膜出现连续荧光,在高倍镜下呈连续的线性荧光,为EMA沉积(图 1)。抗tTG抗体和抗GAF抗体的检出率均为2.63% (4/152)。而在对照组中,3类抗体的检出率均为0%。当3类抗体同时检测时,症状组抗体的总检出率为17.76% (27/152),与对照组比较,差异有统计学意义(P = 0.015 8)。说明CD相关症状的出现与患儿体内存在的麸质相关自身免疫反应有关。
|
| A,basement membrane around the hepatic sinusoid is shown to be full of continuous fluorescence (×20);B,arrow shows continuous linear fluorescence around the hepatic sinusoid (×40). 图 1 荧光显微镜下抗EMA抗体阳性的典型表现 Fig.1 Typical patterns of anti-endomysium antibody positive cells under a fluorescence microscope |
2.3 根据易感基因和抗体检出情况分析CD疑似病例
症状组44例携带易感基因HLA-DQ2/HLA-DQ8的患儿中,共检出7例抗体阳性,抗体检出率为15.9% (7/44);未携带易感基因的108例患儿中,共检出20例抗体阳性,抗体检出率为18.52% (20/108);2组间抗体检出率无统计学差异(P = 0.817 2)。因此,携带易感基因未必引起CD相关的免疫反应,还应考虑儿童的饮食和生活习惯,以及家族遗传史等因素。
7例抗体与基因同时阳性的患儿中,表现为不明原因腹痛3例,身材矮小2例,呕吐和消化不良各1例,均为典型的CD相关症状,高度疑似CD (表 2)。
| No. of cases | Sex | Age | Symptom | Positive antibody | HLA-DQ genotype |
| 1 | Female | 8 years | Abdominalgia | EMA-IgG | HLA-DQ2.2 |
| 2 | Female | 11 years | Abdominalgia | EMA-IgG | HLA-DQ8 |
| 3 | Male | 15 years | Abdominalgia | EMA-IgA | HLA-DQ8 |
| 4 | Female | 4 years | Vomit | tTG-IgA | HLA-DQ2.2 |
| 5 | Female | 3 years | Short Stature | EMA-IgA | HLA-DQ2.5 |
| 6 | Male | 4 years | Short Stature | EMA-IgA | HLA-DQ2.5 |
| 7 | Male | 10 months | Dyspepsia | EMA-IgG | HLA-DQ8 |
3 讨论
CD是与食物材料中含有的麸质有关的一种特殊的紊乱状态,通常与易感基因HLA-DQ2或HLA-DQ8相关,会形成一种特殊且隐匿的自身免疫反应,造成隐窝增生、绒毛萎缩和炎症细胞浸润等小肠黏膜损伤,以及其他器官的功能损害[6]。1990至2009年间苏格兰儿童新发的CD病例数量增长了6倍,一方面说明随着检验技术和临床认识的进步,越来越多的CD儿童得到了诊断,另一方面也表明,在儿童群体中可能存在着巨大的漏诊率[9]。我国目前虽无系统的研究报道,但是CD散发病例报道逐渐增多,中国人群的基因和抗体携带率都高于预期[10]。CHOUNG等[5]通过对社区儿童进行的队列研究发现,1.1%的儿童可能患上CD而未能被诊断出来,其中10.8%在5年后都被确诊为CD。目前在我国,CD尚未得到足够的重视,针对儿童的调查研究更是稀有。
本研究从贴近临床的角度,分析了在具有CD相关肠内、肠外症状的儿童中,CD易感基因HLA-DQ2和HLA-DQ8的携带情况。结果发现,症状组与对照组易感基因检出率无统计学差异,但仍高于YUAN等[7]推测出的辽宁地区青年人群易感基因检出率,这可能是由于本研究样本量较为局限,无法进行人群差异分析。若想更准确地了解易感基因在本地区的携带情况,应进行大规模、多中心的流行病学调查研究。
在有症状患儿中,有17.76%的病例检出自身抗体阳性,且这个比例显著高于对照组,因此可以确定,CD相关症状的出现与体内存在CD相关的自身免疫反应有关。将抗EMA抗体、抗tTG抗体和抗GAF抗体3类抗体联合检测,可有效分辨CD相关症状的出现与自身免疫反应的相关性。因此,这种自身免疫反应的存在应该被视为CD的重要危险因素之一,对此类患者应进行动态监测及随访观察。
目前筛查CD的重要手段,是对有相关症状的患者进行特异性自身抗体检测。抗体阳性的患者,若同时携带易感基因,那么其患病风险就会明显增加。当抗体浓度足够高时,甚至不需要小肠组织活检即可诊断CD[3]。由易感基因导致的CD,通常是一个缓慢的过程,且受多种外界因素影响,如麸质的摄入、母乳喂养方式或者肠道菌群改变等[11]。但是还有一些CD患者并不携带该基因,一项大型的全基因组关联分析研究结果显示,IL-2、IL-22、CD80、CCR4等基因的改变也可能参与CD的形成[12-14],这对传统的CD诊断试图依靠HLA-DQ基因检测来阴性排除CD形成了挑战。本研究发现,在27例抗体阳性的患儿中仅有7例同时检出了CD基因,其余20例出现CD相关自身免疫反应的病例原因无法确定,可能与这种情况有关。而据研究[15]报道,CD相关自身抗体阳性特别是抗EMA抗体阳性时,约有28%的病例可能进展为CD,因此这种自身免疫反应的存在应该被视为CD的重要危险因素之一,对此类患者应持续关注。
CD患者一旦明确诊断,应立即开始无麸质饮食,这能够从根本上改善患者症状。对于抗体阳性但不足以诊断为CD的患者,如果进行无麸质饮食,可缓解相关的症状,而如果任其发展,将有可能进展为CD[16]。本研究检测到的7例抗体与基因同时阳性的患儿虽缺乏“金标准”小肠黏膜活检的支持,但已能够说明这些患儿高度疑似CD,有必要进行小肠活检确诊,或开始无麸质饮食进行试验性治疗。临床医生在面对具有CD典型症状且原因不明的临床患者时,非常有必要将CD纳入临床诊断的考虑范围内,完善相关的实验室诊断检查。
综上所述,CD易感基因HLA-DQ2和HLA-DQ8在有相关症状的儿童中有一定的检出率,且其中有一定比例的儿童检出CD特异性自身抗体阳性,属于CD疑似病例。建议对此类患儿完善相关检查,尽早明确诊断并实施有效的治疗,促进儿童的健康成长。
| [1] |
LUDVIGSSON JF, LEFFLER DA, BAI JC, et al. The Oslo definitions for coeliac disease and related terms[J]. Gut, 2013, 62(1): 43-52. DOI:10.1136/gutjnl-2011-301346 |
| [2] |
HOLMES G, CIACCI C. The serological diagnosis of coeliac disease-a step forward[J]. Gastroenterol Hepatol Bed Bench, 2018, 11(3): 209-215. |
| [3] |
BAI JC, CIACCI C. World gastroenterology organisation global guidelines:celiac disease February 2017[J]. J Clin Gastroenterol, 2017, 51(9): 755-768. DOI:10.1097/MCG.0000000000000919 |
| [4] |
GREEN PH, JABRI B. Coeliac disease[J]. Lancet, 2003, 362(9381): 383-391. DOI:10.1016/s0140-6736(03)14027-5 |
| [5] |
CHOUNG RS, LARSON SA, KHALEGHI S, et al. Prevalence and morbidity of undiagnosed celiac disease from a community-based study[J]. Gastroenterology, 2017, 152(4): 830-839. DOI:10.1053/j.gastro.2016.11.043 |
| [6] |
HUSBY S, KOLETZKO S, KORPONAY-SZAB IR, et al. European Society for Pediatric Gastroenterology, Hepatology, and Nutrition guidelines for the diagnosis of coeliac disease[J]. J Pediatr Gastroenterol Nutr, 2012, 54(1): 136-160. DOI:10.1097/MPG.0b013e31821a23d0 |
| [7] |
YUAN JL, GAO JY, LI X, et al. The tip of the "celiac iceberg" in China:a systematic review and meta-analysis[J]. PLoS One, 2013, 8(12): e81151. DOI:10.1371/journal.pone.0081151 |
| [8] |
VRIEZINGA SL, SCHWEIZER JJ, KONING F, et al. Coeliac disease and gluten-related disorders in childhood[J]. Nat Rev Gastroenterol Hepatol, 2015, 12(9): 527-536. DOI:10.1038/nrgastro.2015.98 |
| [9] |
WHITE LE, MERRICK VM, BANNERMAN E, et al. The rising incidence of celiac disease in Scotland[J]. Pediatrics, 2013, 132(4): e924-e931. DOI:10.1542/peds.2013-0932 |
| [10] |
YUAN JL, ZHOU CY, GAO JY, et al. Prevalence of celiac disease autoimmunity among adolescents and young adults in China[J]. Clin Gastroenterol Hepatol, 2017, 15(10): 1572-1579. DOI:10.1016/j.cgh.2017.04.025 |
| [11] |
CATASSI C, GATTI S, FASANO A. The new epidemiology of celiac disease[J]. J Pediatr Gastroenterol Nutr, 2014, 59(Suppl 1): S7-S9. DOI:10.1097/01.mpg.0000450393.23156.59 |
| [12] |
GARNER C, AHN R, DING YC, et al. Genome-wide association study of celiac disease in North America confirms FRMD4B as new celiac locus[J]. PLoS One, 2014, 9(7): e101428. DOI:10.1371/journal.pone.0101428 |
| [13] |
PLAZA-IZURIETA L, CASTELLANOS-RUBIO A, IRASTORZA I, et al. Revisiting genome wide association studies (GWAS) in coeliac disease:replication study in Spanish population and expression analysis of candidate genes[J]. J Med Genet, 2011, 48(7): 493-496. DOI:10.1136/jmg.2011.089714 |
| [14] |
GARNER CP, MURRAY JA, DING YC, et al. Replication of celiac disease UK genome-wide association study results in a US population[J]. Hum Mol Genet, 2009, 18(21): 4219-4225. DOI:10.1093/hmg/ddp364 |
| [15] |
COLLIN P, HELIN H, MKI M, et al. Follow-up of patients positive in reticulin and gliadin antibody tests with normal small-bowel biopsy findings[J]. Scand J Gastroenterol, 1993, 28(7): 595-598. DOI:10.3109/00365529309096094 |
| [16] |
KURPPA K, ASHORN M, ILTANEN S, et al. Celiac disease without villous atrophy in children:a prospective study[J]. J Pediatr, 2010, 157(3): 373-380, 380.e1. DOI:10.1016/j.jpeds.2010.02.070 |
 2020, Vol. 49
2020, Vol. 49